Wearables: Rhythm diagnostics and beyond
Autoren:
Diego Mannhart
Dr. med. Simon von Gunten
PD Dr. med. Patrick Badertscher
Universitäres Herzzentrum Basel Universitätsspital Basel
E-Mail: patrick.badertscher@usb.ch
Tragbare Monitorsysteme zur Registrierung und Verarbeitung von Vitalparametern, sogenannte «Wearables», erfreuen sich auch in der Schweizer Bevölkerung grosser Beliebtheit. Die elektronischen Alltagsgeräte wurden innert kürzester Zeit von Informations- zu Lifestyle-, Kommunikations- und medizinischen Diagnosegeräten, sodass wir Medizinerinnen und Mediziner im Alltag zusehends mit Diagnosen und Daten von solchen Wearables konfrontiert werden.
Im Frühling 2023 besassen 96% der Schweizer Bevölkerung ein Smartphone und gut ein Drittel ein Wearable.1 Das bekannteste und zugleich am meisten verbreitete Produkt in der Schweiz ist wohl die Apple Watch mit einem Marktanteil von knapp 40%.2 Die Apple Watch bietet Nutzenden seit 2018 (4. Generation) die Möglichkeit, den Herzrhythmus in Form eines 1-Kanal-EKGs aufzuzeichnen, und hat hierfür in den USA gar eine Freigabe der Food and Drug Administration (FDA) erhalten.
Was sind Wearables?
Unter Wearables versteht man eine Technologie, heutzutage hauptsächlich Computersysteme, welche in die Kleidung integriert oder am Körper getragen wird und welche auf die nutzende Person bezogene Daten registriert und ggf. verarbeitet. Im Jahr 1961 legte Norman Holter, ein amerikanischer Biophysiker, mit seiner Publikation «New method for heart studies» über den nach ihm benannten portablen EKG-Rekorder nicht nur den Grundstein zur tragbaren Rhythmusdiagnostik, sondern schuf in gewisser Weise auch ein «Wearable», wenn auch im entferntesten Sinne.3 Der Begriff «Wearables», wie wir ihn heute verwenden, beinhaltet alle Formen von Technologie, welche so entwickelt wurde, dass sie im Alltag bequem getragen werden kann und so fortlaufend Daten über uns und unserer Umgebung registriert.
Im Vergleich zu herkömmlich verwendeten Monitorstrategien wie portablen Blutdruckmessgeräten, Fieberthermometern, Blutzucker-Messgeräten/Patches, Holter-EKGs oder implantierbaren Ereignisrekordern («Loop-Recorder») sind massentaugliche Wearables für Endnutzer günstiger, angenehmer zu tragen und bieten auch einen persönlichen Anreiz durch den vermeintlichen Nutzen sowie die Auswertung von erhobenen Daten über den eigenen Körper- oder Trainingszustand. Es ist davon auszugehen, dass Wearables in Zukunft, wie die Mobiltelefone, in der Bevölkerung weit verbreitet sein werden. Smartwatches haben unsere traditionellen Schweizer Armbanduhren in den Verkaufszahlen längst überholt.6
Besonders Uhren erfreuen sich enormer Beliebtheit in der Gesellschaft, da sie unauffällig, bequem und in den meisten Alltagssituationen ohne Einschränkung oder Stigmatisierung getragen und benutzt werden können. Ein 1-Kanal-EKG beispielsweise kann durch einfaches Berühren der Krone einer Smartwatch mit dem Zeigefinger über 30s aufgezeichnet werden. Die «Smartwatches» sind mit Algorithmen ausgestattet, welche automatisiert Vorhofflimmern (VHF) detektieren können. Wearables sind bereits fester Bestandteil im Alltag, sodass auch in der Medizin immer mehr auf die Diagnostik durch Wearables gesetzt wird und sogar Leitlinien entsprechend angepasst werden. So wurde beispielsweise in den im Jahr 2020 erschienenen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) zur Diagnose und Behandlung von Vorhofflimmern die Diagnostik durch Wearable-basierte 1-Kanal-EKGs ergänzt.4
Wearables in der Kardiologie
Seit dem ersten Holter-EKG im Jahr 1961 entwickelten sich die Wearables zur Rhythmusdiagnostik insbesondere in den letzten drei Jahrzehnten rasant: Zu Beginn der 1990er-Jahre wurde der erste Schrittmacher mit digitaler Signalverarbeitung implantiert.7 1994 gab es die erste Armbanduhr mit 1-Kanal-EKG zur Erfassung von einzelnen Events. 2013 kam mit dem KardiaMobile ein mit dem Smartphone koppelbares 1-Kanal-EKG auf den Markt, womit Echtzeit-Aufzeichnungen des eigenen Herzrhythmus erstellt und versendet werden konnten.8 Mit den Smartwatches ab circa 2013, bestückt mit eigener Software und Prozessoren sowie Applikationen zur Auswertung von Rhythmusaufzeichnungen, wurden die jederzeit mögliche Herzrhythmusaufzeichnung und vor allem -analyse entscheidend vorangetrieben. Ab 2018 konnten dann erstmals auf dem regulären Markt Wearables erworben werden, welche den Herzrhythmus aufzeichneten und durch integrierte Algorithmen unmittelbar – innert Sekunden – analysierten. Die unabhängig von einer medizinischen Indikation ausgewählten Wearables wurden von der FDA freigegeben, erhielten eine CE-Zertifizierung und erlangten somit den Status von medizinisch nutzbaren Geräten und Applikationen. Seither wurden Algorithmen und Aufzeichnung stetig verbessert, es wurde künstliche Intelligenz zur zusätzlichen Analyse getestet und die Möglichkeiten, Grenzen und Limitationen der Technologie wurden in zahlreichen Studien beschrieben.
Die Möglichkeit der Selbstdiagnostik
Spots für Smartwatches werben aktiv damit, dass Endnutzende jederzeit, schnell und unkompliziert ein EKG aufzeichnen können. Während früher nur der Gang zum Arzt oder zur Ärztin die Abklärung einer möglichen Herzrhythmusstörung ermöglichte, wobei dies eine ausführliche Anamneseerhebung und körperliche Untersuchung umfasste, erlebt die Medizin einen Paradigmenwechsel: Diagnostik muss nicht mehr durch medizinisches Personal initiiert werden, sondern Patientinnen und Patienten konfrontieren uns heutzutage oft mit einer durch sie initiierten Diagnostik. Bei einem Anteil von 31% Wearable-nutzenden Personen in der Schweizer Bevölkerung (zum Vergleich: 78,1% der Weltbevölkerung und 96% der Schweizer Bevölkerung besitzen ein Smartphone) ist eine zusätzliche Belastung des Gesundheitssystems durch diese «consumer-initiated» Diagnostik in naher Zukunft vorhersehbar bzw. in gewissen Ländern bereits Alltag.1
Möglichkeiten der Anwendung zur Rhythmusdiagnostik
Vorhofflimmern
Die Hersteller der Wearables zielen darauf ab, eine FDA-Zulassung und/oder eine CE-Zertifizierung zur Diagnostik von Vorhofflimmern (VHF) zu erhalten. Dies mit gutem Grund: Das Risiko für einen Hirnschlag als häufigste Komplikation dieser Herzrhythmusstörung kann durch orale Antikoagulation reduziert werden, sofern sie vor dem Auftreten des Hirnschlags detektiert wird, denn in circa 30% der Schlaganfälle könnte in den 30 Tagen vor dem Ereignis ein subklinisches VHF festgestellt werden.9
Seit der Herausgabe der ESC-Leitlinien 2020 ist es möglich, die Diagnose Vorhofflimmern neben dem herkömmlichen 12-Kanal-EKG auch durch ein 1-Kanal-EKG über mindestens 30 Sekunden zu bestätigen. Die ESC-Leitlinien empfehlen zudem ein opportunistisches VHF-Screening bei Menschen mit Hypertonie (Klasse-I-Empfehlung). Weiter erwägen die Leitlinien das VHF-Screening bei Patienten, welche an einem Schlafapnoe-Syndrom leiden (Klasse-IIa-Empfehlung).4
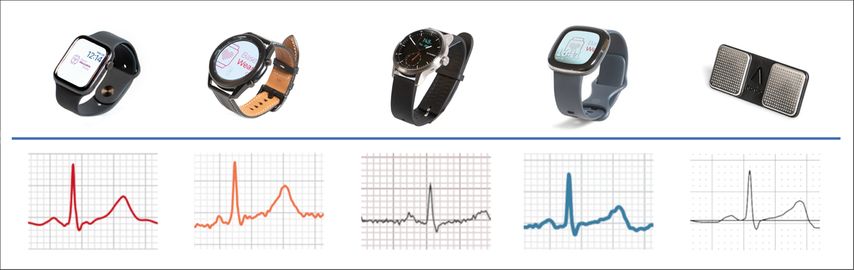
Was bei paroxysmalem VHF für Patientinnen und Patienten eine ideale Option zur Erfassung einer ansonsten schwierig zu erhebenden/zu verifizierenden Diagnose ist, kann durch Wearables günstig und mit relativ hoher Sensitivität diagnostiziert werden, und dies relativ unabhängig davon, welches der immer zahlreicher werdenden Geräte mit FDA-Freigabe oder CE-Zertifizierung verwendet wird.10 Eine Übersicht bietet Abbildung 1.
Abb. 1: Übersicht über einige in der Schweiz verfügbare Smartwatches mit 1-Kanal-EKG-Funktion und automatisierter Erkennung von Vorhofflimmern
Vorhofflattern
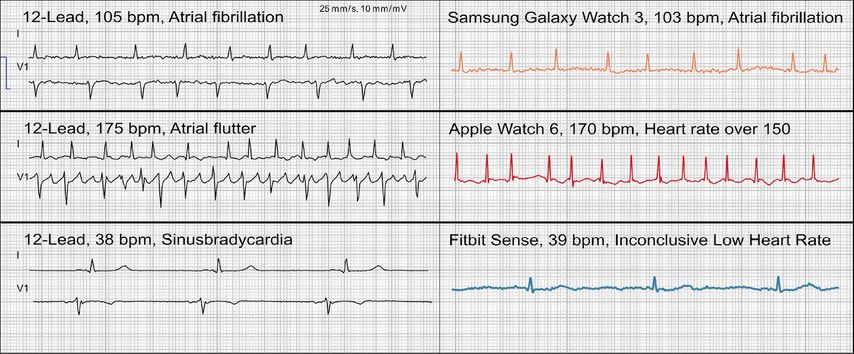
Vorhofflattern aufzuzeichnen ist für Wearables keine Herausforderung, die automatisierte oder manuelle Interpretation jedoch schon. Smartwatches bieten den Nutzenden bei herkömmlicher Anwendung eine Aufzeichnung von 30s einer Einthoven-I-Ableitung an. Vorhofflattern kann in dieser Ableitung bei möglicherweise geringer Amplitude schlecht diagnostiziert werden. Abhilfe kann durch eine Modifikation der Aufzeichnungsweise geschaffen werden: Durch die Positionierung des Wearables auf dem linken Knöchel oder in der linken Leistenregion (d.h. der Position der F-Elektrode im 12-Kanal-EKG) kann eine Einthoven-II-Ableitung erzeugt werden.11 So lässt sich die Aufzeichnung zwar nicht durch den automatisierten Algorithmus (dieser bietet Vorhofflattern nicht als Diagnosemöglichkeit an), jedoch durch das geschulte Auge relativ gut diagnostizieren. Die Möglichkeiten und Grenzen der Diagnose von Rhythmusstörungen sind anhand einiger Beispiele in Abbildung 2 dargestellt.
Abb. 2: Die Möglichkeiten und Grenzen der Rhythmusdiagnostik werden anhand einiger Fallbeispiele gezeigt. Links ist jeweils ein 12-Kanal-EKG zu sehen (Goldstandard) und rechts ein zeitgleich aufgenommenes 1-Kanal-EKG. Im ersten Beispiel von oben erkennt die Uhr richtigerweise ein Vorhofflimmern. Im zweiten Beispiel ist zu sehen, dass für die Uhr eine Detektion von Vorhofflattern nicht möglich ist. Das dritte Beispiel illustriert, dass die meisten Uhren mit zu hohen oder (wie hier) zu niedrigen Herzfrequenzen an ihre Grenzen stossen. Im untersten Beispiel liegt ein falsch negatives Ergebnis vor. Sensitivität und Spezifität der Uhr bei der Erkennung von Vorhofflimmern sind hoch, betragen aber nicht 100%
Paroxysmale supraventrikuläre Tachykardien, das «Herzrasen»
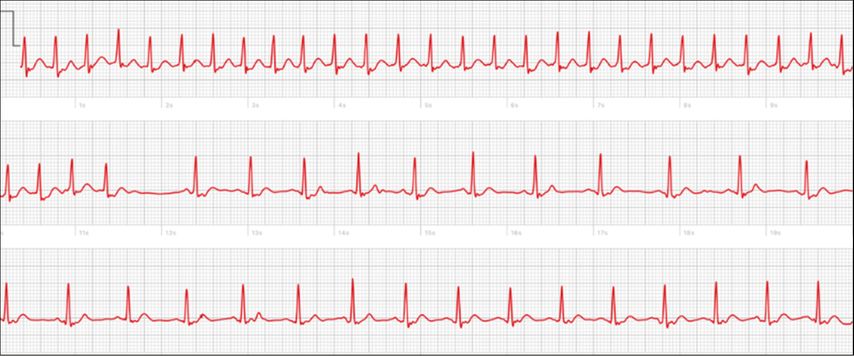
«Plötzlich raste mein Herz und ich habe Angst bekommen.» Eine Aussage wie diese ist oft Grund genug, sich in ärztliche Abklärung zu begeben, wobei das daraufhin aufgezeichnete EKG trotz eindrücklicher subjektiver Symptomatik häufig keinen wegweisenden Befund zeigt. Hier ergibt sich mit den Wearables eine sehr grosse Chance. Besonders bei der jüngeren Generation, den «Digital Natives», ergibt sich die Gelegenheit zur Detektion von ansonsten nur sehr aufwendig und bislang oft nur durch Verknüpfung von passendem Zeitpunkt und verfügbarer Diagnostik zu entdeckenden Herzrhythmusstörungen. Hierunter fallen beispielsweise paroxysmale supraventrikuläre Tachykardien, wovon 60% auf AV-Knoten-Reentry-Tachykardien (AVNRT), 30% auf AV-Reentry-Tachykardien (AVRT) und 10% auf atriale Tachykardien zurückzuführen sind.12 Mit den neuen Möglichkeiten kann ein plötzlich einsetzendes Herzrasen innert Sekunden nach Symptombeginn dokumentiert werden, selbst wenn es nur wenige Minuten anhält. Dank Wearables kann die diagnostische Lücke erfolgreich geschlossen werden.13 Abbildung 3 zeigt ein Fallbeispiel.
Abb. 3: Erfolgreiche Aufzeichnung einer Schmalkomplextachykardie, welche im Verlauf gar terminiert. Klagen Betroffene über ein plötzlich einsetzendes Herzrasen, kann dieses innert Sekunden dokumentiert werden, selbst wenn es wie hier nur kurz anhält. Dank Wearables kann die diagnostische Lücke erfolgreich geschlossen werden
QTc-Intervall
Das Kardia 6L als «Multilead-Device» besitzt als einziges Gerät dieser Art die Zulassung der FDA zur Messung des QT-Intervalls.14 Die Withings-Scanwatch bietet als einziges Wearable 1-Kanal-EKG-Aufzeichnungen mit integrierter Messung der QT-Zeit im Algorithmus. Hierdurch könnten Long-QT-Syndrome (LQTS), welche ventrikuläre Arrythmien (TdP) oder plötzlichen Herztod (SCD) mit sich bringen könnten, detektiert werden.15,16 LQTS können kongenitalen Ursprungs oder erworben sein. Die Wearables bieten die Möglichkeit, auf ein LQTS hinzuweisen, welches beispielsweise transient auf eine Elektrolytstörung zurückzuführen ist17 oder durch die Einnahme von QT-verlängernden Medikamenten hervorgerufen wird.18 Insbesondere in letzterem Fall ist eine Überwachung des Intervalls ratsam und je nach Resultat eine Anpassung der Medikation vorzunehmen.19 Wearables spielen hier in Zukunft möglicherweise eine wichtige Rolle.20 Eine entsprechend suffiziente Möglichkeit zum QT-Monitoring via 1-Kanal-EKG liegt bislang jedoch nicht vor und bei den meisten durch Wearables aufgezeichneten 1-Kanal-EKGs muss das QT-Intervall selbst nachgemessen werden. Das 12-Kanal-EKG ist bis dato die einzige verlässliche Monitoringstrategie, um die QT-Dispersion zu erfassen und eine Über- oder Unterschätzung der QT-Zeit, wie dies beim Monitoring durch ein 1-Kanal-EKG entstehen könnte, zu vermeiden. Insgesamt bleibt eine relevante Untersucherabhängigkeit bestehen.21
Was wir in Zukunft von den Wearables erwarten können
Wearables bieten ein enormes Potenzial, das Forschende weltweit aktuell stark beschäftigt. Neben Sturzprävention und -detektion, Medikationseinnahme, Schlafüberwachung sowie Aktivitäts- und Bewegungsstudien werden aktuell auf keinem anderen Gebiet wie der Rhythmusdiagnostik so viele Studien mit Wearables durchgeführt.22
Eine Frage, die sich wohl jede Person in diesem Zusammenhang stellt: Kann man mit einem Wearable einen Herzinfarkt diagnostizieren? Kurz: Theoretisch ist dies möglich und wurde in Studien und Fallberichten bereits umgesetzt. Durch geschicktes Platzieren der Smartwatch an den Referenzpunkten des normalen 12-Kanal-EKG können vergleichbare Aufzeichnungen dokumentiert werden,23–25 wobei eine gleichzeitige Aufzeichnung von mehr als einem Kanal mit herkömmlichen Smartwatches technisch nicht machbar ist. Geräte wie das bereits erwähnte Kardia 6L bieten mehr als zwei Kontaktpunkte an und ermöglichen somit die gleichzeitige Dokumentation von mehr als einer Ableitung,14 womit auch Rhythmusstörungen wie das Brugada-Syndrom, hypertrophe Kardiomyopathien und ARVC/D («arrhythmogenic right ventricular cardiomyopathy/dysplasia») dokumentiert wurden.16 Solch experimentelle Aufzeichnungen sind im Rahmen von Studien bislang gut machbar, bedürfen jedoch einer genauen Instruktion, Überwachung der Aufzeichnung sowie ggf. der Unterstützung durch Drittpersonen, um eine suffiziente Qualität zu garantieren.16
Künstliche Intelligenz bei Wearables
Eine Herausforderung, mit welcher sowohl Hausärztinnen und -ärzte als auch Kardiologinnen und Kardiologen bereits heute konfrontiert werden, ist die stetig steigende Zahl obgenannter patienteninitiierter Konsultationen. Etwa 17–26% der 1-Kanal-EKGs, welche durch den automatisierten Algorithmus interpretiert werden, sind «inkonklusiv».10 Der Algorithmus ist nicht imstande, aufgrund der aufgezeichneten Parameter eine suffiziente Interpretation zu generieren. Dies kann verschiedene Gründe haben, welche im Abschnitt «Limitationen und Chancen» erläutert werden. Inkonklusive Befunde sind für Endnutzende jedoch oft Grund zur Besorgnis. Um nicht bei jedem dieser nicht automatisiert zu interpretierenden EKG eine Fachperson zuziehen zu müssen, bietet die künstliche Intelligenz eine Möglichkeit, die Vortestwahrscheinlichkeit zu erhöhen und dem Patienten bei ursprünglich unklarem Resultat eine erneute Aufzeichnung oder Ungewissheit zu ersparen. Für Fachpersonal bedeutet die Integrierung eines Algorithmus mit künstlicher Intelligenz eine Reduktion der Zahl an unschlüssigen Resultaten und somit möglicherweise eine Reduktion der dadurch generierten patienteninitiierten Konsultationen bei gleichbleibender Genauigkeit der automatisierten Interpretation.26 Wieso nicht bereits auf jeder Smartphone-Applikation und jeder Smartwatch solche Algorithmen mit künstlicher Intelligenz integriert sind, liegt an der begrenzten Leistungsfähigkeit dieser Geräte, und dies wird sich womöglich in absehbarer Zeit auch nicht implementieren lassen. Ferner sind solcherlei Algorithmen bislang den Endnutzenden nicht und dem Fachpersonal, wenn überhaupt, nur im Rahmen von Studien oder speziellen Abkommen zugänglich. Drittdienstleister, welche die Interpretation von 1-Kanal-EKGs durch Fachpersonal anbieten, sind eine geeignete Lösung für Hausärztinnen und Hausärzte als Zeitersparnis sowie für Patienten und Patientinnen bei Unsicherheiten oder fehlender direkter Anlaufstelle.
Limitationen und Chancen
Eine Limitation der Rhythmusdiagnostik via 1-Kanal-EKG ist die zwangsweise aktive Aufzeichnung durch den Anwender, d.h., es muss durch eine bewusste Bewegung ein Kontakt mit dem Wearable hergestellt werden. Eine Aufzeichnung im Schlaf ist somit nicht möglich. Eine Alternative zur VHF-Detektion via 1-Kanal-EKG bietet die Detektion von VHF mittels Photoplethysmografie (PPG). Wie bei der Pulsoxymetrie misst z.B. eine Smartwatch oder ein Armband kontinuierlich die Schlag-zu-Schlag-Variabilität und versucht so, durch Unregelmässigkeiten VHF zu detektieren. Die Apple Heart Study,27 die Fitbit Heart Study28 und die Huawei Study29 sind namhafte gross angelegte Studien, welche darauf abzielten, eine breite Bevölkerung abzubilden, um Vorhofflimmern mithilfe von PPG zu detektieren. Bewegungsartefakte sind neben einer geringen Batteriekapazität sowie der Notwendigkeit einer Diagnosebestätigung durch ein 1-Kanal-EKG Limitationen dieser Technologie, welche jedoch gleichzeitig grosses Potenzial im Vergleich zu einem kontinuierlichen Patientenmonitoring bietet.
Diese zwangsweise eigenständige Aufzeichnung ist sowohl die grösste Chance als gleichzeitig wohl auch eine der treibenden Limitationen der Technologie: Artefakte, abgebrochene Aufzeichnungen und ungenaue Symptomdokumentation erschweren neben dem Vorliegen einer einzigen Ableitung pro Aufzeichnung die Interpretation sowie die Diagnosestellung. Hinzu kommt, dass sich die Algorithmen der Hersteller nicht nur in der Darstellung der grafischen Aufzeichnung, sondern auch in ihren Messgrenzen unterscheiden. Entsprechend gibt es Wearables, welche eine Herzfrequenz ausserhalb von 50–120 Schlägen pro Minute nicht mehr analysieren. Ebenso sind Extrasystolen, Bewegungsartefakte, Vorhofflattern oder ein kurzer Kontaktunterbruch Gründe für abgebrochene Messungen oder als inkonklusiv gewertete Aufzeichnungen.
Als diagnostisches Instrument, vorläufig in vereinzelten medizinischen Fachbereichen, bieten uns Wearables bereits heute, in naher und fernerer Zukunft die Möglichkeit, prompte Aufzeichnungen zu erlangen, die Vortestwahrscheinlichkeit für Befunde zu erhöhen und die Anzahl von Konsultationen hierdurch gegebenenfalls zu reduzieren. Wearables werden in Zukunft in der Medizin eine bedeutende Rolle spielen und die Medizin sukzessiv weiterentwickeln.
Literatur:
1 Most used consumer electronics in Switzerland 2023. Statista. https://www.statista.com/forecasts/1348648/most-used-consumer-electronics-in-switzerland ; letzter Zugriff 1.9.2023 2 Most used eHealth tracker/ smart watches by brand in Switzerland 2023. Statista. https://www.statista.com/forecasts/1348520/most-used-ehealth-tracker-smart-watches-by-brand-in-switzerland ; letzter Zugriff 1.9.2023 3 Holter NJ: New method for heart studies. Science 1961; 134: 1214-20 4 Hindricks G et al.: 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2021; 42: 373-498 5 Yetisen AK et al.: Wearables in medicine. Adv Mater 2018; 30: e1706910 6 Apple Watch vs Swiss watch industry shipments 2019. Statista https://www.statista.com/statistics/1194565/global-apple-watch-vs-swiss-watch-industry-shipments/ ; letzter Zugriff 1.9.2023 7 Aquilina O: A brief history of cardiac pacing. Images Paediatr Cardiol 2006; 8: 17-81 8 Saxon LA: Ubiquitous wireless ECG recording: a powerful tool physicians should embrace. J Cardiovasc Electrophysiol 2013; 24: 480-3 9 Mahajan R et al.: Subclinical device-detected atrial fibrillation and stroke risk: a systematic review and meta-analysis. Eur Heart J 2018; 39: 1407-15 10 Mannhart D et al.: Clinical validation of 5 direct-to-consumer wearable smart devices to detect atrial fibrillation. JACC Clin Electrophysiol 2023; 9: 232-42 11 Ahmed AS et al.: Using a smartwatch to identify the morphology of atrial flutter. Hear Case Rep 2020; 6: 808-9 12 Trohman RG: Supraventricular tachycardia: implications for the intensivist. Crit Care Med 2000; 28: 129-35 13 Siddeek H et al.: AVNRT captured by Apple Watch Series 4: Can the Apple watch be used as an event monitor? Ann Noninvasive Electrocardiol 2020; 25(5): 12742 14 Azram M et al.: Clinical validation and evaluation of a novel six-lead handheld electrocardiogram recorder compared to the 12-lead electrocardiogram in unselected cardiology patients (EVALECG Cardio). Eur Heart J Digit Health 2021; 2: 643-8 15 Lane JCE et al.: Risk of hydroxychloroquine alone and in combination with azithromycin in the treatment of rheumatoid arthritis: a multinational, retrospective study. Lancet Rheumatol 2020; 2: 698-711 16 Nasarre M et al.: Using a smartwatch electrocardiogram to detect abnormalities associated with sudden cardiac arrest in young adults. EP Eur 2021; 24: 406-12 17 Benoit SR et al.: Risk factors for prolonged QTc among US adults: Third National Health and Nutrition Examination Survey. Eur J Cardiovasc Prev Rehabil 2005; 12: 363-8 18 Viskin S et al.: Long QT syndrome caused by noncardiac drugs. Prog Cardiovasc Dis 2003; 45: 415-27 19 Roden DM et al.: Considerations for drug interactions on QTc interval in exploratory COVID-19 treatment. Heart Rhythm 2020; 17: 231-2 20 Mannhart D et al.: Clinical validation of automated corrected QT-interval measurements from a single lead electrocardiogram using a novel smartwatch. Front Cardiovasc Med 2022; 9: 906079 21 Viskin S et al.: Inaccurate electrocardiographic interpretation of long QT: the majority of physicians cannot recognize a long QT when they see one. Heart Rhythm 2005; 2: 569-74 22 Dagher L et al.: Wearables in cardiology: Here to stay. Heart Rhythm 2020; 17: 889-95 23 Samol A et al.: Recording of bipolar multichannel ECGs by a smartwatch: modern ECG diagnostic 100 vears after Einthoven. Sensors 2019; 19: 2894 24 Samol A et al.: Single-lead ECG recordings including Einthoven and Wilson leads by a smartwatch: a new era of patient directed early ECG differential diagnosis of cardiac diseases? Sensors 2019; 19: 4377 25 Spaccarotella CAM et al.: Multichannel electrocardiograms obtained by a smartwatch for the diagnosis of ST-segment changes. JAMA Cardiol 2020; 5: 1176-80 26 Mannhart D et al.: Clinical validation of an artificial intelligence algorithm offering cross-platform detection of atrial fibrillation using smart device electrocardiograms. Arch Cardiovasc Dis 2023; 116: 249-57 27 Perez MV et al.; Apple Heart Study Investigators: Large-scale assessment of a smartwatch to identify atrial fibrillation. N Engl J Med. 2019; 381: 1909-17 28 Lubitz SA et al.: Detection of atrial fibrillation in a large population using wearable devices: the Fitbit Heart Study. Circulation 2022; 146: 1415-24 29 Guo Y et al.; MAFA II Investigators: Mobile photoplethysmographic technology to detect atrial fibrillation. J Am Coll Cardiol 2019; 74: 2365-75
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...