Update Lipidmanagement
Autorinnen:
Dr. med. Simona Danioth
KD Dr. med. Lea Slahor
Endokrinologie/Diabetologie
Luzerner Kantonsspital, Luzern
Korrespondenz:
E-Mail: simona.danioth@luks.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Kardiovaskuläre Erkrankungen stellen sowohl in der Schweiz als auch weltweit die häufigste Todesursache dar, wobei Fettstoffwechselstörungen als ein Hauptrisikofaktor gelten. In der klinischen Praxis stehen immer mehr Optionen zur Diagnostik und Therapie dieser Störungen des Lipidstoffwechsels zur Verfügung.
Keypoints
-
Lipidstoffwechselstörungen gehören zu den Hauptrisikofaktoren für Herz-Kreislauf-Erkrankungen.
-
Das Augenmerk sollte auf dem frühzeitigen Erkennen entsprechender Risikofaktoren liegen.
-
Zur verbesserten Risikostratifizierung ist das «phenotype assessment» (Bestimmung der atherogenen Partikel) von zunehmendem Interesse.
-
Einer frühzeitigen, potenten und fortdauernden lipidsenkenden Therapie kommt in der Prävention und Behandlung von kardiovaskulären Erkrankungen eine zentrale Bedeutung zu. Hierzu stehen neben den seit Längerem etablierten Statinen immer mehr neue Wirkklassen zur Verfügung.
Kardiovaskuläre Erkrankungen sind weltweit die Hauptursache für erhöhte Morbidität und Mortalität.1 Der Prävention sowie der Behandlung der kardiovaskulären Risikofaktoren (Hypercholesterinämie, arterielle Hypertonie, Diabetes mellitus, Adipositas, Nikotinkonsum, Bewegungsmangel) kommt hierbei eine zentrale Bedeutung zu. Hochwirksame lipidsenkende Therapien können das LDL-Cholesterin (LDL-C) und somit die kardiovaskuläre Morbidität und Mortalität senken. Aufgrund der bisherigen Studienlage lag das Augenmerk auf dem Erreichen einer bestmöglichen LDL-C-Senkung. Von zunehmendem Interesse sind jedoch weitere diagnostische und therapeutische Ansatzpunkte, welche in diesem Artikel zusammengefasst werden. Der Fokus liegt hierbei auf den klinisch relevanten Aspekten.
Diagnostik
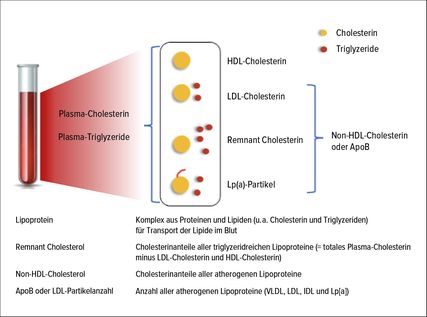
Der Lipidtransport im Blut erfolgt gebunden an Lipoproteine (Abb. 1). Die daraus entstehenden Komplexe – u.a. Lipoprotein(a), VLDL, IDL – zeigen in Abhängigkeit von ihrer Dichte unterschiedliche atherogene Eigenschaften. In der Praxis erfolgt die Fettstoffwechselabklärung routinemässig mittels Bestimmung eines Standard-Lipidprofils (Gesamt-Cholesterin, LDL-C, HDL-C, Triglyzeride). Hinsichtlich der Beurteilung der Cholesterinwerte ist nicht zwingend eine Nüchtern-Blutentnahme nötig (eine Ausnahme stellt der Triglyzeridwert dar). Eine Risikostratifizierung ausschliesslich anhand des LDL-C kann jedoch z.B. bei Patienten mit metabolischem Syndrom (viszerale Adipositas, Insulinresistenz) unzureichend sein.2–3 Dies ist durch eine interindividuell unterschiedliche Anzahl und Grösse der LDL-Partikel bedingt. So ist eine höhere Anzahl von kleinen LDL-Partikeln im Vergleich zu wenigen grossen LDL-Partikeln mit einem höheren kardiovaskulären Risiko assoziiert, trotz eines identischen LDL-C-Spiegels. Zur Detektion einer solchen Diskordanz kommt dem sogenannten «phenotype assessment» (Bestimmung der atherogenen Partikel) eine wachsende Bedeutung zu. So wird gemäss aktueller Evidenz vermutet, dass das Gesamtcholesterin, gebunden an die atherogenen Lipoproteinpartikel (geschätzt als Non-HDL-C), bzw. die Konzentration dieser atherogenen Lipoproteine (gemessen als ApoB oder LDL-Partikel-Anzahl) als Marker für das Langzeitrisiko für die Entwicklung einer Koronarerkrankung der Messung des LDL-C überlegen ist.4,5
Abb. 1: Lipide und Lipoproteine im Plasma (adaptiert nach Nordestgaard BG et al.: Eur Heart J 2016; 37: 1944-58)
«Remnant Cholesterol»
Im Rahmen verschiedener Studien konnte des Weiteren gezeigt werden, dass ein erhöhtes «Remnant Cholesterol» (=Gesamtwert des Plasma-Cholesterins abzüglich LDL-C und HDL-C) mit einem erhöhten Risiko für arteriosklerotische kardiovaskuläre Erkrankungen sowie einer erhöhten Mortalität einhergeht.6 Ein erhöhtes Remnant Cholesterol scheint zudem additiv zu einer erhöhten Gesamtmortalität sowie zum Auftreten von Myokardinfarkten bei Patienten unter bereits etablierter Statintherapie beizutragen und wird als unabhängiger Risikofaktor für kardiovaskuläre Endpunkte in der Primärprävention diskutiert.4–5,7
Lipoprotein(a)
Ein weiteres Lipoprotein von Bedeutung ist das Lipoprotein(a), welches durch seine proatherogenen Eigenschaften (u.a. Hochregulation von Zyto- und Chemokinen, endotheliale Dysfunktion, Migration und Proliferation von glatten Muskelzellen, Klappenverkalkung) charakterisiert ist. Seine Konzentration steht in linearer Assoziation mit dem Auftreten von arteriosklerotischen kardiovaskulären Erkrankungen bei Erwachsenen mittleren Alters.8 Lipoprotein(a) gilt als hereditärer kardiovaskulärer Risikofaktor. Trotz unterschiedlicher Konzentration in verschiedenen ethnischen Untergruppen scheint Lipoprotein(a) das Risiko für arteriosklerotische kardiovaskuläre Erkrankungen unabhängig sowohl von der ethnischen Herkunft als auch vom Vorliegen resp. Fehlen eines Diabetes zu modifizieren.
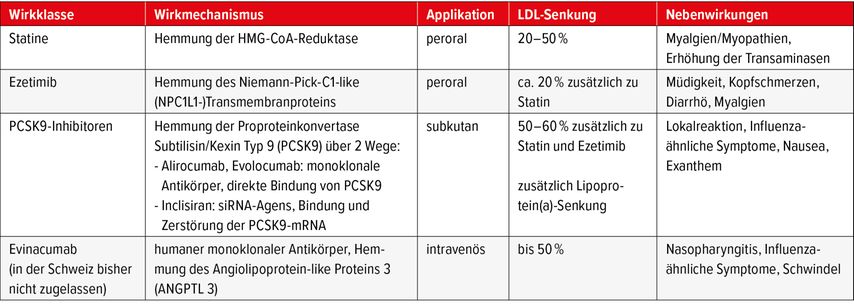
Therapie (Tab.1)
Statine und Ezetimib
Trotz zunehmender Anzahl an Optionen für die lipidsenkende Therapie haben die Statine, was u.a. historisch bedingt ist, weiterhin die Vorreiterrolle in der Behandlung der Hypercholesterinämie. Durch die Hemmung der HMG-CoA-Reduktase wird neben einer Cholesterinsenkung (Potenz: 20–50% LDL-C-Senkung) eine Reduktion von VLDL-C bzw. eine vermehrte Synthese der LDL-Rezeptoren erreicht, mit positivem Effekt auf kardiovaskuläre Endpunkte.9 Als häufigste Nebenwirkungen sind Myalgien/Myopathien sowie eine Erhöhung der Transaminasen zu nennen.
Im Falle eines unzureichenden Therapieansprechens unter maximal tolerierter Statindosierung (gemäss Risikostratifikation) bzw. als primäre Kombinationstherapie bei Patienten mit hohem kardiovaskulärem Risiko wird die Zugabe von Ezetimib empfohlen (Potenz: 18–22% LDL-C-Senkung zusätzlich zu Statin). Der Wirkmechanismus basiert auf der Hemmung des Niemann-Pick-C1-like(NPC1L1-)Transmembranproteins mit konsekutiv verminderter intestinaler Cholesterin-/Mizellen-Absorption. In Kombination mit einer Statintherapie ist eine signifikante Reduktion der Zahl von kardiovaskulären Ereignissen belegt.10 Die häufigsten unerwünschten Nebenwirkungen sind Müdigkeit, Kopfschmerzen, Diarrhö und Myalgien.
Bempedoinsäure
Als Drittlinientherapie bzw. im Falle einer Statinintoleranz wird eine Behandlung mit Bempedoinsäure empfohlen (Potenz: ca. 20% LDL-C-Senkung). Hierbei handelt es sich um einen inaktiven Vorläufer (Prodrug), welcher selektiv in die Hepatozyten aufgenommen wird und dort nach der Aktivierung zu einer Hemmung der ATP-Citratlyase führt. Durch den ähnlichen Wirkort wie bei den Statinen kommt es zusätzlich ebenfalls zu einer Reduktion von VLDL-C und einer vermehrten Synthese der LDL-Rezeptoren. Da die Aktivierung mehrheitlich innerhalb der Hepatozyten stattfindet, tritt unter Bempedoinsäure hingegen keine Myotoxizität auf. Als relevante unerwünschte Nebenwirkung ist die Hyperurikämie/Gicht zu nennen, ausserdem können Abdominalbeschwerden, Anämie sowie eine Transaminasenerhöhung auftreten. In der Schweiz ist Bempedoinsäure als Monotherapie oder in Kombination mit Ezetimib erhältlich. Unter Therapie mit Simvastatin ist zwingend eine Reduktion der Statindosis um 50% vorzunehmen. Die Limitationskriterien sind erfüllt im Falle einer Therapie im Rahmen einer Sekundärprävention und bei einem LDL-C ≥1,8mmol/l bzw. im Rahmen einer Primärprävention bei Patienten mit familiärer Hypercholesterinämie und einem LDL-C ≥2,6mmol/l. Bei Nichterfüllen der genannten Kriterien ist eine Vorstellung bei einem Spezialisten zur Einholung einer Kostengutsprache (für eine Verschreibung ausserhalb der Limitationskriterien) sinnvoll. Ein adäquates Therapieansprechen (mindestens 10% LDL-C-Senkung) muss nach 6 Monaten belegt werden.
PCSK9-Hemmer
Eine neue Ära in der Behandlung der Hypercholesterinämie bedeutete die Zulassung der PCSK9-Inhibitoren (Potenz: 50–60% LDL-C-Senkung zusätzlich zu Statin und Ezetimib). PCSK9 (Proproteinkonvertase Subtilisin/Kexin Typ 9) ist ein Protein, das normalweise im Rahmen der LDL-Resorption aus dem Blut in die Hepatozyten aufgenommen wird und dort zu einer Zerstörung des LDL-Rezeptors führt. Durch die Hemmung von PCSK9 kommt es zu einem Recycling der LDL-Rezeptoren, wodurch mehr Rezeptoren auf der Zellmembran zur Verfügung stehen. Eine solche PCSK9-Hemmung wird medikamentös über zwei Wege erreicht: entweder durch monoklonale Antikörper (Alirocumab, Evolocumab), welche direkt PCSK9 binden, oder durch ein siRNA-Agens (Inclisiran), das über den ASGP-Rezeptor gezielt in Hepatozyten (über Endosome) aufgenommen wird, sich dort an die PCSK9-mRNA bindet und diese zerstört. PCSK9-Inhibitoren führen zudem als einzige bislang zugelassene lipidsenkende Therapie zu einer Reduktion von Lipoprotein(a). Sie werden subkutan verabreicht (Alirocumab/Evolocumab alle 14–30 Tage, Inclisiran alle 6 Monate), wobei es als häufigste Nebenwirkung zu lokalen Reaktionen kommen kann. Weitere unerwünschte Wirkungen sind Influenza-ähnliche Symptome, Nausea und Exanthem. Die Therapie mit einem PCSK9-Hemmer bedarf bei der Erstverschreibung eines Gesuchs um Kostengutsprache durch einen Spezialisten. Eine Ausnahme stellt die Verschreibung im Rahmen einer sekundärpräventiven Indikation und einem LDL-C ≥1,8mmol/l. bzw. die Primärprävention bei Patienten mit hetero-/homozygoter familiärer Hypercholesterinämie und einem LDL-C ≥2,6mmol/l dar. Mit einer LDL-C-Senkung von mindestens 40% oder einem LDL-C <1,4mmol/l nach 6 Monaten ist die Voraussetzung für eine Therapiefortführung im Rahmen der Limitatio erfüllt. Eine weitere Therapieindikation liegt vor im Falle einer Statinintoleranz, definiert als Auftreten von Myalgien, Anstieg der Kreatinkinase auf mindestens den 5-fachen Normwert oder Auftreten einer schweren Hepatopathie unter Therapieversuch mit mindestens zwei verschiedenen Statinen mit oder ohne Ezetimib in maximal verträglicher Dosierung über mindestens drei Monate, ohne Erreichen der oben genannten LDL-C-Zielwerte.
Ausblick
Neuere Therapien machen sich weitere Angriffspunkte im Lipidstoffwechsel zunutze. Bei Evinacumab (Evkeeza®; Zulassung in den USA und der EU 2021, keine Zulassung in der Schweiz) handelt es sich um einen humanen monoklonalen Antikörper, der das Angiolipoprotein-like Protein 3 (ANGPTL 3) hemmt und gezielt zur Behandlung der homozygoten familiären Hypercholesterinämie entwickelt wurde. Der Wirkmechanismus ist nicht gänzlich geklärt, es wird ein verstärkter Effekt der Lipoprotein-Lipase und der endothelialen Lipase diskutiert. Dies erfolgt unabhängig vom LDL-Rezeptor. In Studien konnte eine bis zu 50%ige LDL-C-Reduktion gezeigt werden.11 Daten zu kardiovaskulären Endpunkten liegen bisher nicht vor.
Weitere Therapien zielen auf eine Reduktion von Lipoprotein(a) ab (Pelacarsen, Olpasiran).12 Ergebnisse der Phase-III-Studien zu Pelacarsen werden im Verlauf des Jahres 2024 erwartet.
Literatur:
1 Bundesamt für Statistik: Spezifische Todesursachen. https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszustand/sterblichkeit-todesursachen/spezifische.html ; zuletzt aufgerufen am 16.4.2024 2 Mora S et al.: Discordance of low-density lipoprotein (LDL) cholesterol with alternative LDL-related measures and future coronary events. Circulation 2014; 129: 553-61 3 Lawler PR et al.: Discordance between circulating atherogenic cholesterol mass and lipoprotein particle concentration in relation to future coronary events in women. Clin Chem 2017; 63: 870-9 4 Castañer O et al.: Remnant cholesterol, not LDL cholesterol, is associated with incident cardiovascular disease. J Am Coll Cardiol 2020; 76: 2712-24 5 Quispe R et al.: Remnant cholesterol predicts cardiovascular disease beyond LDL and ApoB: a primary prevention study. Eur Heart J 2021; 42: 4324-32 6 Tybjaerg-Hansen A: Do triglycerides contribute to residual cardiovascular disease risk in diabetes? ADA Congress 2023 7 Johannesen CDL et al.: Apolipoprotein B and non-HDL cholesterol better reflect residual risk than LDL cholesterol in statin-treated patients. J Am Coll Cardiol 2021; 77: 1439-50 8 Patel AP et al.: Lp(a) (Lipoprotein[a]) concentrations and incident atherosclerotic cardiovascular disease: New insights from a large national biobank. Arterioscler Thromb Vasc Biol 2021; 41: 465-74 9 Chou R et al.: Statin use for the primary prevention of cardiovascular disease in adults: Updated evidence report and systematic review for the US Preventive Services Task Force. JAMA 2022; 328: 754-71 10 Cannon CP et al.: Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-97 11 Raal FJ et al.: Evinacumab for homozygous familial hypercholesterolemia. N Engl J Med 2020; 383: 711-20 12 Yeang C et al.: Effect of pelacarsen on lipoprotein(a) cholesterol and corrected low-density lipoprotein cholesterol. J Am Coll Cardiol 2022; 79: 1035-46
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...