Der multimorbide Patient: im Brennpunkt der HFpEF
Autorin:
OÄ Dr. Ulrike Neuhold
Klinische Abteilung für Innere Medizin 1
Universitätsklinikum Krems
E-Mail: ulrike.neuhold@krems.lknoe.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
HFpEF als Syndrom erfreut sich steigender Inzidenz. Im folgenden Artikel wird auf die wechselseitige Beeinflussung von Komorbiditäten eingegangen, diagnostische Algorithmen werden vorgestellt und Behandlungsmöglichkeiten aufgezeigt.
Keypoints
-
Die HFpEF-Behandlung umfasstSGLT2-Inhibitoren EF-unabhängig, symptomorientierte Diuretikagabe und kardiale Rehabilitation.
-
Diagnostische Hinweise auf eine HFpEF sind klinische Zeichen für eine HI und Zeichen erhöhten Füllungsdruckes sowie eine LV-EF ≥50% und ein NT-proBNP ≥125.
-
Bei Adipositas (BMI >30kg/m2) und Diabetes erfolgt eine Behandlung mit GLP-1-Agonisten.
-
Eine frühzeitige Behandlung bei Vorhofflimmern vorzugsweise mittels Ablation ist zu empfehlen.
-
Zusätzlich ist eine leitliniengerechte Blutdruck- und Lipideinstellung wichtig sowie die Überprüfung der chronotropen Kompetenz mittels Ergometrie.
In den rezenten Leitlinien der ESC (European Society of Cardiology) und HFA (Heart Failure Association) 2021 wird HFpEF („heart failure with preserved ejection fraction“) als klinisches Syndrom bezeichnet, bestehend aus Leitsymptomen wie Dyspnoe, Einschränkung der Leistungsfähigkeit sowie strukturell und funktionellen Abnormitäten, einhergehend mit Zeichen des erhöhten Füllungsdruckes bei erhaltender Linksventrikelfunktion, definiert als EF ≥50%.1 Erhöhte Füllungsdrücke sind kompensatorisch notwendig, um ein ausreichendes Schlagvolumen in Ruhe und Belastung zu ermöglichen. Liegt die EF hingegen ≤40%, so wird von einer HFrEF („heart failure with reduced ejection fraction“) gesprochen, liegt sie zwischen 41% und 49%, von einer HFmrEF („heart failure with mildly reduced ejection fraction“).
Derzeit beträgt die Inzidenz von HF in Europa etwa 3/1000 Personenjahre (in allen Altersgruppen) bzw. 5/1000 Personenjahre bei Erwachsenen.2,3 Die Prävalenz steigt altersabhängig auf >10% bei über 70-Jährigen.4–7 Generell wird angenommen, dass etwa 50% der HF-Patienten eine HFrEF aufweisen und 50% sich in HFpEF- und HFmrEF-Patienten aufteilen. Diese Annahme gründet hauptsächlich auf Studien aus dem stationären Bereich.6,8–10 Das ESC-Langzeitregister im ambulanten Bereich berichtet von einer prozentuelletwas anderen Aufteilung. Hier fallen 60% der Patienten in die HFrEF-Gruppe, 24% in die HFmrEF- und 16% in die HFpEF-Gruppe.11
Multimorbidität ist in der großangelegten Olmstedt-County-Studie aus Minnesota definiert als das Vorhandensein von ≥2 Komorbiditäten. 86% der Patienten waren demnach multimorbid, wobei Hypertonie, Hyperlipidämie und kardiale Arrhythmien die führenden Komorbiditäten waren.12
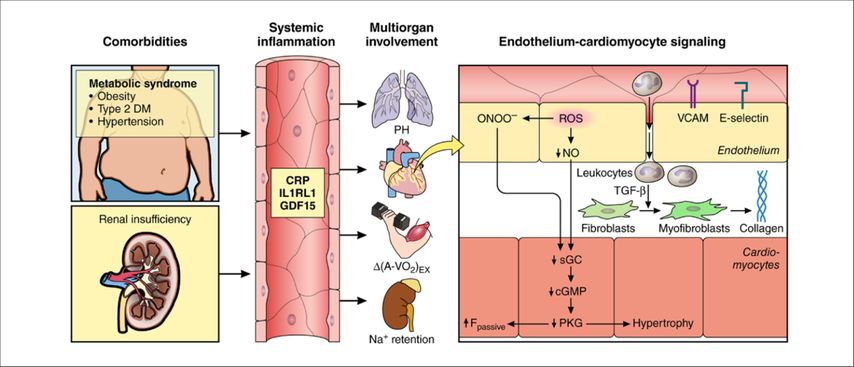
In den ESC-HFA-Leitlinien wird zwischen kardiovaskulären und nonkardiovaskulären Komorbiditäten unterschieden.1 Zu den kardiovaskulären Komorbiditäten zählen Vorhofflimmern, Hypertonie, koronare Herzkrankheit, Klappenerkrankungen und Schlaganfall. Zu den nonkardiovaskulären Komorbiditäten werden Diabetes mellitus, Adipositas, chronische Nierenerkrankungen, chronische Lungenerkrankungen, Schilddrüsen- und Krebserkrankungen ebenso wie Störungen im Eisenstoffwechsel, Hyperlipidämien, Arthritiden, Depressionen sowie generell ein „Frailty“-Zustand gezählt. Die Prävalenz von Hypertonie bei HFpEF beträgt zwischen 60% und 89% und stellt damit gleichzeitig die häufigste Komorbidität dar.11 Komorbiditäten verursachen eine systemische Inflammation, welche auf Lunge, Herz, Muskel und Niere wirkt. Im Herzen kommt es über eine endotheliale Inflammation zur Bildung von Fibrose und einem Übergang in eine HFpEF (Abb. 1).13
Abb. 1: Pathophysiologie der HFpEF verursacht durch systemische Inflammation aufgrund von Komorbiditäten13
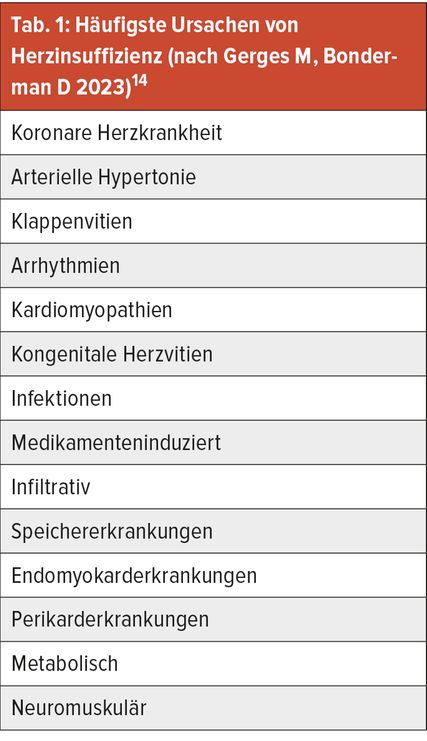
Sieht man sich die Ätiologie von HF an, so ist unschwer erkennbar, dass einige Diagnosen sowohl den Komorbiditäten zugerechnet werden als auch als Ätiologie aufscheinen (Tab. 1).14 Der Grund hierfür liegt in der wechselseitigen Beeinflussung. Beispielsweise kann Vorhofflimmern die Entstehung einer HFpEF begünstigen, da es zur verminderten linksventrikulären Füllung kommt, bei fehlender atrialer Kontraktion. Andererseits laufen HFpEF-Patienten Gefahr, VH-Flimmern zu entwickeln, da es zu einem erhöhten linksatrialen Druck bei zunehmend steifer werdendem linkem Ventrikel (LV) kommt. Es wird im Konsenspaper der ESC 2019 darauf hingewiesen, dass besonderes Augenmerk auf die Diagnostik spezifischer Ätiologien zu richten ist, um seltenere Ursachen, wie z.B. Amyloidose oder eine hypertrophe Kardiomyopathie (HCMP), nicht zu übersehen.15
Die Prognose von HF wird generell weiterhin als schlecht angesehen, wobei in den meisten Studien kein großer Unterschied besteht zwischen HFrEF und HFpEF. Zu konträren Ergebnissen kommt die groß angelegte MAGGIC-Metaanalyse, welche immerhin 39372 Patienten untersucht hat. Das Risiko zu sterben war hier bei HFpEF-Patienten deutlich niedriger.16 Selbstverständlich ist die Prognose auch stark abhängig von zusätzlich vorhandenen Komorbiditäten:Beispielsweise hat ein HFpEF-Patient mit einer Nierenfunktionseinschränkung ein 5-Jahres-Sterberisiko von 70% versus 35% bei normaler Nierenfunktion.17 Es ist daher wenig verwunderlich, dass die HF-ESC-Leitlinien dem Screening und der Behandlung von Komorbiditäten sowie Ätiologien eine Klasse-I-Indikation zuweisen.1
Diagnose einer HFpEF
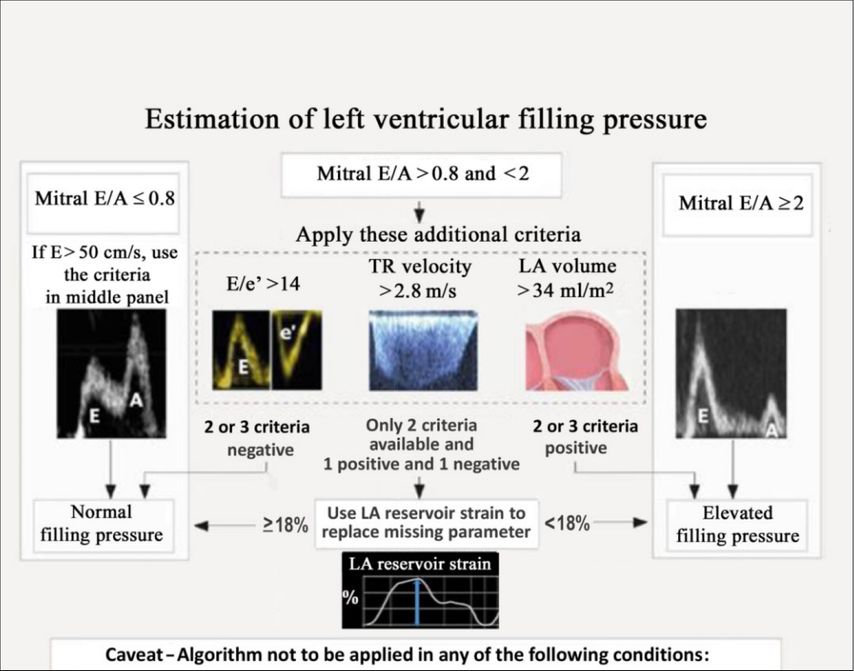
Patienten mit HFpEF präsentieren sich mit Dyspnoe, Leistungsschwäche und Müdigkeit, sodass ein differenzialdiagnostisches Vorgehen unumgänglich ist. Die Basisdiagnostik, bestehend aus EKG, Auskultation, Labor mit NT-proBNP oder BNP, bildet den ersten wichtigen Schritt. Beispielsweise schließt ein normales NT-proBNP von ≤125pg/ml eine kardiale Genese aus. Der nächste wichtige Untersuchungsschritt ist eine ausführliche Echokardiografie, die neben der Diagnosesicherung einen wichtigen Beitrag leistet, um eine spezifische Ätiologie, wie z.B. Klappenvitien, hypertrophe Kardiomyopathie oder Speicherkrankheiten nachzuweisen, die dann weitere Untersuchungsschritte, wie eine Magnetresonanztomografie (MR), Knochenszintigrafie, genetische Analysen etc., nach sich ziehen können. Die häufigste Ätiologie sind jedoch eine Herzkranzgefäßerkrankung und Hypertonie, sodass bei fehlendem spezifischem Nachweis im Echo und gesicherter HFpEF-Diagnose aktiv danach gefahndet werden sollte. Eine HFpEF gilt als gesichert, wenn neben einer LVF ≥50%, gemessen mittels 3D oder Simpson, Zeichen erhöhter linksventrikulärer Füllungsdrücke vorliegen. Ein brauchbarer Algorithmus findet sich im Expertenkonsensus der EACVI (European Association of Cardiovascular Imaging) 2022 (Abb. 2).18
Abb. 2: Algorithmus zur Abschätzung linksventrikulärer Füllungsdrücke18
E` am Mitralring repräsentiert die Verlängerungsgeschwindigkeit und ist somit ein Maß für die Relaxation, wohingegen die mitrale E-Geschwindigkeit durch den transmitralen Druckgradienten bestimmt wird. Daher kann man davon ausgehen, dass bei einem niedrigen E <0,5m/s und einer E/A-Ratio ≤0,8 ein normaler Füllungsdruck vorliegt. Hingegen spricht eine E/A-Ratio von ≥2 bei hoher E-Welle für erhöhten Füllungsdruck. Nicht erwähnt in diesem Algorithmus ist die Abgrenzung zur supernormalen Diastole im Falle einer E/A-Ratio von ≥0,2, die sich durch zusätzliche Bestimmung des E`, das in diesem Fall >1m/s wäre, leicht nachweisen ließe. Eine supernormale Diastole findet sich typischerweise bei Jugendlichen und Sportlern, bei denen die passive LV-Füllung so gut funktioniert, dass die aktive Vorhofkontraktion nicht mehr viel beisteuern muss (kleines A).
Die E/E`-Ratio wird in diesem Algorithmus gemittelt aus dem medialen und lateralen Mitralring. Hierfür gilt ein Cut-off >14. Es ist aber ein nur septales E/E` auch zulässig. In diesem Fall gilt ein Cut-off von >15. LAVI („left atrial volume index“) ist ein Marker für bereits länger bestehenden erhöhten Füllungsdruck, er hat alleine für sich gesehen aber eine nur eingeschränkte Korrelation zur Abschätzung des Füllungsdruckes. Die größte differenzialdiagnostische Schwierigkeit ergibt sich bei einer E/A-Ratio von >0,8 und <2, hier muss „normal“ zu „pseudonormal“ abgegrenzt werden. Ein im Algorithmus nicht erwähntes zusätzlich hilfreiches Tool ist hierbeidie Durchführung eines Valsalva-Manövers, welches durch Abnahme der Vorlast ein Kleinerwerden der E-Welle bewirkt und somit ein relaxgestörtes Muster als Hinweis auf erhöhten Füllungsdruck entstehen lässt. Sollten die erhobenen Befunde inkonklusiv sein, so wird die ergänzende Durchführung des „LA strain“ empfohlen. Ein „LAreservoir strain“ <18% gilt als Zeichen für erhöhten Füllungsdruck, wobei die Übereinstimmung bei HFrEF höher ist als bei HFpEF.19
Behandlung der HFpEF
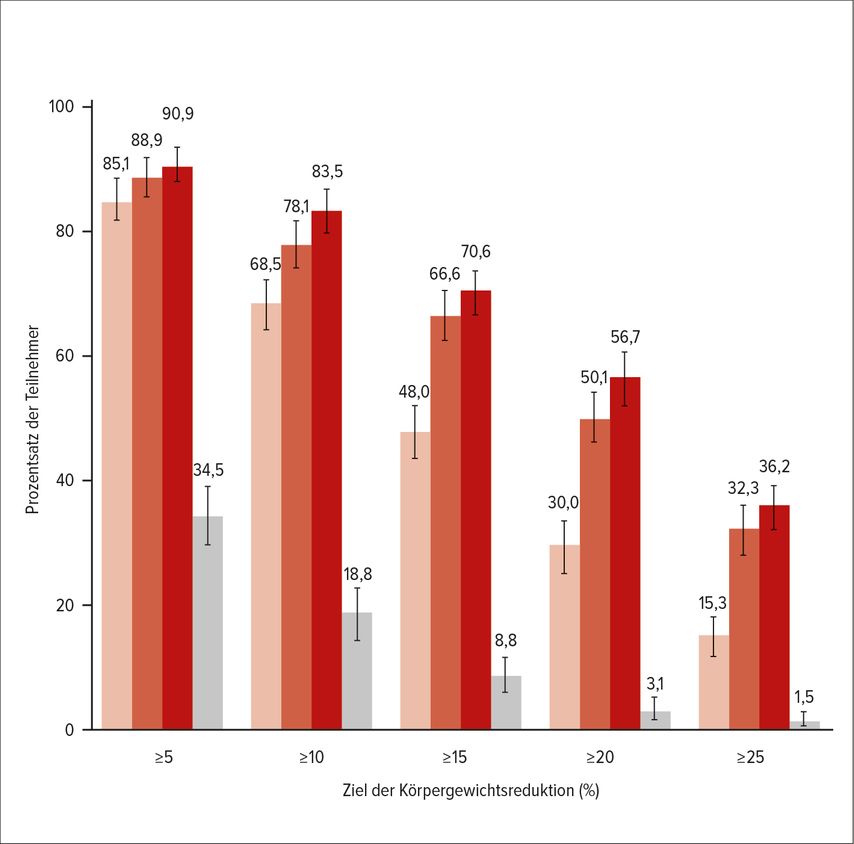
Die 2021 erschienen Leitlinien empfehlen eine rein symptomorientierte Therapie, die darauf abzielt, die Stauungssymptome mit Schleifendiuretika zu reduzieren. Weiters wird auf ein entsprechendes Trainingsprogramm bis hin zu kardialer Rehabilitation eindeutig hingewiesen. Diese Empfehlung beruht darauf, dass es bis 2022 keine Studie geschafft hat, die Vorzüge der bei HFmrEF und HFrEF verwendeteten Substanzgruppen auch auf die HFpEF-Gruppe zu übertragen. Lediglich ein Trend zu weniger Hospitalisierungen wegen Herzinsuffizienz ließ sich feststellen. Mit der EMPEROR-Studie (Empaglifloxin bei HFpEF) bzw. in der Folge auch der DELIVER-Studie (Dapaglifloxin bei HFpEF) stehen die ersten beiden Studien mit positivem Outcome zur Verfügung, die eine signifikante Senkung des kombinierten primären Endpunktes, bestehend aus kardiovaskulärem Tod und Hospitalisierungen wegen Herzinsuffizienz, zeigten.20,21Löst man die Mortalität aus dem kombinierten Endpunkt heraus, so erreichte diese allerdings keine statistische Signifikanz. Der kombinierte primäre Endpunkt war also hauptsächlich getrieben durch weniger Hospitalisierungen wegen Herzinsuffizienz. In beiden Studien lag der Anteil derPersonen mit Diabetes und der Patienten mit Niereninsuffizienz bei 50%. Hypertonie war bis zu 90% vertreten. Positive Effekte waren bereits wenige Wochen nach Behandlungsbeginn zu sehen, und zwar unabhängig davon, ob Diabetes oder Vorhofflimmern vorhanden waren. Es zeigte sich bei niereninsuffizienten Patienten auch eine geringere Abnahme der glomerulären Filtrationsrate, was sich wiederum in einer langsameren Progression der HFpEF widerspiegelte. In einer gepoolten Metaanalyse aus dem HFrEF-Trial DAPA-HF und DELIVER, die das gesamte EF-Spektrum abdeckte und für den Endpunkt kardiovaskulärer Tod ausgerichtet war, zeigte sich mit 14% Reduktion des relativen Risikos nun auch klar ein Mortalitätsbenefit.22 Beide Medikamente sind SGLT2-Inhibitoren und in Europa bereits für die Indikation Herzinsuffizienz, unabhängig von der EF, zugelassen. Es ist davon auszugehen, dass es bald auch zu einem Update der Leitlinien in diese Richtung kommen wird. Darüberhinaus ist es auch weiterhin wichtig, die zugrunde liegende Ätiologie sowie gleichzeitig bestehende Komorbiditäten zu diagnostizieren und einer leitliniengerechten Behandlung zuzuführen. Hier gibt es mit den GLP-1 (Glucagon-like-peptid-1-Rezeptoragonisten) eine Substanzgruppe, welche zu den Darmhormonen gezählt wird, die nach Nahrungsaufnahme von Kohlenhydraten ausgeschüttet werden und die Insulinfreisetzung fördern. Darüberhinaus kommt es auch zu einer Stimulation von Nervenzellen des Hypothalamus mit zentraler Wirkung auf das Sättigungszentrum, wodurch es zu einer signifikanten Gewichtsreduktion kommt. Unter Semaglutid erreichten beispielsweise 50% eine Gewichtsreduktion um mehr als 15%, ein Drittel sogar >20%.23,24 GLP-1-Agonisten führen durch ihren antiinflammatorischen Effekt auch zur Plaquereduktion und -stabilisierung.25 Das macht diese Substanzgruppe zum idealen Therapeutikum bei Patienten mit Diabetes, Adipositas und Atherosklerose, die zu den häufigen Komorbiditäten bei HFpEF zählen. Eine Zulassung besteht derzeit nur in der Kombination mit Diabetes mellitus und Adipositas. Kombiniert man die GLP-1-Agonisten mit GIP („Glucose-dependentinsulinotropicpolypeptid“), so zeigt sich in einer Phase-III-Studie, dass 56% eine Gewichtsreduktion von >20% schafften und 36% sogar eine Gewichtsreduktion von >25% erzielten. Tirzepatid 15mg 1x wöchentlich subkutan steht damit schon auf einer Ebene mit der bariatrischen Chirurgie, womit durchschnittlich 25–30% Gewichtsreduktion in 1–2 Jahren erreicht werden (Abb. 3).26
Abb. 3: Studienteilnehmer, die das Ziel der Gewichtsreduktion erreicht haben (Schätzung des Behandlungsplans; nach Jastreboff AM et al. 2022)26
Eine häufig vorkommende Komorbidität, die gleichzeitig auch als Ursache für HFpEF gilt, ist Vorhofflimmern. Daten aus der Framingham-Studie zufolge kommt es häufiger bei HFpEF- als bei HFrEF-Patienten vor und ist mit einer erhöhten Mortalität verbunden.27 Mehrere Studien konnten hier zeigen, dass eine Pulmonalvenenisolation (PVI) zu einer deutlichen Symptomverbesserung führt.28 In der CABANA-Studie wurde auch ein Vergleich mit medikamentöser Therapie durchgeführt, wobei durch die Ablation eine relative Reduktion der Gesamtmortalität um 43% erzielt werden konnte. In der Subgruppenanalyse haben sich nur in der „longstanding persistent“ Vorhofflimmergruppe die Medikamente als die bessere Option erwiesen, sodass an eine Ablation bereits im frühen Krankheitsverlauf gedacht werden sollte.29 In den ESC-HFA-Leitlinien 2021 ist die PVI mit einer Klasse-IIaIndikation versehen.1 Im Sinusrhythmus sollte auch die chronotrope Kompetenz mittels Ergometrie überprüft werden und gegebenenfalls an die Implantation eines Vorhofschrittmachers im Falle eines Sick-Sinus-Syndroms gedacht werden.
Fazit
Zusammenfassend kann festgehalten werden, dass die Betreuung von HFpEF-Patienten von der Diagnose bis hin zur Therapie der Ätiologie und Komorbiditäten komplex ist und eine enge Kooperation zwischen Hausärzten, niedergelassenen Internisten, Kardiologen und auch Spezialambulanzen unabdingbar ist.
Literatur:
1 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599-726 2 Bozkurt B et al.: Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association. Eur J Heart Fail 2021; 23(3): 352-80 3 Galderisi M et al.: Standardization of adult transthoracic echocardiography reporting in agreement with recent chamber quantification, diastolic function, and heart valve disease recommendations: An expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2017; 18(12): 1301-10 4 van Riet EE et al.: Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review. Eur J Heart Fail 2016; 18(3): 242-52 5 Benjamin EJ et al.: American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics-2018 update: A report from the American Heart Association. Circulation 2018; 137(12): e67e492 6 Ceia F et al.: Prevalence of chronic heart failure in Southwestern Europe: The EPICA study. Eur J Heart Fail 2002; 4(4): 531-9 7 Bibbins-Domingo K et al.: Racial differences in incident heart failure among young adults. N Engl J Med 2009; 360(12): 1179-90 8 van Riet EE et al.: Prevalence of unrecognized heart failure in older persons with shortness of breath on exertion. Eur J Heart Fail 2014; 16(7): 772-7 9 Bleumink GS et al.: Quantifying the heart failure epidemic: Prevalence, incidence rate, lifetime risk and prognosis of heart failure The Rotterdam Study. Eur Heart J 2004; 25(18): 1614-9 10 Koh AS et al.: A comprehensive population-based characterization of heart failure with mid-range ejection fraction. Eur J Heart Fail 2017; 19(12): 1624-34 11 Chioncel O et al.: Epidemiology and one-year outcomes in patients with chronic heart failure and preserved, midrange and reduced ejection fraction: An analysis of the ESC Heart Failure Long Term Registry. Eur J Heart Fail 2017; 19(12): 1574-85 12 Chamberlain AM et al.: Multimorbidity in Heart Failure: A community perspective. Am J Med 2015; 128(1): 38-45 13 Shah SJ et al.: Phenotype specific treatment of HF with HFpEF. A multiorganic roadmap. Circulation 2016; 134(1): 73-90 14 Gerges M, Bonderman D: Herzinsuffizienz mit erhaltener linksventrikulärer Funktion – Update 2022. J Kardiol 2023; 30: 1-2 15 Pieske B et al.: How to diagnose heart failure with preserved ejection fraction: The HFA–PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC) Eur Heart J 2019; 40(40): 3297-317 16 Pocock SH et al.: Predicting survival in heart failure: A risk score based on 39 372 patients from 30 studies. Eur Heart J 2013; 34(19): 1404-13 17 Löfman I et al.: Associations with and prognostic impact of chronic kidney disease in heart failure with preserved, mid-range, and reduced ejection fraction. Eur Journal Heart Fail 2017; 19(12); 1606-14 18 Smiseth OA et al.: Multimodality imaging in patients with heart failure and preserved ejection fraction: an expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2022; 23(2): e34-61 19 Inoue K et al.: Determinants of left atrial reservoir and pump strain and use of atrial strain for evaluation of left ventricular filling pressure. Eur Heart J Cardiovasc Imaging 2021; 23(1): 61-70 20 Anker SD et al.: Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385(16): 1451-61 21 Solomon SD et al.: Dapagliflozin in heart failure with mildly reduced or preserved EF. N Engl J Med 2022; 387(12): 1089-98 22 Jhund PS et al.: Dapagliflozin across the range of ejection fraction in patients with heart failure: A patient-level, pooled meta-analysis of DAPA-HF and DELIVER. Nat Med 2022; 28(9): 1956-64 23 Deng Y et al.: Effect of Semaglutide and Liraglutide in individuals with obesity or overweight without diabetes: A systematic review. Ther Adv Chronic Dis 2022; (13): 1–14 24 John PH et al.: Once-weekly Semaglutide in adults with overweight or obesity. N Engl J Med 2021; 384(11): 989-1002 25 Burgmaier M et al.: Glucagon-like peptide-1 (GLP-1) and its split products GLP-1(9-37) and GLP-1(28-37) stabilize atherosclerotic lesions in apoe-/- mice. Atherosklerosis 2012; 231(2): 427-35 26 Jastreboff AM et al.: Tirzepatide once weekly for the treatment of obesity. N Engl Med 2022; 387(3): 205-16 27 Santhanakrishnan R et al.: Atrial fibrillation begets heart failure and vice versa temporal associations and differences in preserved versus reduced ejection fraction. Circulation. 2016; 133(5): 484-92 28 Rattka M et al.: Restoration of sinus rhythm by pulmonary vein isolation improves heart failure with preserved ejection fraction in atrial fibrillation patients. Europace 2020; 22(9); 1328-36 29 Packer L et al.: Ablation versus drug therapy for atrial fibrillation in heart failure results from the CABANA Trial. Circulation 2021; 143(14): 1377-90
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...