Multimodale Bildgebung in der Abklärung der Aortenklappeninsuffizienz
Autoren: Prim. Dr. Martin Genger
Dr. Valentin Zsilavecz
Innere Medizin II
Landeskrankenhaus Graz II – Standort West
E-Mail: martin.genger@kages.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die genaue Beurteilung des Schweregrads und der hämodynamischen Relevanz einer Aortenklappeninsuffizienz stellt häufig eine Herausforderung dar und bedarf meist der Zusammenschau unterschiedlicher Bildgebungsmethoden. Eine möglichst genaue Beurteilung des Schweregrades und des Mechanismus der Insuffizienz ist essenziell.
Keypoints
-
Bei mittel- bis hochgradigen asymptomatischen AI ist das richtige Timing der operativen Versorgung oft herausfordernd.
-
Es bedarf der Zusammenschau mehrerer bildgebender Methoden und klinischer Faktoren.
-
Das Erkennen von Hinweisen auf ein beginnendes LV-Remodeling ist entscheidend, um eine bestmögliche Versorgung zu gewährleisten.
-
Eine präzise Bildgebung und Identifikation des zugrunde liegenden Mechanismus einer Insuffizienz ist für die Auswahl des richtigen Operationsverfahrens unbedingt notwendig.
Insuffizienzen der Aortenklappe sind ein häufiger Befund in der Echokardiografie. Mittel- oder hochgradige Klappeninsuffizienzen, die gegebenenfalls auch eine direkte klinische Konsequenz haben, treten jedoch nur mit einer Prävalenz von circa 0,5% auf.1 Zur Beurteilung des Schweregrads der Klappeninsuffizienz spielen vor allem die Echokardiografie (transthorakal bzw. transösophageal) und die Magnetresonanztomografie (MRT) eine entscheidende Rolle. Es gilt, mittels genauer Beurteilung des Schweregrades Patienten, die von einer operativen Versorgung profitieren, zu identifizieren und den richtigen Zeitpunkt bzw. die richtige Methode für eine Klappensanierung zu eruieren.
Akute Aortenklappeninsuffizienz
Die häufigsten Ursachen einer akuten Aortenklappeninsuffizienz (AI) umfassen die akute Aortendissektion vom Typ Stanford A mit Beteiligung der Aortenwurzel bzw. -klappe sowie infektiöse Endokarditiden. In der Diagnostik akuter Insuffizienzen spielt vor allem die Echokardiografie eine entscheidende Rolle, um den Mechanismus (u.a. Vegetationen, Perforationen, Aortendissektion) und den Schweregrad einer akuten AI zu beurteilen. Neben der Beurteilung der Aortenklappe, der Herzkammern und der restlichen Herzklappen sollten in der echokardiografischen Abklärung akuter AI auch die Aortenwurzel und die Aorta ascendens mitbeurteilt werden. Bei Aortendissektionen als Ursache der akuten Klappeninsuffizienz kann in vielen Fällen bereits echokardiograpfisch eine Dissektionsmembran („intima flap“) abgegrenzt werden. Außerdem zeigt sich häufig ein begleitender Perikarderguss. Die genaue Beurteilung der Ausdehnung einer Aortendissektion sowie die Identifizierung der betroffenen arteriellen Äste erfolgen meist mittels Computertomografie(CT)-Angiografie. Mittels Magnetresonanztomografie wäre zwar sowohl eine genaue Beurteilung der Aorta als auch die Einschätzung des Schweregrads einer akuten AI möglich. Aufgrund praktischer Limitationen und eingeschränkter Verfügbarkeit spielt das MRT in der Akutdiagnostik der Aortendissektion bzw. der akuten AI meist jedoch keine entscheidende Rolle.2
Chronische Aortenklappeninsuffizienz
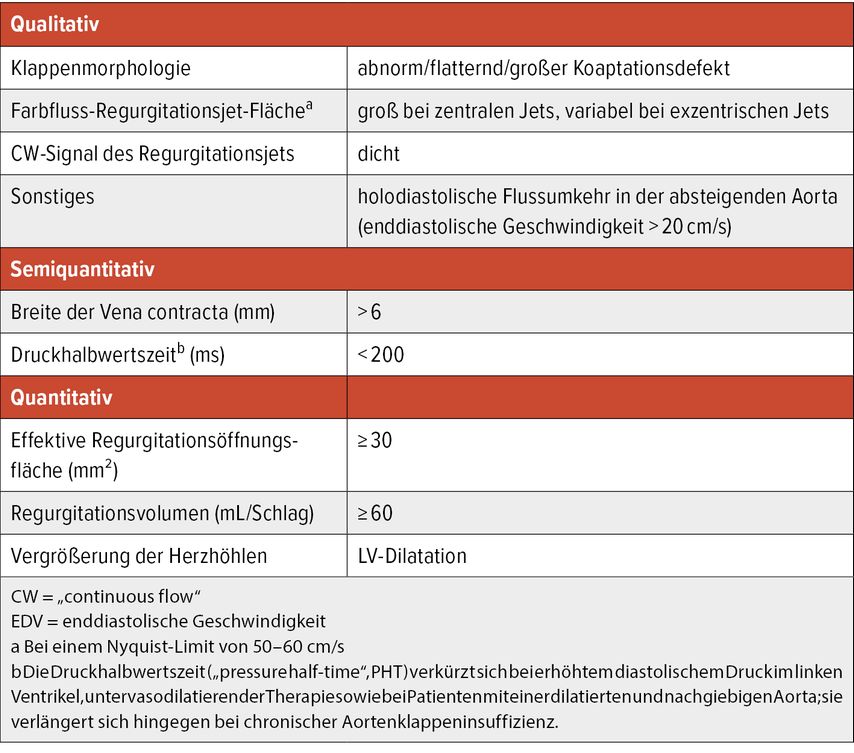
Die genaue Abschätzung des Schweregrads und der hämodynamischen Relevanz einer chronischen AI sowie die Abschätzung des richtigen Zeitpunkts für eine Klappensanierung bedürfen meist einer Zusammenschau klinischer Aspekte und mehrerer bildgebender Methoden (v.a. MRT und TTE/TEE). In der aktuellen Leitlinie der Europäischen Gesellschaft für Kardiologie (ESC) wird die transthorakale bzw. transösophageale Echokardiografie als Methode der Wahl zur Beurteilung der Klappenanatomie, des Schweregrads der Insuffizienz, des Insuffizienzmechanismus sowie der Möglichkeit einer klappenerhaltenden Sanierung genannt. Zur Einschätzung des Schweregrades sollen mehrere qualitative (u.a. Klappenmorphologie, Größe des Regurgitationsjets im Farbdoppler, Dichtheit des CW-Dopplersignals, holodiastolische Flussumkehr in Aorta descendens), semiquantitative (u.a. Vena contracta, „pressure half-time“) und quantitative Parameter (u.a. „efficient regurgitant orifice area“, auch EROA, Regurgitationsvolumen, linksventrikuläre Diameter) herangezogen werden, um eine möglichst adäquate Einschätzung zu ermöglichen (Tab.1).
Tab. 1: Echokardiografische Kriterien zur Definition einer hochgradigen Aortenklappeninsuffizienz laut aktueller ESC-Leitlinie (nach Vahanian A et al. 2022)3
Das kardiale MRT spielt in der aktuellen Leitlinie nur eine untergeordnete Rolle, falls sich in der Echokardiografie uneindeutige oder diskordante Befunde ergeben. Parameter, die mittels MRT erhoben werden sollten, sind vor allem das Regurgitationsvolumen (RegV) bzw. die Regurgitationsfraktion (RegF) und Volumina bzw. Dimensionen des linken Ventrikels. Die aktuell empfohlenen Cut-off-Werte für eine hochgradige AI sind hierbei an die gültigen Grenzwerte für die Mitralklappeninsuffizienz (MI) angepasst (RegV: >60ml, RegF: >50%). Die CT wird in erster Linie zur Beurteilung von begleitenden Dilatationen der Aorta ascendens bzw. der Aortenwurzel empfohlen.
Die Indikation für eine operative Versorgung einer AI ist dann gegeben, wenn diese als hochgradig eingeschätzt wird und klinische Beschwerden vorliegen. Bei asymptomatischen Patient:innen mit hochgradiger AI ist laut aktueller ESC-Leitlinie eine Sanierung dann empfohlen, wenn ein Remodeling des linken Ventrikels vorliegt. Die aktuell gültigen Cut-off-Werte sind hierbei eine linksventrikuläre Ejektionsfraktion (LVEF) von <50% oder ein linksventrikulärer endsystolischer Durchmesser (LVESD) von >50mm bzw. Index (LVESDi) >25mm/m2. Bei niedrigem Operationsrisiko sollte eine Evaluierung bezüglich operativer Versorgung einer hochgradigen asymptomatischen AI bereits ab einer LVEF zwischen 50 und 55% oder einem LVESDi >20mm/m2 erfolgen (Abb.1).3
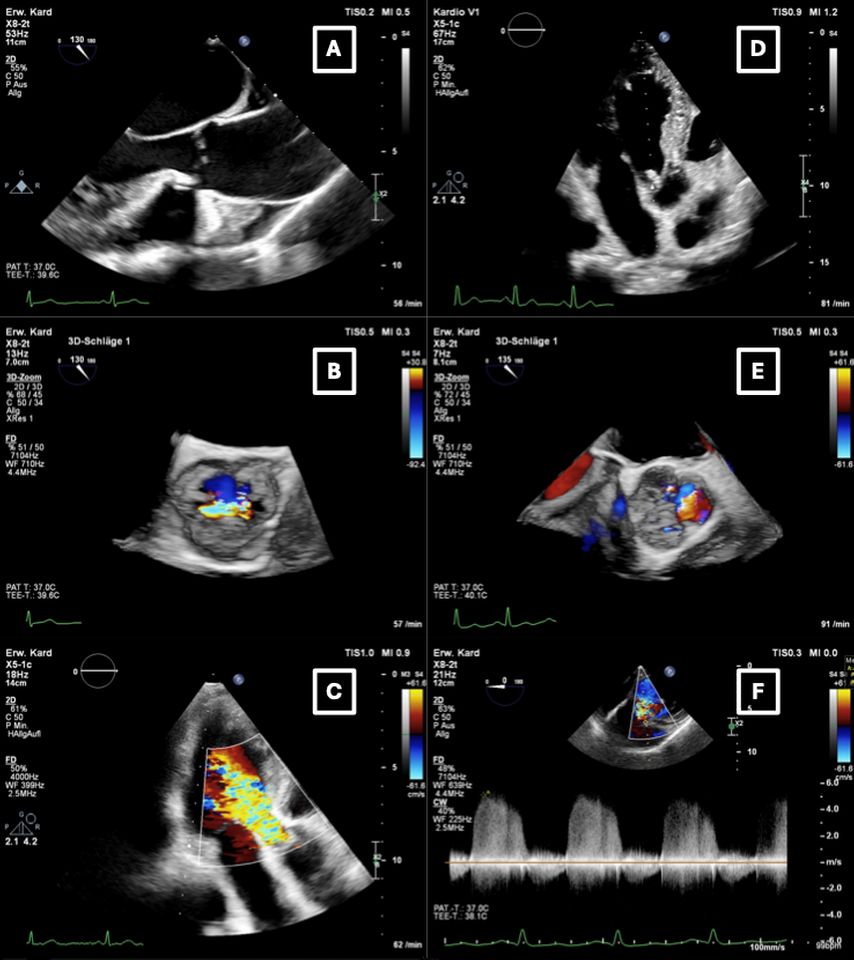
Abb. 1: Typische echokardiografische Befunde bei chronischer (A,B,C) und akuter Aortenklappeninsuffizienz (D,E,F). A,B,C: TEE bei chronischer mittel- bis hochgradiger AI mit dilatierter Aorta asc. (A) und zentralem Insuffizienzjet in der 3D-TEE (B). Im TTE zeigte sich ein breiter Insuffizienzjet im 3-Kammer-Blick (C). D,E,F: akute AI bei Endokarditis mit Vegetation im Bereich der linkskoronaren Tasche (D) und ebendort lokalisiertem Insuffizienzjet in der 3D-TEE (E). Im CW-Doppler ergab sich eine „pressure half-time“ (PHT) von ca. 230ms (F) – einer mittel- bis hochgradigen AI entsprechend
Adaptierung der Cut-off-Werte für Regurgitationsvolumen bzw. -fraktion
Wie bereits erwähnt, werden zur Einschätzung des Schweregrads einer AI mittels Regurgitationsvolumen bzw. -fraktion im kardialen MRT und in der Echokardiografie die gleichen Cut-off-Werte wie bei der MI herangezogen. Eine AI gilt ab einem RegV von 45–60ml bzw. ab einer RegF von 40–49% als mittel- bis hochgradig sowie ab einem RegV >60ml bzw. einer RegF >50% als hochgradig.4 Es stellt sich jedoch die Frage, ob sich die Adaptation bzw. das Remodeling des linken Ventrikels bei ähnlichem Regurgitationsvolumen bzw. ähnlicher Regurgitationsfraktion bei AI und MI gleichen oder ob andere Cut-off-Werte für die AI herangezogen werden sollten.
Vejpongsa etal.konnten in einer Kohortenstudie mit insgesamt 1491 Patient:in-nen, in der kardiale MRT-Parameter zwischen Patient:innen mit AI bzw. MI verglichen wurden, zeigen, dass bei gleichem RegV bzw. gleicher RegF ein deutlich ausgeprägteres LV-Remodeling (u.a. LVESD, linksventrikulärer enddiastolischer Durchmesser [LVEDD] bzw. Volumen [LVEDV]; linksventrikuläres endsystolisches Volumen [LVESV] bzw. Index [LVESDi, LVEDDi, LVESVi] LVEF) bei AI auftritt. Signifikante Unterschiede in Bezug auf das LV-Remodeling traten bei AI und MI ab RegF von >30% (≥mittelgradige AI bzw. MI) auf. Weiterführend wurde in der Studie versucht, eine Korrelation zwischen verschiedenen MRT-Parametern bei Einschluss in die Studie und der Notwendigkeit einer Sanierung der Aortenklappe bzw. eines Aortenklappenersatzes im weiteren Studienzeitraum herzustellen. Dabei wurden vor allem das RegV und die RegF als unabhängige Prädiktoren für die Notwendigkeit einer operativen Sanierung identifiziert. Basierend darauf konnte gezeigt werden, dass eine Adaptierung der Cut-off-Werte für RegV (>38ml) bzw. RegF (>35%) nach unten mit einer hohen Sensitivität und Spezifität in Bezug auf die Notwendigkeit einer Operation einhergeht. In weiterer Folge wurde im Rahmen der Studie eine neue Einteilung der Schweregrade bei AI anhand des RegV (hochgradig: >50ml) bzw. der RegF (hochgradig: >40%) festgelegt und auf das vorliegende Patientenkollektiv angewendet. Dabei zeigte sich eine gute Korrelation zwischen den neu definierten Schweregraden der AI und der Notwendigkeit einer konsekutiven operativen Sanierung.5 Zusammenfassend zeigt sich ein deutlich ausgeprägteres LV-Remodeling bei AI bereits bei deutlich niedrigeren RegF bzw. RegV im Vergleich zur MI.
In einer Kohortenstudie von Malahfji et al. mit 458 eingeschlossenen Patient:innen mit asymptomatischer, zumindest mittelgradiger AI wurde ebenfalls der Einfluss des RegV und der RegF auf einen gemeinsamen Endpunkt – bestehend aus Auftreten von Symptomen, Reduktion der LVEF <50%, Erreichen einer OP-Indikation laut Leitlinie basierend auf den LV-Dimensionen und Tod unter konservativer Therapie – untersucht. Dabei konnten ein RegV von >47ml sowie eine RegF von >43% als Prädiktoren für das Eintreten des primären Endpunkts identifiziert werden.
Die beiden erwähnten Studien legen eine Adaptierung der derzeit empfohlenen Cut-off-Werte für die Einteilung des Schweregrads einer AI anhand von RegF und RegV nahe. Die aktuell vorliegenden Daten beziehen sich jedoch nur auf MRT-Untersuchungen, weshalb weitere Studien zur Korrelation mit echokardiografischen Parametern und zur genauen Festlegung neuer Grenzen der Schweregrade unbedingt notwendig sind.
Neue LV-Remodeling-Parameter und Cut-off-Werte
Bei der mittel- bis hochgradigen asymptomatischen AI spielt, wie bereits erwähnt, das Vorliegen eines Remodelings des linken Ventrikels eine entscheidende Rolle, um den richtigen Zeitpunkt für eine operative Sanierung der AI festzulegen. Laut aktueller ESC-Leitlinie sollten hierbei vor allem die LVEF (<50%) und der LVESD (>50mm) bzw. LVESDi (>25mm/m2) herangezogen werden. Dabei stellt sich jedoch die Frage, ob diese gewählten Parameter ausreichen oder ob weitere Parameter in die Beurteilung des LV-Remodelings einfließen sollten.
Bezüglich der bereits in den Leitlinien genannten Parameter LVESD bzw. LVESDi und LVEF konnte in Studien gezeigt werden, dass eine erhöhte Mortalität bereits vor Erreichen der bisher festgelegten Cut-off-Werte vorliegt.7,8 Diese Erkenntnisse sind in die aktuelle ESC-Leitlinie bereits insofern eingeflossen, als die operative Versorgung einer hochgradigen, asymptomatischen AI bei niedrigem Operationsrisiko bereits ab einer EF von <55% bzw. einem LVESDi von >20mm/m2 mit einer Klasse IIb-Empfehlung erwogen werden sollte.
In der bereits zuvor erwähnten Studie von Malahfji et al., in welcher verschiedene MRT-Parameter mit einem gemeinsamen Endpunkt korreliert wurden (bestehend aus Auftreten von Symptomen, der Reduktion der LVEF <50%, dem Erreichen einer OP-Indikation laut Leitlinie basierend auf den LV-Dimensionen und Tod unter konservativer Therapie), konnten auch zusätzliche Parameter und die dazugehörigen Cut-off-Werte zur Beurteilung des LV-Remodelings bei AI identifiziert werden. Dazu gehören vor allem ein LVESDi von >20mm/m2, ein LVESVi von >43ml/m2 und ein LVEDVi von >109ml/m2. Die beiden Letzteren zeigten in multivariaten Regressionsanalysen eine signifikante Korrelation mit dem Erreichen des primären Endpunkts sowie einen zusätzlichen prognostischen Nutzen zur Einschätzung des LV-Remodelings mittels LVESDi.6
Eine weitere Studie von Malahfji et al. mit 392 Patient:innen untersuchte den Einfluss von Narben bzw. „late gadolinium enhancement“ (LGE) im kardialen MRT auf die Gesamtmortalität von Patient:innen mit zumindest mittelgradiger AI. Der Großteil der Patient:innen (ca. 62%) war bei Studieneinschluss asymptomatisch (NYHAI). Myokardiale Narben konnten bei knapp einem Drittel der Patient:innen identifiziert werden, wobei etwas mehr als 50% ein nichtischämisches Muster aufwiesen. Sowohl das Vorliegen einer myokardialen Narbe im Allgemeinen als auch jener einer ischämischen oder nichtischämischen Narbe wiesen eine unabhängige Korrelation mit einer erhöhten Mortalität auf. Weiters wurde untersucht, wie sich eine operative Sanierung in Abhängigkeit vom Vorliegen einer Narbe im kardialen MRT auf die Gesamtmortalität auswirkt. Dabei konnte gezeigt werden, dass bei Patient:innen, die nicht operiert wurden und eine Narbe im kardialen MRT aufwiesen, eine viel höhere Gesamtmortalität bestand. Nach operativer Klappensanierung glich sich die Gesamtmortalität trotz Vorliegen einer Narbe im kardialen MRT fast der Mortalität von operierten Patient:innen ohne Narbe an. Dies deutet darauf hin, dass das Vorliegen einer Narbe bzw. eines LGE im kardialen MRT ein zusätzlicher Marker für ein relevantes LV-Remodeling sein könnte.9
In einer Kohortenstudie von Yang et al. wurden 550 Patienten mit asymptomatischer, zumindest mittel- bis hochgradiger AI eingeschlossen und über mehrere Jahre hinsichtlich des klinischen Outcomes beobachtet. Dabei konnte gezeigt werden, dass der „left ventricular global longitudinal strain“ (LV-GLS), die LVEF und das LVESVi unabhängig von anderen Faktoren mit einer erhöhten Mortalität verbunden sind. Auch im direkten Vergleich des LV-GLS mit der LVEF, dem LVESDi und dem LVESVi zeigte sich eine statistisch unabhängige Korrelation des LV-GLS mit der Mortalität. Ein deutlicher Anstieg der Mortalität zeigte sich ab einem Cut-off-Wert des LV-GLS von <15% mit einem 2,6x höheren Risiko zu sterben.10 Dies deutet darauf hin, dass die Messung des LV-GLS einen zusätzlichen Nutzen in der Beurteilung des LV-Remodelings bei AI haben dürfte.
Conclusio & Ausblick
Aktuell stellt die Echokardiografie die wichtigste bildgebende Modalität in der Beurteilung der chronischen AI dar. Symptomatische hochgradige Insuffizienzen bedürfen in der Regel keiner zusätzlichen Abklärung mittels kardialer MRT. Falls jedoch diskordante oder grenzwertige Befunde in der TTE bzw. TEE vorliegen, sollte das MRT ergänzend zur Planung des weiteren Vorgehens eingesetzt werden. Insbesondere bei asymptomatischen mittel- bis hochgradigen Insuffizienzen kann das MRT dazu beitragen, den richtigen Zeitpunkt für eine operative Sanierung zu eruieren.
Bezüglich der aktuell empfohlenen Grenzwerte des RegV bzw. der RegF zur Einteilung der AI in Schweregrade sollte laut aktueller Studienlage eine Korrektur nach unten erwogen werden. Weitere Studien sind jedoch notwendig, um die aktuell bestehende Einteilung adäquat anpassen zu können.
Bei asymptomatischen mittel- bis hochgradigen AI stellt die Ermittlung des richtigen Zeitpunkts für eine operative Sanierung häufig eine Herausforderung dar. In den aktuellen ESC-Leitlinien wird daher bereits empfohlen, die LVEF und LVESD bzw. LVESDi als Surrogatparameter für ein beginnendes LV-Remodeling zu berücksichtigen. In aktuellen Studien ergeben sich jedoch klare Hinweise darauf, dass weitere MRT-Parameter (u.a. LVEDV, Narbe in MRT) und echokardiografische Parameter (u.a. „global longitudinal strain“) einen zusätzlichen Benefit in der Prognoseabschätzung und Planung des weiteren therapeutischen Prozederes haben dürften. Auch hier sind weitere Studien notwendig, um Empfehlungen für den Einsatz dieser Parameter im klinischen Alltag abgeben zu können.
Zusammengefasst stellen die Einschätzung des Schweregrads und die Eruierung des richtigen Zeitpunkts für die operative Sanierung einer chronischen AI häufig eine Herausforderung dar. Oft ist die Zusammenschau mehrerer bildgebender Verfahren sowie klinischer Aspekte entscheidend. Zusätzliche Parameter zur Einschätzung des klinischen Verlaufs einer AI könnten in Zukunft ein auf die jeweiligen Patient:innen zugeschnittenes therapeutisches Prozedere ermöglichen.
Praxistipp
Bei schwer zu beurteilendem Schweregrad einer Aortenklappeninsuffizienz mittels Echokardiografie bzw. bei diskrepanten Befunden kann das Herz-MRT entscheidende Zusatzinformationen liefern.
Literatur:
1 Akinseye OA et al.: Aortic valve regurgitation: a comprehensive review. Curr Probl Cardiol 2018; 43(8):315-34 2 Erbel R et al.: ESC committee for practice guidelines. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The task force for the diagnosis and treatment of aortic diseases of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(41): 2873-926 3 Vahanian A et al.: ESC/EACTS scientific document group. 2021 ESC/EACTS guidelines for the management of valvular heart disease: developed by the task force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Rev Esp Cardiol 2022; 75(6): 524 4 Lancellotti P et al.: Scientific document committee of the European Association of cardiovascular imaging.Recommendations for the echocardio-graphic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2013; 14: 611-44 5 Vejpongsa P et al.: Differences in cardiac remodeling in left-sided valvular regurgitation: implications for optimal definition of significant aortic regurgitation. JACC Cardiovasc Imaging 2022; 15(10): 1730-41 6 Malahfji M et al.: Influence of cardiac remodeling on clinical outcomes in patients with aortic regurgitation. J Am Coll Cardiol 2023; 81(19): 1885-98 7 Yang LT et al.: Association of echocardiographic left ventricular end-systolic volume and volume-derived ejection fraction with outcome in asymptomatic chronic aortic regurgitation. JAMA Cardiol 2021; 6(2): 189-98 8 Mentias A et al.: Long-term outcomes in patients with aortic regurgitation and preserved left ventricular ejection fraction. J Am Coll Cardiol 2016; 68(20): 2144-53 9 Malahfji M et al.: Myocardial scar and mortality in chronic aortic regurgitation. J Am Heart Assoc 2020; 9(23): e018731 10 Yang LT et al.: Automated global longitudinal strain exhibits a robust association with death in asymptomatic chronic aortic regurgitation. J Am Soc Echocardiogr 2022; 35(7): 692-702.e8
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...