Moderne Radiotherapie
Autoren:
Dr. Lukas Kocik
Prof. Dr. Hans Geinitz
Radioonkologie Ordensklinikum Linz, Barmherzige Schwestern
E-Mail: lukas.kocik@ordensklinikum.at
E-Mail: hans.geinitz@ordensklinikum.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
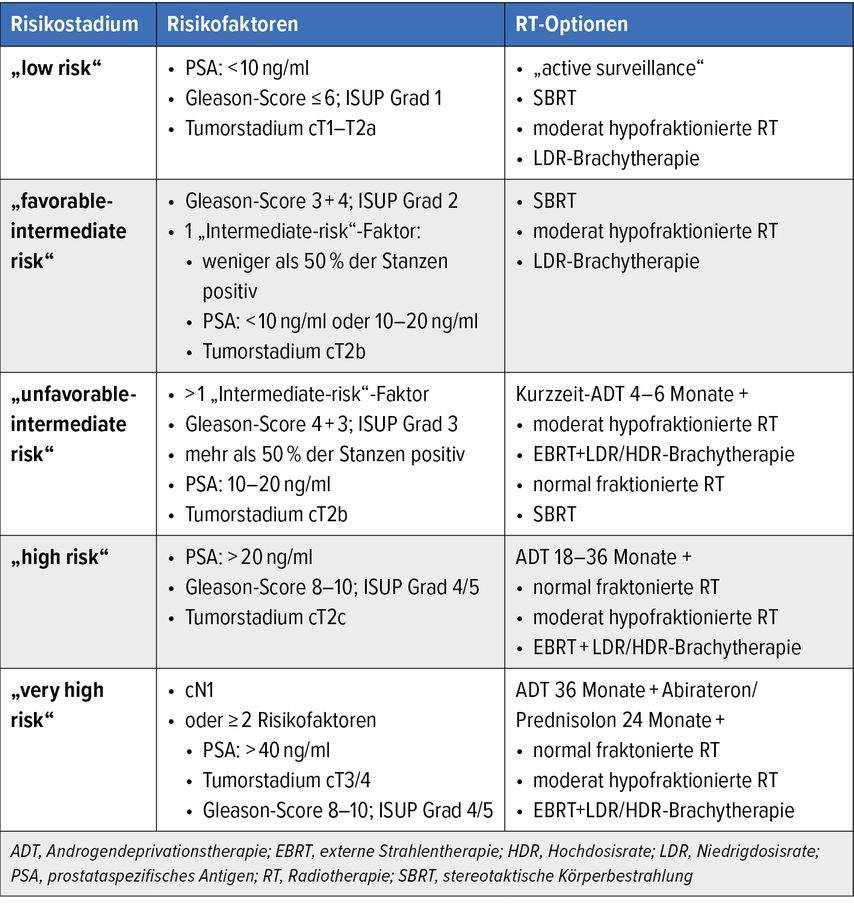
In der modernen Radiotherapie geht die Entwicklung in Richtung einer erhöhten Zieldosis und einer (Ultra-)Hypofraktionierung zugunsten einer verkürzten Therapiedauer. Die Definition der Risikostufe und eine zusätzliche Einteilung in„favorable“ und „unfavorable“ sind bei der Therapiewahl wichtig.
Die randomisierte ProtecT-Studie stellt noch immer die qualitativ hochwertigste Studie in Bezug auf den Vergleich der kurativen Therapieoptionen beim lokalisierten Prostatakarzinom dar (radikale Prostatektomie, definitive Radiotherapie und „active monitoring“). Letztes Jahr wurden die 15-Jahres-Daten veröffentlicht.1
In den Daten zeigen sich alle drei Optionen weiterhin als sehr effektiv mit einer sehr geringen Prostatakarzinom-assoziierten Sterblichkeit von 2,2–3,1% nach 15 Jahren. Lediglich in der Gruppe mit „active monitoring“ wird eine deutlich erhöhte Inzidenz von Metastasierung (9,4%) im Vergleich zu den beiden anderen Therapieoptionen sichtbar (4,7% und 5,0%).
Mittlerweile wurden auch die 12-Jahres-Daten zu den „patient-reported outcomes“ veröffentlicht. Hier zeigt sich die Radiotherapie der radikalen Prostatektomie und dem „active monitoring“ überlegen (3–8% vs. 18–24% vs. 9–11%), vor allem in Bezug auf die Notwendigkeit des Einsatzes von Inkontinenzeinlagen. Die Potenz der Patient:innen war nach Radiotherapie und „active monitoring“ deutlich häufiger erhalten (27% vs. 30% vs. 18%). Lediglich im Bereich der Stuhlinkontinenz war die Radiotherapie den beiden anderen Gruppen unterlegen (12% vs. 6% vs. 6%).
Die Patient:innen wurden im Rahmen der ProtecT-Studie mit einer 3D-konformalen Radiotherapie in normaler Fraktionierung mit 2Gy-Einzeldosis bis 74Gy behandelt. Bei einer Verabreichung von fünf Fraktionen pro Woche entspricht dies einer Therapiedauer von 7,5 Wochen.
Von technischer Seite sind der aktuelle Therapiestandard aber die intensitätsmodulierte Radiotherapie (IMRT) und deren Weiterentwicklung „volumetric intensity modulated arc therapy“ (VMAT) in Kombination mit einer bildgeführten Radiotherapie („image-guided“ Radiotherapie [IGRT]). Mit diesen Techniken lässt sich eine deutlich bessere Schonung der lokalen Risikostrukturen erreichen und die Rate an urogenitalen und gastrointestinalen Nebenwirkungen senken.
74Gy stellen bei normaler Fraktionierung die minimale Zieldosis dar. In den Studien zur Dosiseskalation (74–80Gy) konnte ein verlängertes biochemisches progressionsfreies Überleben gezeigt werden. Heuer wurden bei der ASCO-Jahrestagung die Langzeitergebnisse der Studie GETUG-AFU 18 präsentiert. Sie zeigen einen Vorteil der Dosiseskalation von 70Gy auf 80Gy für das biochemische progressionsfreie Überleben sowie das prostatakarzinomspezifische Überleben und das Gesamtüberleben bei Hochrisikopatient:innen. Jede Dosiseskalation führt aber auch zu einer Steigerung der urogenitalen und gastrointestinalen Nebenwirkungen.
Therapieverkürzung durch moderate Hypofraktionierungund Ultrahypofraktionierung
In der Bestrebung, die Therapiedauer für die Patient:innen zu verkürzen, wurden mehrere Studien zur Hypofraktionierung durchgeführt. Hierbei wird die Dosis pro Fraktion gesteigert. Damit kann die Anzahl der Gesamtfraktionen verkürzt werden. Die prominenteste der Hypofraktionierungsstudien ist die Studie CHHiP.2
In CHHiP wurde die Standardfraktionierung von 37x2Gy mit einer moderaten Hypofraktionierung mit 20x3Gy randomisiert verglichen. Die 10-Jahres-Daten wurden letztes Jahr bei der ASCO-Jahrestagung präsentiert. Hier war die moderate Hypofraktionierung mit 79,8% der normalen Fraktionierung mit 76% knapp signifikant nicht überlegen, aber beide Fraktionierungen waren zumindest gleichwertig.
In Bezug auf die urogenitalen und gastrointestinalen Nebenwirkungen zeigt sich kein Unterschied zwischen den beiden Fraktionierungen. Die Häufigkeit der Notwendigkeit einer Sigmoidoskopie war im Standardarm 12% und im hypofraktionierten Arm 8%.
Die moderate Hypofraktionierung stellt nun einen Therapiestandard für das lokalisierte Prostatakarzinom dar. Die Ausnahme bilden Hochrisikokarzinome und Karzinome mit Samenblaseninfiltration, da diese in den Studien zur moderaten Hypofraktionierung unterrepräsentiert waren und weiterhin normal fraktioniert mit bis zu einer Dosis von 74–80Gy behandelt werden können.
Eine weitere Therapieverkürzung kann mit Ultrahypofraktionierung erreicht werden. Hierbei wird die Einzeldosis weiter gesteigert und die Gesamttherapiedauer kann auf fünf bis sieben Sitzungen reduziert werden.
In der Studie HYPO-RT-PC wurde eine Bestrahlung mit 7x6,2Gy mit einer konventionellen Fraktionierung 39x2Gy verglichen.3 In beiden Armen zeigten sich eine Rate des rezidivfreien Überlebens von 84% nach fünf Jahren sowie kein Unterschied in den gastrointestinalen und urogenitalen Nebenwirkungen.
Letztes Jahr wurden bei der ASTRO-Jahrestagung nun auch die 5-Jahres-Daten der Studie PACE-B präsentiert. In dieser Studie wurde die stereotaktische Bestrahlung der Prostata mit 5x7,25Gy mit einer moderaten Hypofraktionierung von 20x3,1Gy verglichen.
Die Rate des rezidivfreien Überlebens war in beiden Gruppen nach fünf Jahren bei ca. 95%. In der Gruppe der Patient:innen, die in nur fünf Sitzungen behandelt wurden, zeigte sich eine leichte, aber nicht signifikante Erhöhung des Auftretens der urogenitalen Nebenwirkungen.
Die Ultrahypofraktionierung und Prostatastereotaxie stellen Therapieoptionen für Patient:innen mit lokalisiertem Prostatakarzinom mit niedrigem und intermediärem Risiko dar. Für eine derartige Verkürzung der Therapiedauer wird eine intrafraktionelle bildgeführte Bestrahlung empfohlen. In den bisherigen randomisierten Studien waren noch nicht ausreichend viele Patient:innen mit Hochrisikokarzinomen vertreten, somit sollte diesen Patient:innen diese Therapie auch noch nicht angeboten werden. Auch bei Patient:innen mit großem Prostatavolumen (>80ml) oder mit vorbestehenden obstruktiven Beschwerden sollte primär die Standardtherapie empfohlen werden.
Simultane Androgendeprivation
Bei Patient:innen mit Karzinomen mit niedrigem Risiko ist eine alleinige Radiotherapie ausreichend. Bei Patient:innen mit Prostatakarzinomen mit intermediärem Risiko sollte eine Unterteilung in „favorable“ und „unfavorable“ durchgeführt werden. Während Patient:innen mit einem Prostatakarzinom mit „unfavorable“ Risiko von einer simultanen Kurzzeitandrogendeprivation (4–6 Monate) profitieren, kann bei Patient:innen mit einem Prostatakarzinom mit „favorable-intermediate“ Risiko auf diese verzichtet werden.
Bei Patient:innen mit einem Hochrisikokarzinom ist die Durchführung der simultanen Androgendeprivation für 18–36 Monate empfohlen. Entsprechend den Ergebnissen der Studie STAMPEDE4 sollte bei Patient:innen mit Karzinomen mit sehr hohem Risiko (klinischer Lymphknotenbefall oder zumindest zwei der folgenden Hochrisikofaktoren: PSA ≥40ng/ml, T3/T4 oder Gleason-Score 8–10) zusätzlich zur kombinierten Radiohormontherapie für drei Jahre eine Therapie mit Abirateron und Prednisolon durchgeführt werden. Dadurch lässt sich das metastasenfreie Überleben und Gesamtüberleben der Patient:innen verlängern. Es profitieren aber nur fitte Patient:innen mit einem ECOG 0–1 von dieser Therapieeskalation.
Brachytherapie des Prostatakarzinoms
Die Brachytherapie ist weiterhin eine mögliche Alternative zur externen Radiotherapie. Der Vorteil der Brachytherapie ist, dass sie eine deutliche Dosiseskalation in der Prostata erlaubt. Bei der Low-Dose-Rate(LDR)-Brachytherapie werden radioaktive Isotope (meistens Jod125) implantiert und verbleiben dauerhaft in der Prostata.
Die alleinige LDR-BT kann Patient:innen mit Prostatakarzinomen mit „low“ und „favorable-intermediate“ Risiko angeboten werden. Bei Karzinomen mit „unfavorable-intermediate“ und Hochrisiko kann sie als Boost in Kombination mit einer externen Radiotherapie angewendet werden. In diesen Risikostadien wird aber eher die Hochdosisrate (HDR) in der Brachytherapie empfohlen. Hierbei wird mittels Kathetern und Schläuchen die radioaktive Quelle (meist Iridium192) in wenigen Sitzungen kurzzeitig eingesetzt, um die Dosis zu verabreichen. Mit dem HDR-BT-Boost zusätzlich zu einer externen Radiotherapie mit 45–50Gy lässt sich das progressionsfreie Überleben der Patient:innen verlängern, bei einem ähnlichen Nebenwirkungsprofil wie bei der alleinigen Radiotherapie.
Die Brachytherapie bietet für die Patient:innen die Möglichkeit, eine weitere Verkürzung der Therapiedauer zu erreichen, ist aber abhängig von der Erfahrung des behandelnden Instituts.
Early-Salvage-Radiotherapiestatt adjuvanter Radiotherapie
Im April 2024 wurden die endgültigen Ergebnisse der Studie RADICALS-RT veröffentlicht.5 Hier zeigt sich in den 10-Jahres-Daten kein signifikanter Unterschied zwischen adjuvanter Radiotherapie und Early-Salvage-Therapie bei einem PSA-Anstieg >0,1ng/ml oder drei aufeinanderfolgenden steigenden Werten in Bezug auf das metastasenfreie Überleben und das Gesamtüberleben bei Patient:innen mit mehr als einem Risikofaktor (R1, pT3/4, präoperatives PSA >10ng/ml, GS 7–10).
Patient:innen mit adjuvanter Radiotherapie hatten aber eine signifikant schlechtere urogenitale und fäkale Kontinenz. Somit sollte Patient:innen postoperativ primär eine Observanz mit regelmäßigen PSA-Kontrollen empfohlen werden.
In der RADICALS-RT-Studie waren Patient:innen mit Hochrisikofaktoren (GS≥8; pT3b; pN1) unterrepräsentiert. Bei diesen Patient:innen kann individuell eine adjuvante Radiotherapie diskutiert werden, eventuell auch in Kombination mit einer Androgendeprivationstherapie.
Literatur:
1 Hamdy FC et al.: Fifteen-year outcomes after monitoring, surgery, or radiotherapy for prostate cancer. N Engl J Med 2023; 388(17): 1547-58 2 Dearnaley D et al.: Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 2016; 17(8): 1047-60 3 Widmark A et al.: Ultra-hypofractionated versus conventionally fractionated radiotherapy for prostate cancer: 5-year outcomes of the HYPO-RT-PC randomised, non-inferiority, phase 3 trial. Lancet 2019; 394(10196): 385-95 4 Attard G et al.: Abiraterone acetate and prednisolone with or without enzalutamide for high-risk non-metastatic prostate cancer: ameta-analysis of primary results from two randomised controlled phase 3 trials of the STAMPEDE platform protocol. Lancet 2022; 399(10323): 447-60 5 Parker CC et al.: Timing of radiotherapy (RT) after radical prostatectomy (RP): long-term outcomes in the RADICALS-RT trial (NCT00541047). Ann Oncol 2024; 35(7): P656-66
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...