Moderne Herzschrittmacher: Entwicklung & aktuelle Konzepte
Autorin:
Dr. Taemi Yoshida
2. Medizinische Abteilung mit Kardiologie und internistischer Intensivmedizin
Klinik Landstraße, Wien
E-Mail: taemi.yoshida@gmx.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Herzschrittmacher sind längst mehr als einfache Taktgeber. Technologische Innovationen verfolgen unterschiedliche Strategien und erfordern eine individualisierte Systemwahl – entweder zur möglichst physiologischen Stimulation oder zur Reduktion implantatassoziierter Komplikationen.
Keypoints
-
CSP ermöglicht eine physiologische Aktivierung des kardialen Reizleitungssystems und kann Pacing-assoziierte Kardiomyopathien verhindern.
-
Die Studienlage zeigt für CSP Vorteile gegenüber konventionellem rechtsventrikulärem Pacing sowie eine Nichtunterlegenheit im Vergleich mit CRT.
-
Sondenlose Schrittmacher sind bei Patienten mit eingeschränktem venösem Zugang oder erhöhtem Infektionsrisiko eine wertvolle therapeutische Option.
-
Aufgrund spezifischer Limitationen sollten sondenlose Schrittmachersysteme nur nach sorgfältiger individueller Indikationsstellung eingesetzt werden.
Der erste permanente Herzschrittmacher wurde im Jahr 1958 implantiert. Seitdem hat sich die Schrittmachertherapie erheblich weiterentwickelt, mit dem Ziel, eine möglichst physiologische kardiale Erregung und Kontraktion zu erreichen.
Stellenwert physiologischer kardialer Erregung
Konventionelle Schrittmachersysteme stimulieren den rechten Vorhof und/oder den rechten Ventrikel, wobei die ventrikuläre Elektrode meist apikal platziert wird. Diese rechtsventrikuläre apikale Stimulation führt zu einer nichtphysiologischen Erregungsausbreitung mit langsamer myokardialer Aktivierung beider Ventrikel und verspäteter Erregung der posterolateralen Wand des linken Ventrikels. Elektrokardiografisch zeigt sich ein Linksschenkelblock-ähnliches QRS-Muster, mechanisch eine intra- und interventrikuläre Dyssynchronie, die insbesondere bei hohem Stimulationsanteil (≥20%) zu einer Verschlechterung der linksventrikulären systolischen Funktion bis hin zu einer durch „Pacing“(Stimulation)-induzierten Kardiomyopathie führen kann.
Für die Behandlung dieser Dyssynchronie wurde die kardiale Resynchronisationstherapie (CRT) etabliert. Hierbei wird zusätzlich zur rechtsventrikulären Elektrode eine linksventrikuläre Elektrode über dem Koronarsinus an der (postero-)lateralen Wand des linken Ventrikels positioniert. Große randomisierte Studien wie COMPANION und MADIT-CRT zeigten eine prognostische Verbesserung bei Patienten mit schwer eingeschränkter linksventrikulärer Funktion und Linksschenkelblock, einschließlich eines durch Pacing induzierten Linksschenkelblocks. Limitationen der CRT bestehen jedoch in anatomischen Einschränkungen des Koronarsinus und einem relevanten Anteil an Nonrespondern.
Zur weiteren Reduktion von Pacing-induzierter Herzinsuffizienz wurde das „conduction system pacing“ (CSP) entwickelt, bei dem das kardiale Reizleitungssystem direkt stimuliert wird. Das Pacing des His-Bündels erlaubt eine nahezu physiologische Erregung, ist jedoch technisch anspruchsvoll und mit steigenden Reizschwellen im Langzeitverlauf assoziiert. Als Weiterentwicklung wurde das Pacing des linksventrikulären Reizleitungssystems distal des His-Bündels etabliert: das „left bundle branch pacing“ (LBBP). Der proximale Anteil des Purkinjefasersystems mit seinen (meist drei, gelegentlich vier) Faszikeln verläuft im basalen interventrikulären Septum in Richtung Apex. Dieses Septum ist dicker und überwiegend muskulär aufgebaut, was eine stabile Fixierung der Schraubelektrode erleichtert.
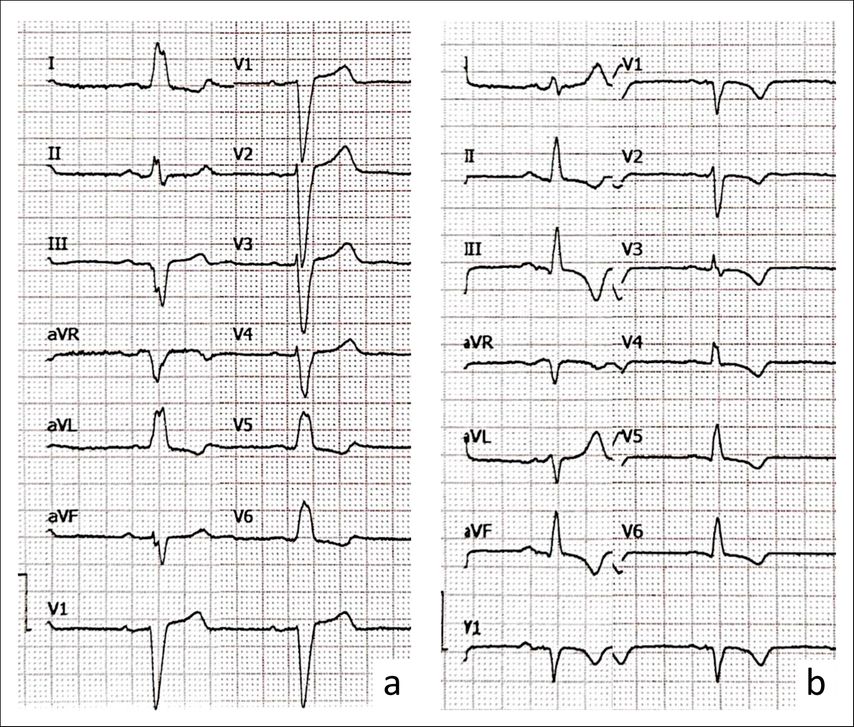
Die Faszikel liegen in unterschiedlicher Tiefe innerhalb des Septums. Mit zunehmender Eindringtiefe der Elektrode können – in dieser Reihenfolge – der rechte Faszikel, der linksposteriore, der linksseptale und schließlich der linksanteriore Faszikel erfasst und direkt stimuliert werden. Aufgrund der feinen Struktur der Faszikel ist eine selektive Erfassung nicht immer möglich. Dennoch kann in den meisten Fällen eine deutlich schmalere QRS-Morphologie im Vergleich zur konventionellen rechtsventrikulären Stimulation erreicht werden (Abb.1).1
Abb. 1: EKG-Beispiel einer Patientin mit AV-Block Typ Mobitz II und Linksschenkelblock vor (a) und nach (b) Implantation eines Schrittmachers mit „left bundle branch pacing“
Die bisherige Studienlage, überwiegend mit kleineren Patientenkollektiven, deutet darauf hin, dass CSP nicht nur elektrokardiografische („kosmetische“) Verbesserungen bewirkt, sondern auch klinische Vorteile bietet. In der randomisierten Prague-CSP-Studie wurden 249 Patienten entweder einer konventionellen rechtsventrikulären Stimulation oder einer CSP-Strategie zugeteilt [His-Bündel-Pacing: n=10; „left bundle branch area pacing“ (LBBAP): n=96, „deep septal pacing“: n=15). CSP war mit einem signifikant geringeren Abfall der linksventrikulären Ejektionsfraktion assoziiert. Harte klinische Endpunkte (kardialer Tod, CRT-Upgrade, Hospitalisierung wegen Herzinsuffizienz) unterschieden sich zwischen den Gruppen nicht signifikant.2
In zwei kleinen randomisierten Studien wurde CSP direkt mit CRT verglichen. In der randomisiert kontrollierten LBBP-RESYNC-Studie wurden 40 Patienten mit nichtischämischer Kardiomyopathie und hochgradig eingeschränkter Linksventrikelfunktion randomisiert. Die CSP-Implantation war in 90% erfolgreich (8 selektives, 10 nichtselektives LBBP), während die CRT-Implantation in 80% erfolgreich war. Nach sechs Monaten zeigte sich in der CSP-Gruppe eine größere Verbesserung der linksventrikulären Ejektionsfraktion. In der „Intention to treat“-Analyse stieg die EF in der CSP-Gruppe von 28,3 ± 5,3% auf 49,4 ± 13,2%, in der CRT-Gruppe von 31,1 ± 5,6% auf 46,5 ± 9,4%. In der Analyse per Protokoll war der Unterschied noch ausgeprägter.3
Die randomisiert kontrollierte CSP-SYNC-Studie schloss insgesamt 62 Patienten mit ischämischer und nichtischämischer Kardiomyopathie ein und verglich LBBAP mit CRT im Rahmen einer Nichtunterlegenheitsanalyse. Nach sechs Monaten betrug die EF-Verbesserung 14,0% (95%CI: 11,2–16,8) in der LBBAP-Gruppe gegenüber 8,5% (95% CI: 5,6–11,2) in der CRT-Gruppe. Nach 12 Monaten nahm die Verbesserung in beiden Gruppen weiter zu. Auch die klinische Symptomatik, gemessen anhand des NYHA-Stadiums und der 6-Minuten-Gehstrecke, verbesserte sich signifikant. Eine NYHA-Verbesserung um mindestens eine Klasse wurde nach 6 Monaten bei 65% der Patienten in der LBBAP-Gruppe und bei 52% in der CRT-Gruppe erreicht, womit die Nichtunterlegenheit von CSP bestätigt wurde.4
Aufgrund der bislang noch begrenzten Evidenzlage werden CSP-Systeme derzeit insbesondere bei Patienten empfohlen, bei denen ein ventrikulärer Stimulationsanteil von mehr als 20% zu erwarten ist. Bei Patienten mit reduzierter linksventrikulärer Ejektionsfraktion (<40%) bleibt die kardiale Resynchronisationstherapie (CRT-Pacemaker [CRT-P]; CRT-Defibrillator [CRT-D])weiterhin die Therapie der ersten Wahl, wobei CSP als alternative Option in Betracht gezogen werden kann.
Reduktion Device-assoziierter Infektionen
Device-assoziierte Infektionen zählen zu den am schwersten wiegenden Komplikationen der Schrittmachertherapie. Die Inzidenz liegt bei konventionellen Schrittmachern bei etwa 0,5–2% und steigt bei komplexeren Systemen wie ICD und CRT-D auf bis zu 5%. Hauptinfektionsquelle ist die Haut, insbesondere die Aggregattasche, weshalb Infektionen gehäuft im Zusammenhang mit Generatorwechseln auftreten. Eine bestätigte Device-Infektion erfordert in der Regel die vollständige Explantation des Systems einschließlich aller Sonden sowie eine systemische antibiotische Therapie. Bei Schrittmacherabhängigkeit ist eine temporäre Schrittmachertherapie bis zur Reimplantation notwendig. Neben der klinischen Bedeutung ist die Device-Infektion auch gesundheitsökonomisch relevant, mit durchschnittlichen Behandlungskosten von rund 10700 Euro.5 Weitere Komplikationen wie Sondendislokationen, Sondenbrüche oder Schrittmacher-assoziierte Trikuspidalklappeninsuffizienz sind ebenfalls unmittelbar an Sonden und Aggregattaschen gebunden.
Zur Vermeidung dieser Sonden- und Taschen-assoziierten Komplikationen wurden sondenlose Schrittmachersysteme entwickelt. Nach ersten Konzepten in den 1970er-Jahren wurde 2012 das erste kommerzielle System eingeführt. Die Implantation erfolgt perkutan über eine femorale Schleuse direkt in den rechten Ventrikel, mit Fixation über Häkchen oder Schraubmechanismen und intraoperativer Prüfung des „Sensing“ (Wahrnehmung) und der Reizschwellen.
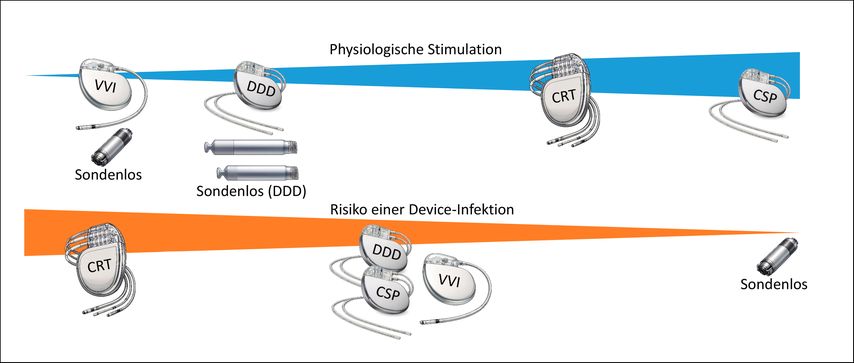
Die Infektionsrate bei sondenlosen Systemen ist in großen Registern nahezu null (Abb.2). Dem stehen spezifische Risiken gegenüber, insbesondere eine leicht erhöhte Rate an Perikardtamponaden im Vergleich zu konventionellen Systemen. Risikofaktoren sind höheres Alter, niedriges Körpergewicht, weibliches Geschlecht sowie relevante Komorbiditäten wie Herzinsuffizienz, COPD, vorausgegangener Myokardinfarkt oder Dialysepflichtigkeit.6 Eine septale Implantationsposition kann das Risiko reduzieren.
Abb. 2: Schrittmachersysteme im Spannungsfeld zwischen physiologischer Erregungsausbreitung und Device-assoziiertem Infektionsrisiko
Langzeitdaten zeigen für etablierte Systeme eine Batterielaufzeit etwa von bis zu zwölf Jahren. Nach Batterieerschöpfung ist die Implantation mehrerer Geräte im rechten Ventrikel möglich, wenngleich die Suche nach geeigneten Implantationsstellen zunehmend anspruchsvoll wird. Parallel wurden Techniken zur Explantation entwickelt, wobei in Einzelfällen, publiziert als Fallberichte, auch bis zu sieben Jahre alte Systeme erfolgreich entfernt werden konnten.7
Die ersten Generationen sondenloser Schrittmacher (Micra™ von Medtronic) erlaubten ausschließlich eine VVI-Stimulation. Durch Weiterentwicklung der Sensorik und Software konnte ein System etabliert werden, das mechanische Vorhofkontraktionen erkennt und eine VDD-Stimulation ermöglicht, bei der die ventrikuläre Stimulation an die atriale Aktivität gekoppelt wird. Diese AV-Synchronisation ist allerdings auf Herzfrequenzen bis etwa 110/min limitiert und damit insbesondere für jüngere oder körperlich aktive Patienten nur eingeschränkt geeignet.
Ein weiterer Entwicklungsschritt wurde mit dem Aveir™-System (Abbott) erreicht. Hierbei handelt es sich um ein modulares System mit einem sondenlosen Aggregat im rechten Vorhof und einem zweiten im rechten Ventrikel. Beide Einheiten kommunizieren über eine energiearme intrakardiale Kommunikation (i2i-Kommunikation) miteinander und ermöglichen eine echte DDD-Stimulation.
Trotz dieser Fortschritte bleibt ein wesentlicher Nachteil sondenloser Systeme bestehen: Im Gegensatz zur Entwicklung konventioneller Schrittmacher hin zu einer möglichst physiologischen Erregung erlaubt die aktuelle Generation sondenloser Systeme lediglich eine rechtsventrikuläre Stimulation, meist im apikalen oder septalen Bereich. Erste hybride Ansätze, wie die Kombination eines sondenlosen linksventrikulären Systems mit einem konventionellen Schrittmacher (WiSE-CRT), wurden 2022 publiziert, haben jedoch bislang keine breite klinische Anwendung gefunden.8
Ein sondenloses CSP befindet sich derzeit in der Entwicklung. Erste Ergebnisse aus einer kleinen Serie von 14 Implantationen wurden im August 2025 veröffentlicht. Die Erfolgsrate einer stabilen Schenkelerfassung („capture“) liegt bislang unter der der konventionellen CSP-Systeme und belastbare Langzeitdaten, insbesondere zu Spätkomplikationen, fehlen derzeit noch.9
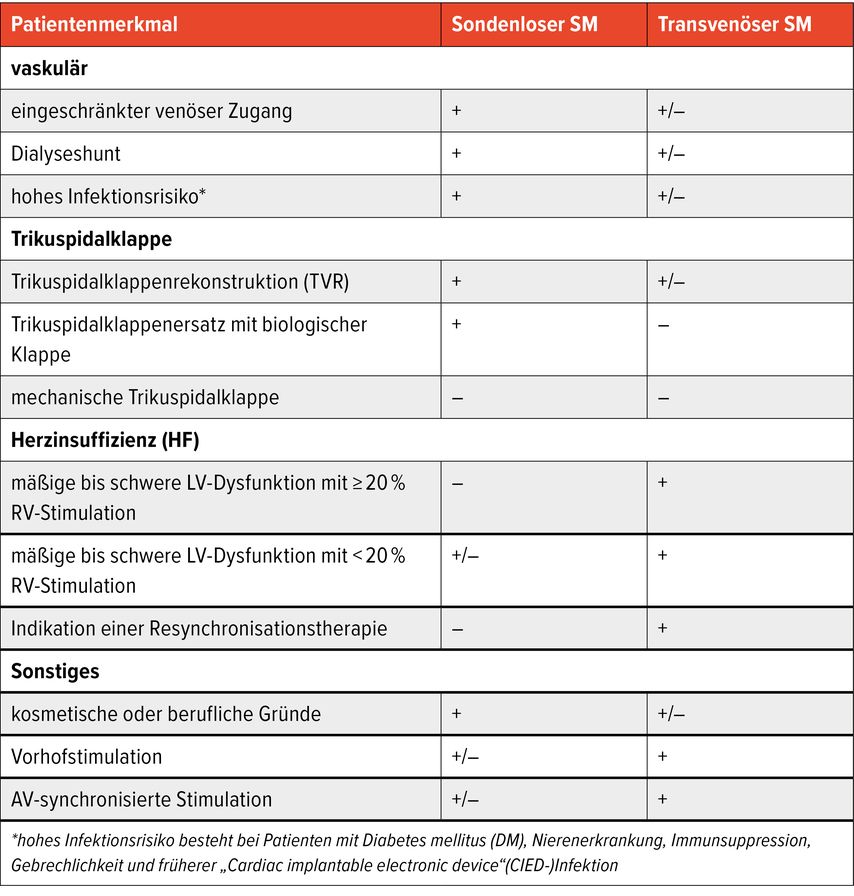
Ein weiterer relevanter Nachteil sondenloser Schrittmachersysteme sind die hohen Kosten. Der Preis liegt aktuell bei etwa dem Zehnfachen eines konventionellen Einkammerschrittmachers. Aktuell sind sondenlose Schrittmacher insbesondere bei Patienten mit eingeschränktem venösem Zugang, Dialyseshunt, hohem Infektionsrisiko oder signifikanter Trikuspidalklappenerkrankung sinnvoll. Kontraindiziert sind sie bei mechanischem Trikuspidalklappenersatz. Relative Kontraindikationen bestehen bei deutlich reduzierter linksventrikulärer Funktion und zu erwartendem hohem Stimulationsanteil (Tab.1).5
Tab. 1: Indikation für sondenlosen und transvenösen Schrittmacher (modifiziert nach Saleem-Talib S et al. 2025)5
Blick in die Zukunft
Die Entwicklung in der Medizintechnik ist rasant. Im April 2025 wurde ein experimenteller Herzschrittmacher vorgestellt, der kleiner als ein Reiskorn ist (1,8mm breit, 3,5mm lang und 1mm dick).10 Das System kann injiziert werden; die Rhythmusdetektion erfolgt über ein externes, tragbares Hautgerät, während der Stimulationsbefehl mittels Infrarotlicht übertragen wird und die Energiegewinnung aus den Elektrolyten des Blutes erfolgt. Der intrakardiale Anteil des Schrittmachers ist bioresorbierbar und löst sich nach Beendigung der Funktion vollständig im Körper auf, sodass eine chirurgische Entfernung nicht erforderlich ist. Dieses Konzept richtet sich insbesondere an Neugeborene mit angeborenen Herzfehlern, bei denen nur eine temporäre Schrittmachertherapie notwendig ist.
Fazit
Praxistipp
Die Wahl des Schrittmachers ist heute keine Standardentscheidung mehr, sondern sollte konsequent individualisiert erfolgen.Die aktuelle Entwicklung der Schrittmachertherapie verfolgt zwei zentrale Strategien: einerseits die direkte Stimulation des kardialen Reizleitungssystems zur Ermöglichung einer möglichst physiologischen Erregungsausbreitung und potenziellen Korrektur elektrophysiologischer Pathologien, andererseits minimalistische Implantationskonzepte zur Reduktion Implantat-assoziierter Risiken, insbesondere von Device-Infektionen. Vor diesem Hintergrund stehen heute multiple technische Optionen zur Verfügung, deren Auswahl eine individuelle, patientenzentrierte Entscheidung erfordert.
Literatur:
1 Burri H et al.: EHRA clinical consensus statement on conduction system pacing implantation: endorsed by the Asia Pacific Heart Rhythm Society (APHRS), Canadian Heart Rhythm Society (CHRS), and Latin American Heart Rhythm Society (LAHRS). Europace 2023; 25(4): 1208-36 2 Curila K et al.: Prospective randomized trial of conduction system pacing vs right ventricular pacing for patients with atrioventricular block; Prague CSP trial. Heart Rhythm 2025; 22(10): e894-902 3 Wang Y et al.: Randomized trial of left bundle branch vs. biventricular pacing for cardiac resynchronization therapy. J Am Coll Cardiol 2022; 80(13): 1205-16 4 Žižek D et al.: Conduction system pacing vs. biventricular pacing for cardiac resynchronization: the CSP-SYNC randomized single centre study. Europace 2025; 27(9): euaf192 5 Saleem-Talib S et al.: Leadless pacing: a comprehensive review. Eur Heart J 2025; 46(21): 1979-90 6 Piccini JP et al.: Development and validation of a risk score for predicting pericardial effusion in patients undergoing leadless pacemaker implantation: experience with the Micra transcatheter pacemaker. Europace 2022; 24(7): 1119-26 7 Neuzil P et al.: MP-453087-3 removal of a chronically-implanted Micra leadless ventricular - single center experience. Heart Rhythm 2023; 20(5): 123-4 8 Okabe T et al.: Leadless left ventricular stimulation with WiSE-CRT system - initial experience and results from phase I of SOLVE-CRT study (nonrandomized, roll-in phase). Heart Rhythm 2022; 19(1): 22-9 9 Reddy VY et al.: First-in-human study of a leadless pacemaker system for left bundle branch area pacing. Heart Rhythm 2025; 22(8): 2010-7 10 Maturana J.: Kleiner als ein Reiskorn: Der kleinste Schrittmacher der Welt. https://de.euronews.com/gesundheit/2025/04/06/kleiner-als-ein-reiskorn-der-kleinste-herzschrittmacher-der-welt ; zuletzt aufgerufen am 8.1.2025
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...