MINOCA: Myokardinfarkt ohne obstruktive koronare Herzkrankheit
Autoren:
Dr. med. Sophie Degrauwe
Dr. med. Juan F. Iglesias
Prof. Dr. med. Marco Roffi
Service de Cardiologie
Hôpitaux Universitaires de Genève
Rue Gabrielle-Perret-Gentil 4, 1205 Genève
E-Mail: sophie.degrauwe@hcuge.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
MINOCA bedeutet einen dokumentierten Herzinfarkt, bei dem sich in der Koronarangiografie keine relevante koronare Herzerkrankung zeigt. MINOCA-Patienten sind jünger als Patienten mit einem durch eine obstruktive Koronarerkrankung bedingten Infarkt, und es sind überwiegend Frauen betroffen. MINOCA ist eine Arbeitsdiagnose, die den Kliniker dazu veranlassen muss, die Ätiologie zu klären, um dem Patienten eine passende Behandlung anbieten zu können.
Keypoints
-
MINOCA ist ein Syndrom, das durch das Vorliegen eines Myokardinfarkts ohne signifikante obstruktive koronare Herzkrankheit gekennzeichnet ist.
-
Bei Vorliegen eines MINOCA muss immer die Ätiologie geklärt werden.
-
Die kardiale MRT ist die Bildgebung der ersten Wahl beim MINOCA.
-
Therapie und Prognose des MINOCA richten sich nach der zugrunde liegenden Ätiologie.
Der Myokardinfarkt ohne obstruktive koronare Atherosklerose (MINOCA) ist als Syndrom gekennzeichnet durch das Vorliegen eines Myokardinfarkts ohne signifikante obstruktive epikardiale koronare Herzkrankheit (>50%) in der Koronarangiografie und ohne dass eine nicht ischämische Ätiologie wie Sepsis oder Lungenembolie vorliegt.1
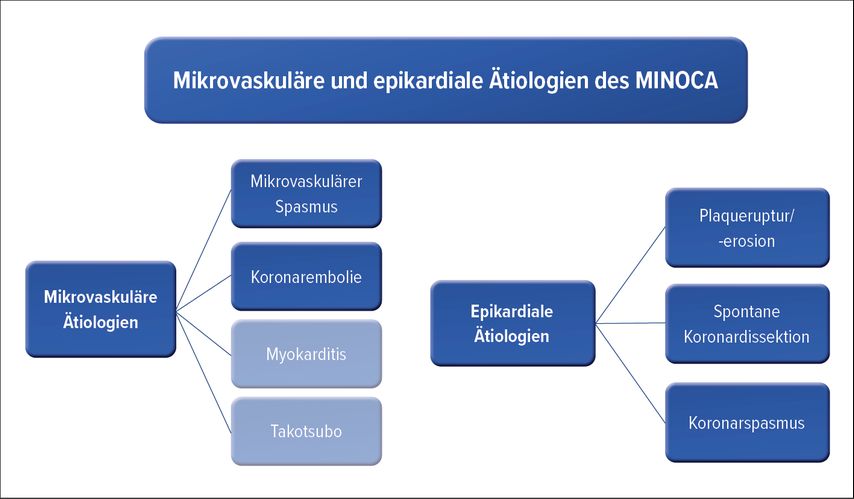
Anamnese, EKG, Bestimmung kardialer Biomarker, Echokardiografie sowie Koronarangiografie zählen zu den ersten diagnostischen Massnahmen beim MINOCA. Die kardiale MRT ist die Bildgebung der ersten Wahl. Mögliche Ätiologien des MINOCA umfassen die Ruptur und Erosion atherosklerotischer Plaques, Vasospasmus, koronare mikrovaskuläre Dysfunktion sowie spontane Koronardissektion; nicht vaskuläre Ätiologien wie akute Myokarditis und Takotsubo-Syndrom sind Teil der Arbeitsdiagnose (Abb. 1).1
Abb. 1: Die häufigsten mikrovaskulären und epikardialen Ätiologien des MINOCA. Myokarditis und Takotsubo sind Teil der Arbeitsdiagnose bis zur Durchführung eines geeigneten diagnostischen Tests
Wenn segmentale Kinetikstörungen zu erkennen sind, die einem koronararteriellen Versorgungsgebiet entsprechen, spricht das für ein epikardiales Muster; hier kommen als Ätiologien eine koronare Plaque, eine spontane Koronardissektion oder ein Koronarspasmus infrage. Segmentale Kinetikstörungen, die über ein koronararterielles Versorgungsgebiet hinausgehen, sprechen für ein mikrovaskuläres Muster und deuten in erster Linie auf einen mikrovaskulären Vasospasmus oder eine koronare Mikroembolisation hin.
Die Prognose ist beim MINOCA sehr unterschiedlich, abhängig von der Ätiologie. Im Vergleich zu Patienten mit nicht transmuralem Myokardinfarkt auf dem Boden einer obstruktiven koronaren Herzkrankheit ist bei Patienten mit MINOCA die 1-Jahres-Mortalität höher, bedingt durch die Mortalität nicht kardiovaskulärer Ursachen.2 Die Rate schwerwiegender kardiovaskulärer Ereignisse nach vier Jahren beträgt 25%, die 5-Jahres-Mortalität 11%.2 Für die Versorgung von MINOCA-Patienten ist die Identifizierung der jeweiligen Ätiologie entscheidend, um patientenspezifisch eine passende Behandlung anbieten zu können.
Epidemiologie und klinisches Bild
MINOCA-Patienten sind im Vergleich zu Patienten mit einem durch eine obstruktive Koronarerkrankung bedingten Infarkt jünger und haben weniger kardiovaskuläre Risikofaktoren. Bei 6–15% aller Herzinfarkte handelt es sich um einen MINOCA; überwiegend sind Frauen betroffen.2
Wie der Name sagt, liegt beim MINOCA ein Myokardinfarkt ohne obstruktive Erkrankung der Koronararterien vor. Zur Erinnerung: Ein Myokardinfarkt ist definiert durch eine Veränderung (Anstieg und/oder Abfall) des kardialen Troponins mit mindestens einem Wert jenseits der 99.Perzentile des Referenzgrenzwerts bei einem klinischen Bild, das mit einem Myokardinfarkt vereinbar ist.3 Das Nichtvorhandensein einer obstruktiven epikardialen koronaren Herzkrankheit ist definiert als Fehlen einer ≥50%igen Obstruktion in der diagnostischen Koronarangiografie.
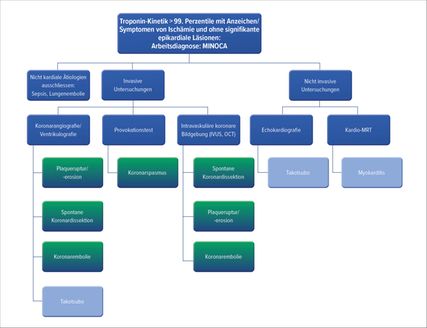
Klinische Beurteilung (Abb. 2)
Die Diagnostik des MINOCA umfasst in erster Linie Anamnese, EKG und Verlauf des kardialen Troponins. Im Elektrokardiogramm kann unabhängig von der Ätiologie des MINOCA eine ST-Senkung oder -Hebung erkennbar sein. Die Beurteilung der segmentalen Kinetik mittels Echokardiografie und/oder Ventrikulografie muss in der akuten Phase durchgeführt werden. Die kardiale MRT ist die Bildgebung der ersten Wahl für die klinische Beurteilung eines MINOCA.4 Die Morphologie-MRT lässt erkennen, welche Region des Myokards eine Schädigung aufweist (Feststellung von Ödemen, Analyse der Kontraktilität). Das Vorliegen eines etwaigen verzögerten Enhancements nach Gadolinium-Injektion und dessen Lokalisation geben Aufschluss über den Mechanismus des MINOCA. So deutet ein subendokardiales verzögertes Enhancement auf eine ischämische Ätiologie hin, ein subepikardiales verzögertes Enhancement hingegen auf eine Myokarditis.4
Abb. 2: Algorithmus für die MINOCA-Diagnostik. Myokarditis und Takotsubo sind Teil der Arbeitsdiagnose bis zur Durchführung eines geeigneten diagnostischen Tests
Mit der Koronarangiografie lässt sich feststellen, ob Koronarläsionen mit ≥50% Obstruktion vorliegen, was die Diagnose MINOCA ausschliessen würde. Eine intrakoronare Bildgebung mittels optischer Kohärenztomografie (OCT) und/oder intravaskulären Ultraschalls (IVUS) im Zuge der diagnostischen Koronarangiografie kann hilfreich sein, um eine Plaqueruptur oder -erosion, eine spontane Koronardissektion oder eine koronare Thromboembolie zu erkennen.5
Pathogenese und Behandlung
Epikardiale Ursachen
Plaqueruptur und Plaqueerosion
Bei 40% der MINOCA-Patienten wird im intrakoronaren Ultraschall eine Ruptur oder eine Erosion von Plaques festgestellt.5,6 Plaqueruptur und -erosion können in koronaren Segmenten auftreten, die bei der Koronarangiografie unauffällig oder nur geringfügig atherosklerotisch aussehen. Um die Diagnose stellen zu können, kann eine intrakoronare Bildgebung (IVUS und/oder OCT) erforderlich sein.
Die Myokardnekrose, die bei einer Plaqueruptur oder -erosion auftritt, wird durch eine Thrombose/Thromboembolie, das Hinzukommen eines Vasospasmus oder eine Kombination dieser Prozesse verursacht. Bei Patienten mit MINOCA und Plaqueruptur kann die kardiale MRT eine myokardiale Ödembildung mit oder ohne Nekrose aufzeigen, was auf eine transitorische Störung der koronaren Durchblutung in einer epikardialen Arterie hindeutet.1
Zur Behandlung von Patienten mit MINOCA infolge einer Plaqueruptur wird eine zweifache Thrombozytenaggregationshemmung für 12 Monate, gefolgt von einer lebenslangen einfachen Thrombozytenaggregationshemmung empfohlen. Begleitend zur Thrombozytenaggregationshemmung wird eine Statintherapie empfohlen.1
Spontane Koronardissektion
Die spontane Koronardissektion (SCAD) ist durch ein intramurales Hämatom in der Koronargefässwand mit oder ohne Riss der Intima gekennzeichnet.7 Von SCAD sind überwiegend (zu 90%) Frauen betroffen; sie liegt 25% der akuten Koronarsyndrome bei Frauen unter 50 Jahren zugrunde.7 Die wichtigsten prädisponierenden Faktoren für eine SCAD sind hormonelle Veränderungen (Schwangerschaft, post partum, Menopause), Pluriparität und fibromuskuläre Dysplasie.
Die Prognose stationär und nach 30 Tagen ist ausgezeichnet,7 das 5-Jahres-Rezidivrisiko ist jedoch hoch (27%).8 In der grossen Mehrheit der Fälle wird eine konservative Behandlung empfohlen, da sich bei perkutaner Behandlung die Dissektion ausweiten kann. Für die Behandlung der SCAD liegen Expertenempfehlungen vor, die im Wesentlichen Betablocker sowie Thrombozytenaggregationshemmung mit Acetylsalicylsäure und Clopidogrel über einen Zeitraum von 6–12 Monaten vorsehen.9
Koronarspasmus
Das Auftreten eines koronaren Vasospasmus ist Anzeichen einer Hyperreagibilität der glatten Muskulatur gegenüber endogenen oder exogenen vasospastisch wirkenden Substanzen (Kokain, Methamphetamin). Die Angaben zur Prävalenz von Koronarspasmen bei MINOCA-Patienten variieren zwischen 3 und 95%. Diese grosse Bandbreite der Prävalenz ist vor allem durch die Methoden bedingt, die zur Diagnose des Koronarspasmus angewendet werden. Provokationstests waren bei knapp der Hälfte der MINOCA-Patienten in einer aktuellen Studie positiv.10
Patienten mit Acetylcholin- oder Ergonovin-Provokationstest (intrakoronare Gabe) haben eine schlechtere Prognose, sowohl bezogen auf harte klinische Endpunkte (Tod jeglicher Ursache, Tod mit kardiovaskulärer Ursache, Rehospitalisierung wegen rezidivierenden akuten Koronarsyndroms) als auch auf die Lebensqualität (Status anginosus).11
Vasodilatation mit Nitraten und Kalziumantagonisten ist hier die Therapie der Wahl.1 Bei Patienten mit hohem Risiko für plötzlichen Herztod infolge eines Koronarspasmus sollte geprüft werden, ob ein implantierbarer Defibrillator indiziert ist.12
Abb. 3: MINOCA-Patienten sind jünger als Patienten mit einem klassischen Herzinfarkt, und es sind überwiegend Frauen betroffen
Mikrovaskuläre Ätiologien
Mikrovaskulärer Spasmus
Ein mikrovaskulärer Vasospasmus ist durch eine vorübergehende myokardiale Ischämie ohne zugrunde liegende epikardiale koronare Läsion gekennzeichnet. Die Diagnose kann mittels Acetylcholin-Test gestellt werden, wenn dieser eine Angina pectoris reproduziert und elektrokardiografische Zeichen einer Ischämie induziert, ohne dass ein Spasmus einer epikardialen Arterie vorliegt.11 Was die Mortalität angeht, ist die Prognose dieser Patienten gut, doch im Hinblick auf die Morbidität liegt bei annähernd einem Drittel der Patienten eine refraktäre Angina pectoris vor, selbst unter Anwendung von Kalziumantagonisten.11
Takotsubo
Ob die Takotsubo-Kardiomyopathie den Ätiologien von MINOCA zuzurechnen ist, ist umstritten. Es wird jedoch vorgeschlagen, das Syndrom bis zu einer spezifischen myokardialen Bildgebung in die Arbeitsdiagnose einzuschliessen.
Die Takotsubo- oder Stress-Kardiomyopathie manifestiert sich in den meisten Fällen als akutes Koronarsyndrom, ist durch eine vorübergehende akute linksventrikuläre Dysfunktion ohne signifikante epikardiale Stenosierung gekennzeichnet und tritt oft im Zusammenhang mit einer auslösenden Stressbelastung auf. Segmentale Kinetikstörungen sind nicht auf ein koronararterielles Versorgungsgebiet beschränkt. Eine transitorische Hypokinese/Akinesie oder Dyskinesie liegt im mittleren linksventrikulären Bereich vor, teilweise ist auch die Herzspitze betroffen.Die genaue Ätiologie des Takotsubo wird noch diskutiert (Katecholamin-induziertes «Stunning» des Myokards; mikrovaskulärer Spasmus). Unabhängig von der Ätiologie ist Takotsubo mit einer reversiblen Dysfunktion der Mikrozirkulation assoziiert.13 In der kardialen MRT ist als typisches Muster Ödembildung des Myokards zu erkennen.
Die 1-Jahres-Mortalität bei Patienten mit Takotsubo beträgt 1–2%.14 Was die Langzeitprognose angeht, so belegen Daten aus dem weltweit grössten Takotsubo-Patientenregister, welches von einem Schweizer Zentrum geführt wird, dass die Auftretenshäufigkeit schwerwiegender kardiovaskulärer Ereignisse 9,9% pro Patientenjahr beträgt, mit einer Sterblichkeit von 5,6% pro Patientenjahr.15
Die Behandlung von Takotsubo beruht auf der Anwendung von Betablockern sowie ACE-Hemmern. Bei kardiogenem Schock kann mechanische Kreislaufunterstützung angezeigt sein.1
Myokarditis
Bei bis zu einem Drittel der MINOCA-Patienten liegt eine Myokarditis vor.16
Klinisch kann sich die Myokarditis ganz unterschiedlich manifestieren, unter anderem als akutes Koronarsyndrom ohne epikardiale obstruktive Koronarläsion und mit oder ohne linksventrikuläre Dysfunktion. Retrosternale Schmerzen, ST-Strecken-Veränderungen im EKG sowie erhöhte kardiale Biomarker können auf eine myokardiale Entzündung sowie eine endotheliale Dysfunktion der koronaren Mikrozirkulation zurückgehen.1 Die häufigste Ätiologie der Myokarditis ist eine virale Infektion mit Adeno-, Herpes-, Coxsackieviren und Parvovirus B19 als häufigste Erreger. Eine Myokarditis kann auch im Rahmen einer systemischen Autoimmunerkrankung wie systemischer Lupus erythematodes auftreten.1 Die Beurteilung einer Myokarditis umfasst u.a. eine kardiale MRT. Die Myokardbiopsie stellt den diagnostischen Goldstandard dar, wird in der klinischen Praxis jedoch nicht routinemässig durchgeführt.1
Bei knapp der Hälfte der Patienten ist der klinische Verlauf nach 2–4 Wochen günstig; in einer Minderheit der Fälle verläuft die Myokarditis fulminant. Bei einer Myokarditis-induzierten linksventrikulären Dysfunktion wird eine Therapie mit Betablockern und ACE-Hemmern empfohlen.1
Koronarembolie
Sie betrifft in der Regel die Mikrozirkulation und zählt daher zu den mikrovaskulären Ätiologien des MINOCA. Die Embolie kann durch einen Thrombus koronaren oder systemischen Ursprungs verursacht werden, im Rahmen einer genetischen (Faktor-V-Leiden-Mutation, Protein-C- oder -S-Mangel) oder erworbenen Gerinnungsstörung (Antiphospholipid-Antikörper-Syndrom) oder im Zusammenhang mit Vorhofflimmern oder einer Herzklappenpathologie.11 Die paradoxe Embolie ist eine seltene MINOCA-Ursache und kann mit einem offenen Foramen ovale oder einem Atriumseptumdefekt in Verbindung stehen.11
Prognose und Therapie des MINOCA nach Koronarembolie richten sich nach der zugrunde liegenden Ätiologie.
Fazit
MINOCA ist eine heterogene Entität, die bei rund 10% der Patienten vorliegt, die wegen eines Herzinfarkts behandelt werden. Die Identifizierung der zugrunde liegenden Ätiologie mithilfe diagnostischer Algorithmen ermöglicht es, dem Patienten eine passende Behandlung anzubieten. Die langfristigen Auswirkungen der MINOCA-Behandlung auf schwerwiegende kardiovaskuläre Ereignisse muss noch in speziellen Studien und Registern untersucht werden.
Literatur:
1 Agewall S et al.: ESC working group position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J 2017; 38: 143-53 2 Tamis-Holland JE et al.: Contemporary diagnosis and management of patients with myocardial infarction in the absence of obstructive coronary artery disease: a scientific statement from the American Heart Association. Circulation 2019; 139: e891-908 3 Ibanez B et al.: ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39: 119-77 4 Hausvater A et al.: ST-segment elevation and cardiac magnetic resonance imaging findings in myocardial infarction with non-obstructive coronary arteries. Int J Cardiol 2019; 287: 128-31 5 Reynolds HR et al.: Mechanisms of myocardial infarction in women without angiographically obstructive coronary artery disease. Circulation 2011; 124: 1414-25 6 Ouldzein H et al.: Plaque rupture and morphological characteristics of the culprit lesion in acute coronary syndromes without significant angiographic lesion: analysis by intravascular ultrasound. Ann Cardiol Angiol 2012; 61: 20-6 7 Saw J et al.: Canadian spontaneous coronary artery dissection cohort study: in-hospital and 30-day outcomes. Eur Heart J 2019; 40: 1188-97 8 Tweet MS et al.: Clinical features, management and prognosis of spontaneous coronary artery dissection. Circulation 2012; 126: 579-88 9 Adlam D et al.: Spontaneous coronary artery dissection. Eur Heart J 2016; 37: 3073-4 10 Montone RA et al.: Patients with acute myocardial infarction and non-obstructive coronary arteries: safety and prognostic relevance of invasive coronary provocative tests. Eur Heart J 2018; 39: 91-8 11 Scalone G et al.: Editor’s Choice- Pathophysiology, diagnosis and management of MINOCA: an update. Eur Heart J Acute Cardiovasc Care 2019; 8: 54-62 12 Lanza GA et al.: Current clinical features, diagnostic assessment and prognostic determinants of patients with variant angina. Int J Cardiol 2007; 118: 41-7 13 Galiuto L et al.: Reversible coronary microvascular dysfunction: a common pathogenetic mechanism in apical ballooning or takotsubo syndrome. Eur Heart J 2010; 31: 1319-27 14 Elesber A et al.: Four-year recurrence rate and prognosis of the apical ballooning syndrome. J Am Coll Cardiol 2007; 50: 448-52 15 Templin C et al.: Clinical features and outcomes of takotsubo (stress) cardiomyopathy. N Engl J Med 2015; 373: 929-38 16 Tornvall P et al.: Myocarditis or „true“ infarction by cardiac magnetic resonance in patients with a clinical diagnosis of myocardial infarction without obstructive coronary disease: a meta-analysis of individual patient data. Atherosclerosis 2015; 241: 87-91
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...