Koronare Restenosen im Zeitalter der Drug-Eluting Stents – von der Pathogenesezur Behandlung
Autoren:
Dr. med. Matthias Bossard
Dr. med. Adrian Attinger
PD Dr. med. Florim Cuculi
FMH Innere Medizin und Kardiologie, spez. Interventionelle Kardiologie
Klinik für Kardiologie
Herzzentrum – Luzerner Kantonsspital
Luzern
E-Mail: matthias.bossard@luks.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz grosser Fortschritte bei der perkutanen Behandlung der koronaren Herzkrankheit und Einführung moderner medikamentenbeschichteter Stents («drug-eluting stents») ist die Restenose weiterhin ein häufiges Problem. Die Thematik von Restenose, Pathogenese, Prädiktoren und Behandlung fasst dieser Artikel zusammen.
Keypoints
-
Restenosen mit signifikanter Reduktion des Gefässlumens nach PCI und Stentimplantation bilden sich häufig als Folge von unkontrollierter Neointimaproliferation.
-
Trotz optimierter PCI-Techniken und moderner DES bleibt die Restenose ein häufiges und somit klinisch relevantes Problem. Restenosen sind assoziiert mit wiederholten Hospitalisationen, Interventionen und einem erhöhten Sterblichkeitsrisiko.
-
Die Optimierung der PCI-Technik, v.a. Implantationstechniken, Stent-/Scaffold-Technologie, wie auch die Individualisierung der Behandlungsstrategien bei der KHK sind zentral, um das Risiko für die Entwicklung von ISR weiter zu reduzieren.
Seit der Einführung der Angioplastie bei Koronarstenosen durch Andreas Grüntzig und von koronaren Stents durch Ulrich Sigwart Ende der Siebziger- respektive Achtzigerjahre stellt das Problem der Restenosen nach perkutaner Koronarintervention (PCI) die involvierten Ärzte vor grosse Herausforderungen. Mit der rasant fortschreitenden Entwicklung der PCI-Technik und vor allem der Einführung von medikamentenbeschichteten Ballons und Stents konnte die Restenoserate deutlich reduziert werden.1,2 So traten anfänglich bei 20–40% der Patienten innerhalb weniger Jahre nach PCI Restenosen auf, nach Einführung moderner medikamentenbeschichteter Stents («drug-eluting stent», DES) konnte diese Rate auf <10% reduziert werden, was aber eine beträchtlich hohe Rate bleibt und mit vielen Problemen verbunden ist.1 Die Restenose stellt somit die Achillesferse der PCI dar.
Definition und Pathogenese
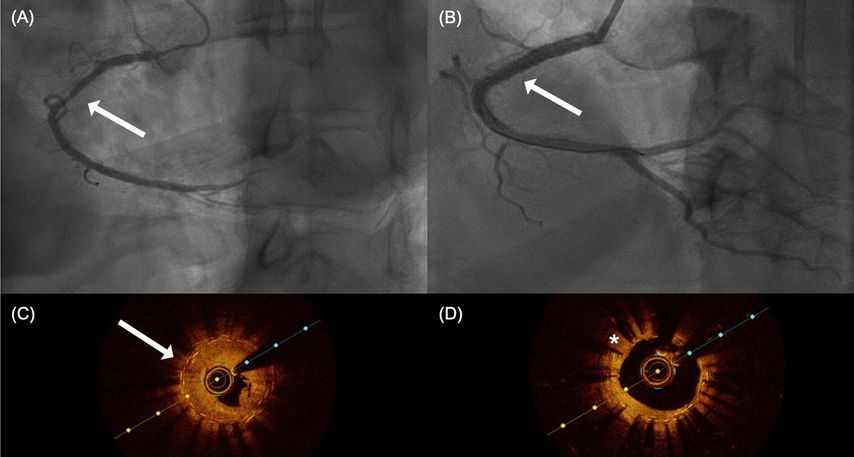
Die Restenose entsteht als Reaktion auf die Verletzung der Gefässwand durch die PCI bzw. Stentimplantation, welche schliesslich zu einer Reduktion des Gefässinnendiameters (Gefässlumen) führt. Rein angiografisch wird eine InStent-Restenose (ISR) als >50%ige Stenose innerhalb oder direkt angrenzend (≤5mm) an ein früher mittels Stents behandeltes Gefässsegment definiert.2 Bei der Entwicklung der Restenose findet sich insgesamt ein komplexes entzündlich-regeneratives Wechselspiel zwischen den zellulären Bestandteilen der koronaren Gefässwand, v.a. des Endothels und den glattwandigen Myozyten sowie den Mono-, Lympho- und Thrombozyten.2 Nach reiner Ballonangioplastie finden sich bei der Entwicklung einer Restenose v.a. Umbauvorgänge in der Gefässwand (v.a. «remodelling» und «recoil»). Dieser Prozess ist v.a. durch ein Remodelling (Umbau der Gefässwandstrukturen im Rahmen des Heilungsprozesses) oder ein Recoil (Wiederverengung der Koronargefässe) bedingt.2 Wohingegen es bei ISR häufig zu einer exzessiven Proliferation von Initimagewebe (Neointimahyperplasie) und einer sogenannten Neoatherosklerose (Entwicklung von lipidreichen Plaques im gestenteten Segment) kommt.2 ISR wird sowohl nach Implantation von rein metallischen Stents («bare-metal stents», BMS) wie auch DES beobachtet.2 Mittels Einführung antiproliferativer Substanzen (Paclitaxel oder «-limus»-Analoga) konnte das Risiko für eine exzessive Neointimahyperplasie-Entwicklung deutlich reduziert werden (Abb. 1).
Abb. 1:Reduktion der Neointimahyperplasie mittels antiproliferativer Substanzen. Vergleich Abbildungen A/C versus B/D
Risikofaktoren für Restenosen
Tab. 1: Faktoren, welche die Entwicklung von Restenosen begünstigenBMS: «bare-metal stent»; DES: «drug-eluting stent»; MLD: minimaler Lumendiameter; PCI: perkutane Koronarintervention
Über die letzten drei Jahrzehnte wurden viele Risikofaktoren für die Entwicklung von Restenosen (v.a. ISR) identifiziert, wobei das Ineinandergreifen von Patienten-, Läsionen- und PCI-assoziierten Faktoren schlussendlich zum Problem führt (Tab.1). In diesem Zusammenhang sind sicherlich der Diabetes mellitus und die Niereninsuffizienz als wichtigste Patientenfaktoren für die Entwicklung einer ISR hervorzuheben.3 Es ist jedoch auch anzumerken, dass mit zunehmender Komplexität und Länge der behandelten Läsion das Risiko für die Entwicklung von ISR zunimmt.3
Von interventioneller Seite her ist es so, dass eine Unterexpansion des implantierten Stents sicherlich die häufigste Ursache für ISR darstellt. Hierbei spielen mangelnde Vorbehandlung der Läsion («lesion preparation»), Implantation von zu kleinen Stents («undersizing»), fehlende Nachdilatation und das Nichtabdecken der kompletten Läsion («geographic miss») eine zentrale Rolle.3 Des Weiteren können auch Frakturen der Stents (z.B. bei sehr tortuösen Gefässen) die Entwicklung von ISR begünstigen.3
Wir müssen uns auch bewusst sein, dass das Vorhandensein einer Restenose per se einen relevanten Risikofaktor für das erneute Auftreten einer Restenose darstellt. So hatten beispielsweise laut einer kürzlich publizierten Studiefast 20% aller Patienten, welche für ISR nach DES-Implantation mittels medikamentenbeschichteter Ballons («drug-coated balloon», DCB) behandelt werden mussten, im Verlauf von 6–9 Monaten eine erneute Restenose.4
Die neuen Stents
Die Optimierung der Stentplattformen (bspw. «Thin-Strut»-Cobalt-Chrom-Stents mit Strebendiameter von 60–80μm), die Einführung neuer antiproliferativer Substanzen («-limus-Stents» mit bspw. Sirolimus-, Everolimus- oder Zotarolimus-Beschichtungen) und zuletzt optimierte oder fehlende Polymere, welche als Verbindungsmoleküle/Träger für das «-limus»-Analogum auf der metallischen Stentplattform verwendet werden, reduzierten das Risiko für Neointimahyperplasie und Neoatherosklerose weiter und verbesserten die PCI-Outcomes drastisch.2 Dies hatte auch zur Folge, dass es nun den interventionellen Kardiologen möglich ist, Läsionen perkutan zu behandeln, welche bis vor wenigen Jahren nur mittels Bypass-Operation versorgt werden konnten.
Von der Restenose zur Klinik
Klinisch kann eine Restenose über lange Zeit unbemerkt bleiben. In der Regel äussert sich diese durch das Auftreten von ischämieassoziierten Symptomen (typischerweise Angina und Dyspnoe) oder stummer Ischämie (bspw. im Rahmen einer Ergometrie mit ST-Senkungen), sobald die Stenosierung hämodynamisch relevant wird und damit eine myokardiale Durchblutungsstörung verursacht. Interessanterweise fand eine kürzlich publizierte Analyse, dass sich Restenosen sehr häufig akut im Sinne eines akuten Koronarsyndroms (ACS) manifestieren (bspw. mit instabiler Angina).5 Entsprechend sollten Kliniker auch hellhörig werden, wenn Patienten mit einer PCI in der Vorgeschichte über erneute ischämieverdächtige Symptome klagen. Die ISR ist gemeinhin bekannt als unabhängiger Prädiktor für eine erhöhte Morbidität und Mortalität von Patienten mit koronarer Herzkrankheit (KHK) und muss ernst genommen werden.6 Aus diesem Grund ist es zentral, Patienten nach einer PCI in regelmässigen Abständen klinisch zu kontrollieren. Wobei häufig die Anamnese und ein einfacher Belastungstest, wie beispielsweise die Ergometrie, in periodischen Abständen ausreichen können. Die Durchführung nicht invasiver Ischämietests (bspw. Myokardperfusionsszintigrafie oder Kardio-MRT) wie auch Re-Koronarangiografien werden in der Regel nur empfohlen, falls eine suggestive Symptomatik vorliegt (z.B. progrediente Angina oder Leistungsknick) oder der hochgradige Verdacht auf eine relevante stumme Ischämie besteht.
Von der Prävention zur Behandlung von Restenosen
Unabhängig davon, ob eine Restenose oder eine native Läsion behandelt wurde, steht nach PCI mit oder ohne Implantation von Stents primär die optimale medikamentöse Therapie der zugrunde liegenden KHK im Vordergrund. Das bedeutet, dass neben der dualen antithrombotischen Therapie mit Plättchenhemmern – in der Regel mit Aspirin und einem P2Y12-Inhibitor (Clopidogrel, Ticagrelor oder Pasugrel) – die kardiovaskulären Risikofaktoren optimal versorgt werden sollten. Es ist naheliegend, dass die aggressive Lipidsenkung (heutiger LDL-Cholesterinzielwert <1,4mmol/l bzw. 54mg/dl), Nikotinkarenz sowie Diabetesbehandlung das Risiko für eine Restenose sowie die Progression der KHK reduzieren. Es ist jedoch auch anzumerken, dass die Plättchenhemmer primär das Risiko für ischämische Events, im Sinne akuter Myokardinfarkte und Stentthrombosen, reduzieren, jedoch wenig Einfluss auf die Progression der Restenosen haben.
Bis vor wenigen Jahren wurden Restenosen in der Regel primär mittels reiner Ballonangioplastie («plain old balloon angioplasty», POBA) oder direkter Implantation einer neuen Lage von Stents behandelt. Dies war leider oftmals nicht sehr effizient und viele Patienten erhielten schlussendlich multiple Lagen und vor allem auch sehr lange Segmente mit Stents implantiert, was oftmals das sogenannte «Onion-Skin-Phänomen» (Abb. 2) oder eine «Full-Metal-Jacket» aufgrund des ausdehnten Stentings zur Folge hatte.
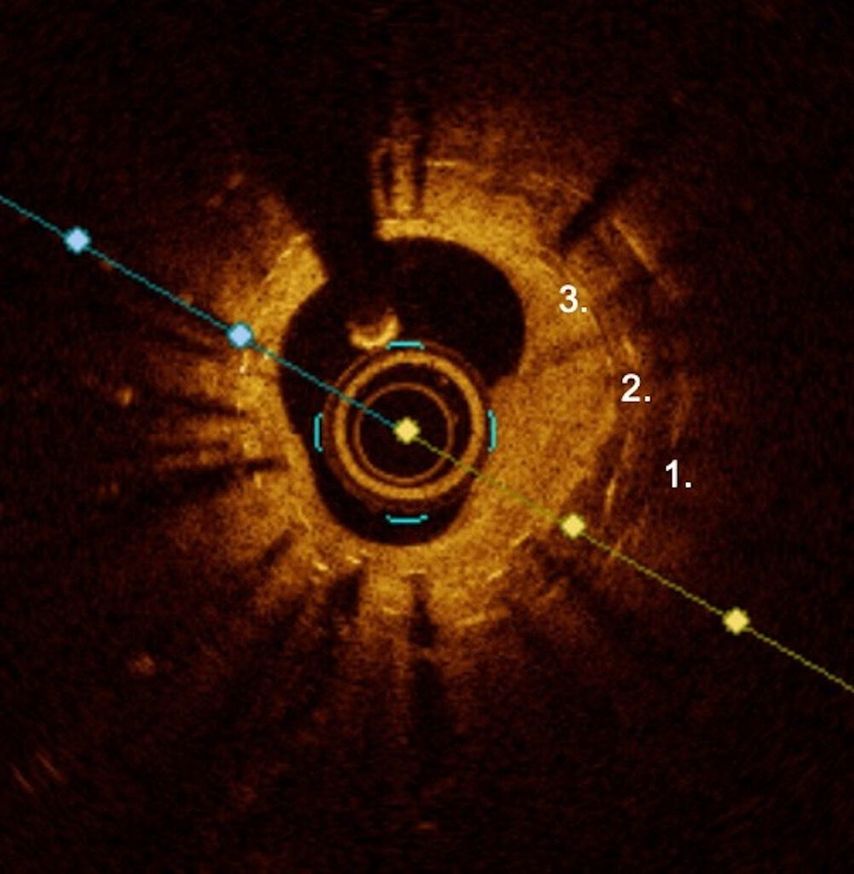
So haben sich nun die Optionen, welche zur ISR-Behandlung eingesetzt werden können, vervielfacht und es sollte ein auf die spezifischen Charakteristika der ISR-Läsion zugeschnittener Therapieansatz gewählt werden. Es empfiehlt sich, wann immer möglich intravaskuläres Imaging – intrasvaskulären Ultraschall (IVUS) oder optische Kohärenztomografie (OCT) – einzusetzen, um die Mechanismen, welche zur ISR führten, zu ergründen.7 Entsprechend sollte diese dann auch korrigiert werden.
Eine Unterexpansion des Stents kann beispielsweise mittels aggressiver Nachdilatation mit sogenannten «non-compliant balloons» (z.B. mit OPN NC Ballon®) verbessert werden. Fibrotische Plaques oder eine exzessive Neointimahyperplasie können mittels «cutting/scoring balloon» bearbeitet werden, damit man schlussendlich wieder Lumen gewinnt. Bei sehr verkalkten ISR-Läsionen ist man gezwungen, unter Umständen apparative Methoden wie mechanische Atherektomie/Rotablation®, Laser-Atherektomie oder intravaskuläre Lithoplastie (Shockwave®) zu verwenden.8
Der Anspruch, eine Restenose «metallfrei» zu behandeln und das «Onion-Skin- Phänomen» zu verhindern, hat die Entwicklung von medikamentenbeschichteten Ballons vorangetrieben.2,8 Die Grundidee besteht darin, dass man nach dem Dilatieren der Stenose eine antiproliferative Substanz (Paclitaxel oder Sirolimus) aufträgt, welche die Neointimahyperplasie-Entstehung unterbinden soll. So wurden mit diesen Grundgedanken auch bioresorbierbare Scaffolds bei ISR getestet. Ob man nun ISR besser mit DCB oder DES behandelt, wird weiterhin diskutiert. Verschiedene Studien und auch Metaanalysen haben Hinweise geliefert, dass Läsionen, welche mit modernen DES, v.a. Everolimus-beschichteten Stents (bspw. Xience® DES), behandelt werden, wahrscheinlich die besseren Langzeitresultate haben.1,7,8 Es besteht nun jedoch auch ein Konsens, dass man die Behandlung der Restenose spezifisch an die zugrunde liegende Therapie anpassen sollte. So scheinen zum Beispiel moderne DES insbesondere bei Neoatherosklerose den DCB gegenüber überlegen zu sein.8
Literatur:
1 Siontis GC et al.: Percutaneous coronary interventional strategies for treatment of in-stent restenosis: a network meta-analysis. Lancet 2015; 386: 655-64 2 Buccheri D et al.: Understanding and managing in-stent restenosis: a review of clinical data, from pathogenesis to treatment. J Thorac Dis 2016; 8: E1150-62 3 Dangas GD et al.: In-stent restenosis in the drug-eluting stent era. J Am Coll Cardiol 2010; 56: 1897-907 4 Cassese S et al.: Incidence and predictors of reCurrent restenosis after drug-coated balloon Angioplasty for Restenosis of a drUg-eluting Stent: The ICARUS Cooperation. Rev Esp Cardiol (Engl Ed) 2018; 71: 620-7 5 Moussa ID et al.: Trends and outcomes of restenosis after coronary stent implantation in the United States. J Am Coll Cardiol 2020; 76: 1521-31 6 Cassese S et al.: Prognostic role of restenosis in 10 004 patients undergoing routine control angiography after coronary stenting. Eur Heart J 2015; 36: 94-9 7 Neumann FJ et al.: 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2019; 40: 87-165 8 Shlofmitz E et al.: Restenosis of drug-eluting stents: a new classification system based on disease mechanism to guide treatment and state-of-the-art review. Circ Cardiovasc Interv 2019; 12: e007023
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...