Implantierbare kardiale Monitore bei Hochrisikopatienten nach Myokardinfarkt: Ergebnisse der SMART-MI-Studie
Autor:
Prim. Univ.-Prof. Dr. Axel Bauer
Vorstand Medizinische Klinik III
Abteilung für Kardiologie und Angiologie
Medizinische Universität Innsbruck
E-Mail: axel.bauer@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die meisten Komplikationen nach einem Myokardinfarkt ereignen sich bei Patienten mit nur mittelgradig eingeschränkter oder erhaltener linksventrikulärer Ejektionsfraktion (LVEF). Für diese Patienten existieren bislang keine präventiven Strategien.1
Keypoints
-
Die Mehrzahl aller kardiovaskulären Komplikationen nach Myokardinfarkt ereignet sich bei Patienten mit einer linksventrikulären Ejektionsfraktion von über 35%.
-
Digitale EKG-basierte Biomarker identifizieren Hochrisikopatienten nach Myokardinfarkt mit LVEF 36–50%.
-
Die Ergebnisse der SMART-MI-Studie zeigen, dass diese Patienten von einer kontinuierlichen telemetrischen Risikoüberwachung mittels implantierbarer kardialer Monitore profitieren könnten.
-
Hierdurch sensitiv erfasste, meist asymptomatische schwere Arrhythmien zeigen spätere klinische Komplikationen frühzeitig an, wodurch sich ein Fenster für diagnostische und therapeutische Interventionen öffnen könnte.
Die Gruppe der Postinfarktpatienten mit LVEF >35% ist groß und das individuelle Risiko heterogen, sodass eine akkurate Risikostratifizierung von entscheidender Bedeutung ist. Die Beurteilung kardialer autonomer Steuerungsprozesse könnte hierbei einen Schlüssel darstellen. Schädigungen des kardialen autonomen Nervensystems nach einem Myokardinfarkt sind häufig und mit einer ungünstigen Prognose vergesellschaftet. Die Analyse biologischer Signale, in welchen sich autonome Steuerungsprozesse widerspiegeln, erlaubt einen nicht invasiven und praktikablen diagnostischen Zugang zum kardialen autonomen Nervensystem. Mittels moderner EKG-basierter Biomarker ist es möglich, Hochrisikopatienten nach Myokardinfarkt mit LVEF 36–50% zu identifizieren, deren Prognose sich praktisch nicht von Hochrisikopatienten mit LVEF ≤35% unterscheidet.2
Aus klinischen Studien an Postinfarktpatienten mit eingeschränkter LV-Funktion ist bekannt, dass asymptomatische Rhythmusereignisse schweren klinischen Komplikationen vorausgehen können.3 Subkutane implantierbare kardiale Monitore („implantable cardiac monitors“ – ICM) können diese mit hoher Empfindlichkeit erfassen und es hierdurch ermöglichen, drohende klinische Komplikationen frühzeitig vorherzusagen.
Die SMART-MI-Studie
In der SMART-MI-Studie wurde nun erstmalig das Konzept verfolgt, Risikopatienten nach Myokardinfarkt, welche nicht die etablierten Kriterien für eine prophylaktische Defibrillatorimplantation erfüllen, kontinuierlich telemetrisch zu überwachen. Ziel ist hierbei die frühzeitige Identifizierung von Vorboten gefährlicher Komplikationen, was perspektivisch eine personalisierte Prävention ermöglichen könnte. Die Ergebnisse der SMART-MI-Studie wurden im Rahmen einer Hotline-Sitzung auf der Jahrestagung der Europäischen Gesellschaft für Kardiologie 2021 präsentiert und Anfang des Jahres publiziert.4
Methodik
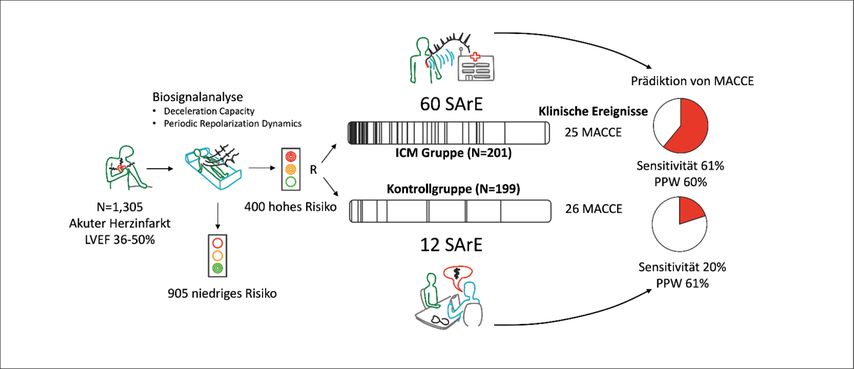
Die SMART-MI-Studie (NCT 02594488) war eine prospektive, multizentrische, randomisierte, offene, kontrollierte diagnostische Studie, die an insgesamt 33 Zentren in Deutschland und Österreich durchgeführt wurde. Abbildung 1 zeigt eine grafische Zusammenfassung der Studie. Überlebende eines akuten Myokardinfarktes mit LVEF 36–50% wurden einer 20-minütigen Biosignalmessung mittels eines hochaufgelösten EKGs unterzogen. Mit der Dezelerationskapazität des Herzens („deceleration capacity“ – DC)5 und der periodischen Repolarisationsdynamik („periodic repolarization dynamics“ – PRD)6 wurden zwei digitale Biomarker bestimmt, welche vagale und sympathische Regulationsprozesse charakterisieren.
Abb. 1:Grafische Übersicht über die SMART-MI-Studie. 1305 Postinfarktpatienten mit linksventrikulärer Ejektionsfraktion (LVEF) 36–50% wurden mittels Biosignalanalyse stratifiziert, um 400 Hochrisikopatienten zu randomisieren. In der ICM-Gruppe wurden häufiger schwere arrhythmische Ereignisse (SArE) detektiert als in der Kontrollgruppe (schwarze Striche markieren die Zeitpunkte der Detektion). Im Beobachtungszeitraum traten insgesamt 51 schwere kardiale oder zerebrovaskuläre Ereignisse (MACCE) auf. SArE detektierten MACCE in der ICM-Gruppe mit einer dreifach erhöhten Sensitivität bei vergleichbarem positiv prädiktivem Wert (PPV). Modifiziert nach Bauer A et al.4
DC gilt als Maß für die „Schwingungsfähigkeit“ der Herzfrequenz im Beobachtungszeitraum und somit als globales Maß vornehmlich vagaler Aktivität auf der Ebene des Sinusknotens. PRD erfasst periodische Modulationen der Repolarisationsinstabilität im Niederfrequenzbereich, die mutmaßlich durch efferente sympathische Aktivität der thorakalen Ganglien beeinflusst werden.
Entsprechend etablierten Cut-off-Werte wurden Patienten mit DC ≤2,5ms oder PRD ≥5,75deg2 als Risikopatienten klassifiziert und in eine von zwei Gruppen randomisiert. In der experimentellen Gruppe wurde ein ICM (Medtronic LINQ) implantiert und an das telemetrische Nachsorgesystem (Carelink) angebunden. In der Kontrollgruppe erfolgte eine konventionelle Nachsorge in 6-monatigen Abständen.
Primärer Endpunkt war die Zeit bis zur Detektion folgender schwerer Arrhythmien: Vorhofflimmern ≥6min, AV-Block ≥IIb, schnelle nicht anhaltende ventrikuläre Tachykardien (VT; >187Schläge/min für mindestens 40 Schläge) und anhaltende VT oder Kammerflimmern.
Ergebnisse
Zwischen Mai 2016 und Juli 2020 wurden insgesamt 1305 Patienten mittels Biosignalanalyse einer Risikostratifizierung unterzogen, um insgesamt 400 Risikopatienten in eine ICM-Gruppe (n=201) und eine Kontrollgruppe (n=199) zu randomisieren. Das mediane Alter der Patienten betrug 64 Jahre (IQR 57–73), die LVEF 45% (40–48%). Die Patienten wurden über einen medianen Zeitraum von 21 Monaten nachbeobachtet.
Detektion schwerer Rhythmusereignisse
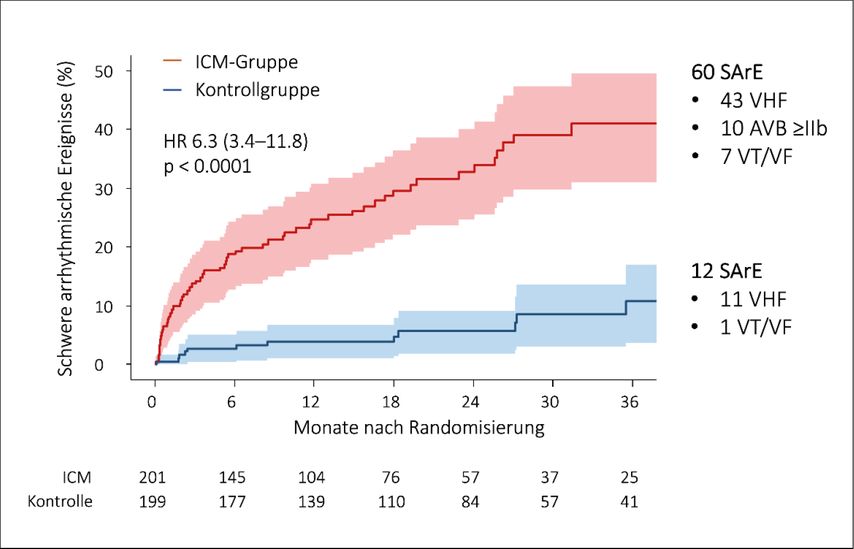
Die telemetrische Überwachung detektierte effektiv und frühzeitig schwere arrhythmische Ereignisse. So konnten in der ICM-Gruppe innerhalb des Beobachtungszeitraums bei 60 der 201 Patienten (30%) schwere Rhythmusereignisse erkannt werden, wohingegen dies bei der Kontrollgruppe nur bei 12 der 199 Patienten (6%) der Fall war, was einer Hazard-Ratio von 6,33 (IQR 3,40–11,78; p<0,0001; Abb. 2) entsprach. Eine verbesserte Erkennung zeigte sich für alle Arten vordefinierter Arrhythmien. In beiden Gruppen war die Mehrzahl der Arrhythmien asymptomatisch (68% bzw. 58%), d.h., die Arrhythmien wurden durch die Patienten selbst nicht erkannt.
Abb. 2:Ergebnisse der SMART-MI-Studie: kumulative Detektionsraten von schweren arrhythmischen Ereignissen (SArE) in der ICM-Gruppe (rot) und der Kontrollgruppe (blau). AVB: AV-Block; VHF: Vorhofflimmern; VT: ventrikuläre Tachykardie
Vorhersage schwerer klinischer Ereignisse
Detektierte schwere Rhythmusereignisse hatten in beiden Gruppen einen starken Vorhersagewert für zukünftige schwere kardiale und zerebrovaskuläre Ereignisse („major adverse cardiac and cerebrovascular events“ – MACCE). Der positiv prädiktive Wert war mit 60% in der ICM- bzw. 61% in der Kontrollgruppe vergleichbar. Allerdings war die Sensitivität mit 61% in der ICM-Gruppe gegenüber 20% in der Kontrollgruppe verdreifacht (p=0,007; Abb. 1).
Leitlinien-basierte Interventionen in beiden Gruppen
In der ICM-Gruppe wurden deutlich häufiger diagnostische und therapeutische Eingriffe vindiziert. So wurde häufiger ein ICD oder Schrittmacher implantiert (19 vs. 5), häufiger eine Katheterablation durchgeführt (10 vs. 3) und häufiger eine orale Antikoagulation initiiert. Die Indikationen für sämtliche Eingriffe wurden dabei durch die behandelnden Ärzte der jeweiligen Studienzentren gestellt. Die Indikationen für eine neue orale Antikoagulation basierten in den allermeisten Fällen auf der Erkennung von Vorhofflimmern, wobei die mediane Vorhofflimmerdauer hierbei 4,5 Stunden und der mediane CHA2DS2-VASc-Score 3 betrug.
Resümee
Die SMART-MI-Studie konnte erstmals einen klinischen Nutzen durch den Einsatz von ICM bei Hochrisikopatienten mit vorangegangenem Myokardinfarkt und einer linksventrikulären Auswurffraktion über 35% zeigen. Die telemedizinische Überwachung mittels ICM ermöglichte eine kontinuierliche digitale Risikobeurteilung durch frühzeitige Identifizierung von Patienten mit sehr hohem Risiko für Komplikationen. Diese Patienten bedürfen einer sorgfältigen Evaluation hinsichtlich etwaiger diagnostischer oder therapeutischer Maßnahmen sowie einer engmaschigen Überwachung. SMART-MI wurde als diagnostische Studie konzipiert. Dementsprechend lassen sich keine Aussagen über die prognostischen Auswirkungen der getroffenen Maßnahmen treffen. Der Einsatz von ICM zur kontinuierlichen digitalen Risikobewertung bei Hochrisikopatienten mit vorangegangenem Infarkt könnte daher eine neue Option der Prävention darstellen, wobei die optimalen Behandlungspfade noch zu definieren sind.
Literatur:
1 Priori SG, Blomstrom-Lundqvist C: European Society of Cardiology Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death summarized by co-chairs. Eur Heart J 2015; 36(41): 2757-9 2 Hamm W et al.: Risk prediction in post-infarction patients with moderately reduced left ventricular ejection fraction by combined assessment of the sympathetic and vagal cardiac autonomic nervous system. Int J Cardiol 2017; 249: 1-5 3 Bloch Thomsen PE et al.: Long-term recording of cardiac arrhythmias with an implantable cardiac monitor in patients with reduced ejection fraction after acute myocardial infarction: the Cardiac Arrhythmias and Risk Stratification After Acute Myocardial Infarction (CARISMA) study. Circulation 2010; 122(13): 1258-64 4 Bauer A et al.: Telemedical cardiac risk assessment by implantable cardiac monitors in patients after myocardial infarction with autonomic dysfunction (SMART-MI-DZHK9): a prospective investigator-initiated, randomised, multicentre, open-label, diagnostic trial. Lancet Digit Health 2022; 4(2): e105-e16 5 Bauer A et al.: Deceleration capacity of heart rate as a predictor of mortality after myocardial infarction: cohort study. Lancet 2006; 367(9523): 1674-81 6 Rizas KD et al.: Sympathetic activity-associated periodic repolarization dynamics predict mortality following myocardial infarction. J Clin Invest 2014; 124(4): 1770-80
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...