Echokardiografische Beurteilung der Linksventrikelhypertrophie
Autorin:
Dr. Christina Binder-Rodriguez
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
Eine linksventrikuläre Hypertrophie ist meist eine echokardiografische Blickdiagnose. Obwohl es meist nicht möglich ist, alleine anhand der Echokardiografie auf die Genese der Hypertrophie zu schließen, so gibt es doch einige Merkmale, die für die weitere Abklärung und Klinik von großer Bedeutung sind.
Keypoints
-
Sekundäre oder reaktive Hypertrophien sind häufig, während primäre Hypertrophien eher selten sind.
-
Die hypertrophe Kardiomyopathie ist eine genetische Erkrankung und der Begriff sollte, um Fehldiagnosen zu vermeiden, nur für diese Erkrankung verwendet werden.
-
Das Sportlerherz ist eine reaktive Hypertrophie abhängig von Ausmaß und Art des Sports, die sich im Laufe der Zeit nach Beendigung der Aktivität zurückbildet.
-
Bei einer Septumdicke >15mm sollte an eine andere Differenzialdiagose als das Sportlerherz gedacht werden.
-
Nach Möglichkeit sollte eine Speckle-Tracking-Analyse bei allen (unklaren) Hypertrophien angewendet werden.
-
V.a. bei dysproportionaler Hypertrophie sollte differenzialdiagnostisch an das Vorliegen mehrerer Ursachen der LVH gedacht werden (z.B. gleichzeitige Aortenstenose und Speichererkrankung).
Was bedeutet „myokardiale Hypertrophie“?
Bei Vorliegen einer Herzmuskelverdickung ist primär zu unterscheiden, ob eine tatsächliche Hypertrophie der Kardiomyozyten besteht oder ob eine Vermehrung des Extrazellulärraumes, z.B. durch Fibrose oder Ablagerungen, vorliegt (Abb.1). Häufig tragen auch beide der genannten Mechanismen zur Ausbildung der Hypertrophie bei. In diesem Zusammenhang ist anzumerken, dass der Begriff hypertrophe Kardiomyopathie (HCM) für eine genetische Erkrankung reserviert sein sollte, die aufgrund einer Mutation im Sarkomergen zu einer meist sehr ausgeprägten myozytären Hypertrophie führt. Eine kardiale Hypertrophie kann jedoch auch viele andere Ursachen haben.
Charakterisierung der Hypertrophie
Quantifizierung der Hypertrophie
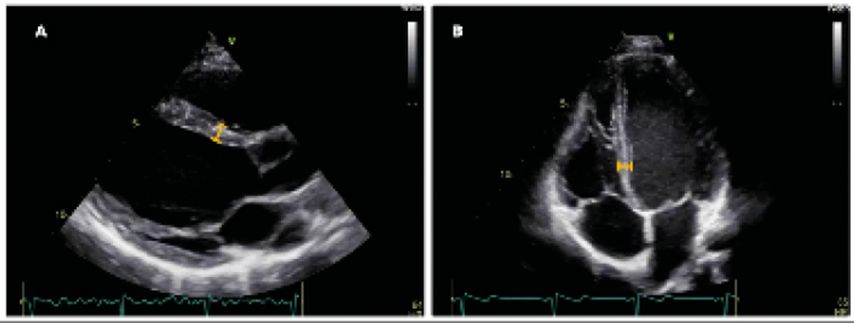
Es wird empfohlen, die Dicke des interventrikulären Septums am Ende der Diastole in einer parasternalen, langen Achse im unteren Drittel zu messen (Abb.2A).1 Alternativ kann die Wanddicke des linken Ventrikels auch in einem apikalen 4-Kammer-Blick an derselben Stelle gemessen werden (Abb.2B). Dabei sollte darauf geachtet werden, dass der linke Ventrikel optimal in der Längsachse angeschnitten wird, um eine Übermessung zu vermeiden. Die normale Septumdicke beträgt 6–9mm bei Frauen und 6–10mm bei Männern. Eine genauere Quantifizierung der Linksventrikelhypertrophie (LVH) kann anhand der Berechnung der relativen Wanddicke oder myokardialen Masse erfolgen.1 Diese beiden Parameter müssen anhand einer Formel berechnet werden und sind daher für die klinische Praxis oftmals nicht sinnvoll anwendbar. Sie bleiben meist für explizite Fragestellungen und akademische Zwecke reserviert.
Verteilung der Hypertrophie
Die Verteilung der LVH kann gleichmäßig oder lokalisiert sein. Als konzentrische Hypertrophie bezeichnet man eine gleichmäßige Wandverdickung in allen Myokardanteilen, die zu einer Verkleinerung des linksventrikulären Lumens führen. Exzentrische Hypertrophien sind ebenfalls gleichmäßig verteilt, jedoch ist das linksventrikuläre Volumen nicht bedeutsam reduziert. Bei der HCM besteht meist eine asymmetrische Hypertrophie, die in den septalen Wandabschnitten stärker ausgeprägt ist. Seltene Formen der HCM sind durch eine isolierte, im Apex auftretende Hypertrophie charakterisiert. Zur besseren Darstellung dieser Veränderungen kann eine echokardiografische Kontrastmitteluntersuchung hilfreich sein. Weiters sollte darauf geachtet werden, ob auch andere Strukturen als der linke Ventrikel von der Hypertrophie betroffen sind. Bei Speichererkrankungen z.B. findet man häufig auch eine Verdickung des rechten Ventrikels, der Herzklappen und des intraatrialen Septums. Eine isolierte rechtsventrikuläre Hypertrophie bei fehlender Linksherzerkrankung sollte an eine primäre pulmonale Hypertension (PH) denken lassen.
Folgen der Linksventrikelhypertrophie
Unabhängig von der Ursache der LVH kommt es mit Voranschreiten der Erkrankung zu einer Versteifung des Myokards und damit zu einer diastolischen Dysfunktion und einer Erhöhung der Füllungsdrücke im linken Herzen.2 Daher sollte bei diesen Patienten eine genaue Evaluierung der diastolischen Funktion erfolgen. Häufig kommt es in weiterer Folge zu einer Mitralinsuffizienz, zu einer Vergrößerung des linken Vorhofs und einer Fortleitung der erhöhten Druckverhältnisse in den Pulmonalkreislauf. Betroffene Patienten entwickeln daher oftmals eine sekundäre (postkapilläre) PH, die auch echokardiografisch diagnostiziert werden kann.3,4 Eine PH verursacht im Verlauf eine rechtsventrikuläre Druckbelastung und korreliert meist gut mit den klinischen Symptomen der Patienten.5–7 Daher ist auf diese Veränderungen im Rahmen der echokardiografischen Untersuchung unbedingt zu achten, um ein Gesamtbild der hämodynamischen Auswirkungen der LVH zu erhalten.
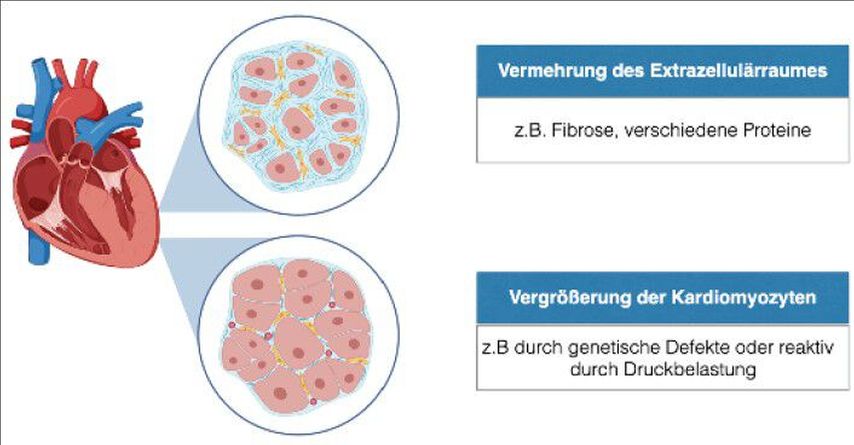
Abb. 1: Verdickung der Myokardwand durch Myozytenhypertrophie als auch bei Vermehrung des Extrazellulärraumes (erstellt mit Biorender von Christina Binder-Rodriguez)
Abb. 2: Bestimmung der interventrikulären Septumdicke in einer parasternalen langen Achse (2A) oder im apikalen 4-Kammer-Blick (2B). ©Echolabor MedUni Wien
Ursachen der Linksventrikelhypertrophie
Eine LVH kann eine primäre (häufig genetische) Erkrankung sein oder sekundär (reaktiv) als Folge einer anderen Pathologie auftreten. Im Allgemeinen sind sekundäre LV-Hypertrophien häufig, während primäre Formen seltener vorkommen. Die Unterscheidung dieser zwei Subgruppen ist für die weitere Therapie von entscheidender Bedeutung. Obwohl die Echokardiografie in vielen Fällen – mit Ausnahme der LVH durch Aortenstenose – keine eindeutige Diagnose stellen kann, ist sie dennoch essenziell, da sie ein ideales Screeningtool ist und auch für die Entscheidung über die weitere Abklärung entscheidend ist.
Primäre Hypertrophie
Hypertrophe Kardiomyopathie
Bei der HCM kommt es häufig zu einer ausgeprägten Hypertrophie. Klinisch präsentieren sich Patienten häufig mit Dyspnoe, Brustschmerzen oder Herzrhythmusstörungen, können jedoch in den frühen Stadien der Erkrankung auch asymptomatisch sein.8 Symptome sind sowohl durch die mit der LVH einhergehenden erhöhten intrakardialen Füllungsdrücken zu erklären als auch durch das verringerte Schlagvolumen, vor allem wenn aufgrund der Hypertrophie eine Obstruktion des linksventrikulären Ausflusstraktes vorliegt. Diese kommt meist dann zustande, wenn durch die Flussbeschleunigung das anteriore Mitralklappensegel während der Systole in den Ausflusstrakt gezogen wird und ihn damit obstruiert (SAM-Phänomen=„systolic anterior motion“). Eine solche Obstruktion kann echokardiografisch anhand von Dopplermessungen gut diagnostiziert und quantifiziert werden.
Weiters neigen Patienten mit HCM zu malignen Rhythmusstörungen. Leider erfolgt die Erstdiagnose dieser meist sehr jungen Patienten nicht selten im Rahmen eines plötzlichen Herztodes.9 Echokardiografische Parameter werden angewandt, um das Risiko für einen plötzlichen Herztod abzuschätzen und die Indikation für einen implantierten Defibrillator zu stellen.10
Speichererkrankungen
Hierzu gehören im Wesentlichen die Gruppe der kardialen Amyloidosen, der lysosomalen Speichererkrankungen (z.B. M.Fabry, M.Pompe) und der Glykogenspeichererkrankungen. Von diesen Krankheitsbildern ist in der Erwachsenenkardiologie die kardiale Amyloidose am häufigsten.11 Es kommt bei dieser Erkrankung zu einer Ablagerung von Amyloidfibrillen im Extrazellulärraum, die meist aus fehlgefalteten Leichtketten (AL-Amyloidose) oder Transthyretin (TTR-Amyloidose) bestehen. Dadurch kommt es zu einer restriktiven Kardiomyopathie, aber vor allem im Rahmen der AL-Amyloidose auch zu einer direkten Toxizität der Amyloidfibrillen gegen Kardiomyozyten und damit zu einer progressiven diastolischen und systolischen Dysfunktion, die sich klinisch mit Zeichen und mit Symptomen einer Herzinsuffizienz manifestiert.12
Sekundäre Hypertrophie
Jede Form der linksventrikulären Druckbelastung führt in weiterer Folge zu einer Hypertrophie. Die chronische un- oder insuffizient behandelte arterielle Hypertonie und die Aortenstenose sind in der Praxis die häufigsten Ursachen einer solchen „reaktiven“ Hypertrophie. Ab einer Septumdicke von 15mm sollte jedoch auch an alternative Diagnosen gedacht werden (z.B. Speichererkrankung, HCM). Andere häufige Ursachen für sekundäre Hypertrophien sind:
Herzinsuffizienz mit erhaltener Linksventrikelfunktion (HFpEF)
Diese Erkrankung betrifft oft ältere Frauen mit typischen Komorbiditäten eines metabolischen Syndroms (arterielle Hypertonie, Adipositas, Hyperlipidämie, Diabetes mellitus). Durch komplexe molekulare Mechanismen kommt es zu einer chronischen systemischen Inflammation, einer endothelialen Dysfunktion und dadurch sowohl zu einer Hypertrophie der Kardiomyozyten als auch zu einer vermehrten Ausbildung von Fibrose im Extrazellulärraum.13 In der Folge entwickeln Patienten eine diastolische, aber auch eine systolische, kardiale Dysfunktion. Echokardiografisch zeigt sich das typische Bild einer milden oder moderaten Linksventrikelhypertrophie sowie eine starke Vergrößerung der Vorhöfe und häufig bedeutsame Insuffizienzen der AV-Klappen.14 Auch diese Patienten entwickeln häufig eine sekundäre PH.15
Sportlerherz
Vor allem bei Leistungssportlern kann es durch die chronische und intensive Druckbelastung im Systemkreislauf bei hohen Blutdruckwerten im Rahmen der sportlichen Belastung zu einer myokardialen Hypertrophie kommen. Allerdings ist diese Form der LVH meist maximal mittelgradig ausgeprägt und die Septumdicke beträgt in den allermeisten Fällen weniger als 15mm. Die Ausprägung und Morphologie der Veränderungen ist dabei von der Art der Belastung abhängig. Während Kraftsportler eher eine konzentrische LVH entwickeln, kommt es durch Ausdauersport meist zu einer eher exzentrischen Hypertrophie, die im Allgemeinen auch etwas weniger ausgeprägt ist.16 Wichtig zu betonen ist, dass dies ein reversibler Prozess ist und dass sich die Hypertrophie im Verlauf vollständig zurückbildet, wenn kein Sport mehr betrieben wird. Diese Form der Hypertrophie führt auch nicht zu einer Erhöhung der Füllungsdrücke und auch nicht zu Beschwerden. Alternative Diagnosen sollten vermutet werden, wenn die Septumdicke 15mm übersteigt, wenn eine diastolische Dysfunktion vorliegt oder wenn Patienten sich mit Beschwerden präsentieren.
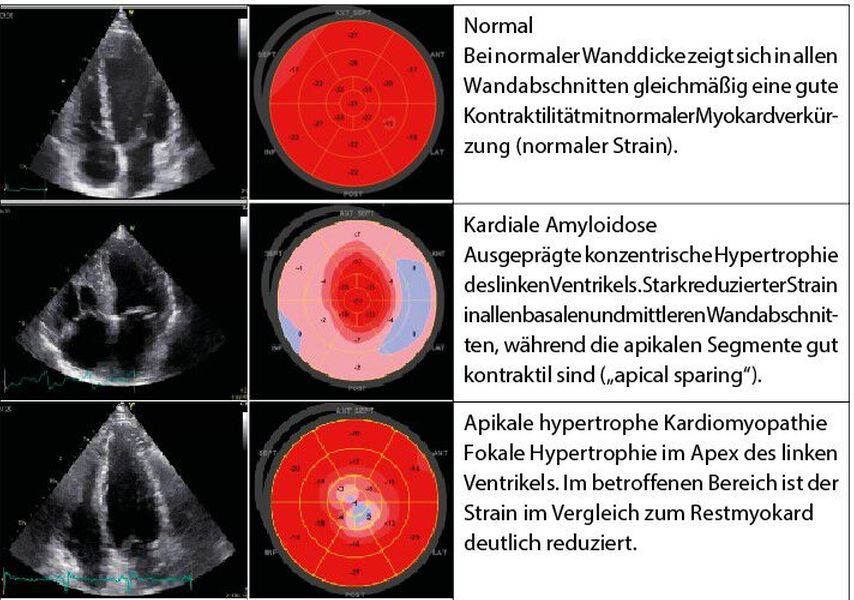
„Speckle tracking“ und Strain-Analyse
Anhand der Analyse einzelner Graupunkte im Ultraschall kann mittels „speckle tracking imaging“ bei guten Untersuchungsbedingungen mit hoher Sensitivität die Kontraktilität einzelner Myokardsegmente quantifiziert werden. Dies ist einerseits zur Diagnostik subklinischer und subtiler kardialer Funktionsstörungen nützlich, andererseits kann anhand dieser Methode auch die Differenzialdiagnostik von Kardiomyopathien – vor allem jener, die mit einer LVH einhergehen – erleichtert werden.17 Da meist die Kontraktilität in den hypertrophierten Wandabschnitten schlechter ist, kommt es bei den oben erwähnten Erkrankungen zur Ausbildung spezieller Strain-Muster (Tab.1). Wenn verfügbar, sollte diese Methode bei allen Patienten mit (unklarer) Hypertrophie zum Einsatz kommen. Die Echokardiografie ist eine ideale Untersuchungsmethode für die Erstdiagnostik und die Verlaufskontrolle bei Patienten mit linksventrikulärer Hypertrophie. Neue Spezialmethoden zur Bildanalyse können auch in der Differenzialdiagnostik eine bedeutende Rolle spielen.
Literatur:
1 Lang RM et al.: Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28(1): 1-39.e14 2 Gori M et al.: Haemodynamics of heart failure with preserved ejection fraction: a clinical perspective. Card Fail Rev 2016; 2(2): 102-5 3 Slivnick J et al.: Prevalence and haemodynamic profiles of pulmonary hypertension in cardiac amyloidosis. Open Heart 2022; 9(1): e001808 4 Mitra A et al.: Significance of pulmonary hypertension in hypertrophic cardiomyopathy. Curr Probl Cardiol 2020; 45(6): 100398 5 Mohammed SF et al.: Right ventricular function in heart failure with preserved ejection fraction. Circulation 2014; 130(25): 2310-20 6 Bodez D et al.: Prognostic value of right ventricular systolic function in cardiac amyloidosis. Amyloid 2016; 23(3): 158-67 7 Mahmod M et al.: Right ventricular function declines prior to left ventricular ejection fraction in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2022; 24(1):36 8 Díez-López C, Salazar-Mendiguchía J: Clinical presentations of hypertrophic cardiomyopathy and implications for therapy. Glob Cardiol Sci Pract 2018; 2018(3): 19 9 McKenna WJ et al.: Arrhythmia in hypertrophic cardiomyopathy. I: Influence on prognosis. Br Heart J 1981; 46(2): 168 10 Elliott PM et al.: 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35(39): 2733-79 11 Ruiz-Guerrero L, Barriales-Villa R: Storage diseases with hypertrophic cardiomyopathy phenotype. Glob Cardiol Sci Pract 2018; 2018(3): 28 12 Bonderman D et al.: Diagnosis and treatment of cardiac amyloidosis: an interdisciplinary consensus statement. Wien Klin Wochenschr 2020; 132(23-24): 742-61 13 Borlaug BA: The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol 2014; 11(9): 507-15 14 Shah AM et al.: Echocardiographic features of patients with heart failure and preserved left ventricular ejection fraction. J Am Coll Cardiol 2019; 74(23): 2858-73 15 Hoeper MM et al.: Pulmonary hypertension in heart failure with preserved ejection fraction: a plea for proper phenotyping and further research†. Eur Heart J 2016; 38(38): 2869-73 16 Paterick TE et al.: Echocardiography: profiling of the athlete’s heart. J Am Soc Echocardiogr 2014; 27(9): 940-8 17 Butz T et al.: Two-dimensional strain analysis of the global and regional myocardial function for the differentiation of pathologic and physiologic left ventricular hypertrophy: a study in athletes and in patients with hypertrophic cardiomyopathy. Int J Cardiovasc Imaging 2011; 27(1): 91-100
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...