Chronisch thromboembolische pulmonale Hypertonie: moderne Therapiekonzepte
Autor:innen:
Dr. Miriam S. D. Adameit
Priv.-Doz. Dr. Stefan Guth
Priv.-Doz. Dr. Christoph B. Wiedenroth
Abteilung für Thoraxchirurgie
Kerckhoff-Klinik
Bad Nauheim
Korrespondierende Autorin:
Dr. Miriam S. D. Adameit
E-Mail: m.adameit@kerckhoff-klinik.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die chronisch thromboembolische pulmonale Hypertonie (CTEPH) ist eine wichtige Komplikation der akuten oder rezidivierenden Lungenembolie, die durch eine chronische Obstruktion der pulmonalen Strombahn zu einer Rechtsherzbelastung und nachfolgend zum Rechtsherzversagen führen kann. Mittlerweile konnte die Prognose der Patienten durch drei spezifische Therapiemodalitäten signifikant verbessert werden: die pulmonale Endarteriektomie (PEA), die medikamentöse Therapie sowie die pulmonale Ballonangioplastie (BPA).
Keypoints
-
Bei symptomatischen Patienten nach überstandener Lungenembolie an CTEPH denken.
-
Die erweiterte Diagnostik und Behandlung erfolgt im Expertenzentrum.
-
Patienten mit CTEPH sollen langfristig durch einen PH-Spezialisten betreut werden.
Die Inzidenz der chronisch thromboembolischen pulmonalen Hypertonie (CTEPH) nach überstandener Lungenembolie wird zwischen 0,1 und 11,8% angegeben.1 Durch unzureichende Thrombolyse, begünstigt durch Inflammation, Störungen der Fibrinolyse oder Infektion, kommt es zum fibrotischen Umbau des thrombotischen Materials und damit zur chronischen Obstruktion der Lungenarterien. Häufig tritt eine sekundäre Mikrovaskulopathie auf, die sich durch Hyperperfusion der nicht obstruierten Lungengefäße und die oben genannten Faktoren entwickelt. Die daraus resultierende zunehmende Nachlast des rechten Ventrikels kann die Erkrankung aggravieren, bis hin zum Rechtsherzversagen und Tod des Patienten.
Im Anfangsstadium äußert sich die Erkrankung meist unspezifisch, was die Diagnosestellung erschwert und häufig verzögert.2 Patienten, die nach einer Lungenembolie unter therapeutischer Antikoagulation symptomatisch bleiben, sollten daher weiterer Diagnostik zugeführt werden. Klassischerweise klagen die Patienten über im Verlauf zunehmende Luftnot bei Belastung.
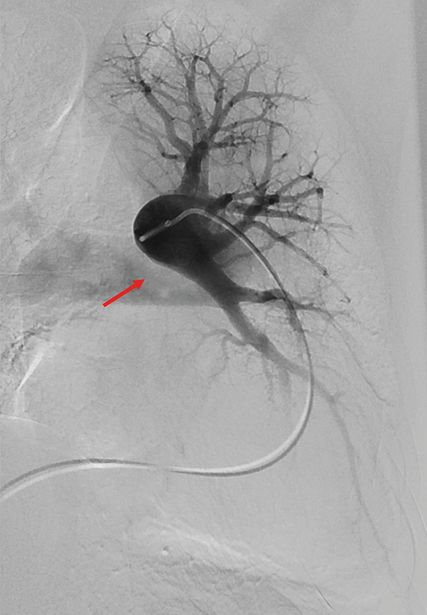
Abb. 1: Selektive Pulmonalisangiografie der linken Pulmonalarterie in 30°-Projektion: Der Oberlappen ist perfundiert, während der Unterlappen vollständig verschlossen ist (pfeilmarkiert)
Bei Verdacht auf eine CTEPH sollte entsprechend dem Diagnostikalgorithmus der ESC/ERS-Leitlinie eine Ventilations-Perfusionsszintigrafie durchgeführt werden.1 Ergibt sich hier der Verdacht auf eine Perfusionsstörung bei erhaltener Ventilation, ein sogenannter Mismatch-Befund, soll der Patient in einem Zentrum für CTEPH zur weiterführenden Diagnostik vorgestellt werden. Ergänzend werden eine Rechtsherzkatheter-Untersuchung sowie bildgebende Untersuchungen wie eine CT-Angiografie und/oder eine Pulmonalisangiografie (Abb. 1) durchgeführt.
In regelmäßigen interdisziplinären Konferenzen, an der ein auf die PEA (pulmonale Endarteriektomie) spezialisierter Chirurg, ein BPA(pulmonale Ballonangio-plastie)-Interventionalist, ein Radiologe und ein Spezialist für pulmonale Hypertonie (PH) teilnehmen, wird dann eine Therapieempfehlung ausgesprochen.
Mittlerweile stehen drei Therapieansätze zur Verfügung: die pulmonale Endarteriektomie (PEA), die gezielte medikamentöse Therapie und die pulmonale Ballonangioplastie (BPA). Welches Therapiekonzept für den Patienten infrage kommt, hängt maßgeblich von der Lokalisation der pulmonalarteriellen Veränderungen ab. Aber auch Komorbiditäten und das Alter des Patienten haben Einfluss auf die Therapieentscheidung. Zwei Dritteln der Patienten kann eine operative Therapie empfohlen werden.3,4 Für inoperable Patienten steht zum einen die medikamentöse Therapie und ggf., bei entsprechenden Zielgebieten, die BPA zur Verfügung.
Pulmonale Endarteriektomie (PEA)
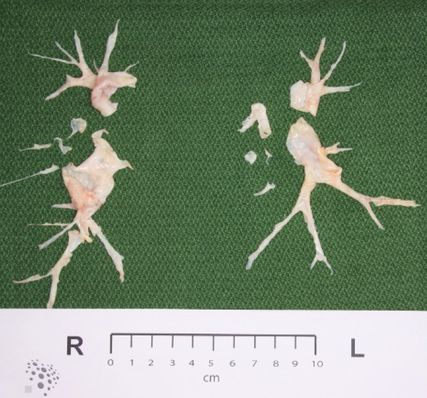
Abb. 2: Endarteriektomie-Präparat: Beidseits finden sich bindegewebige Zylinder bis auf Subsegmentniveau
Die PEA ist die Therapie der Wahl, insofern sich der Patient für diesen komplexen Eingriff eignet: Unter Einsatz der Herz-Lungen-Maschine wird im tiefen hypothermen Kreislaufstillstand das vernarbte Gewebe vollständig aus den Lungenarterien entfernt (Abb. 2). Hierdurch kann eine deutliche Verbesserung bis hin zur Normalisierung der pulmonalen Hämodynamik erreicht werden. In erfahrenen Zentren liegt die Mortalität bei etwa 2–3%.5 Die Langzeitergebnisse sind exzellent.6
Medikamentöse Therapie
Der Ansatzpunkt der medikamentösen Therapie ist die sekundäre Mikrovaskulopathie. Hier konnte Riociguat, ein Stimulator der löslichen Guanylatzyklase, als erste Substanz nicht nur eine Besserung der pulmonalen Hämodynamik, sondern auch eine Verbesserung der Belastbarkeit der Patienten in der 6-Minuten-Gehstrecke erreichen.7 Die Substanz ist für Patienten mit inoperabler CTEPH oder residueller/rezidivierender PH nach PEA zugelassen und empfohlen.1
Für Patienten mit inoperabler CTEPH der WHO-Funktionsklassen III und IV sowie auch bei PH nach PEA konnte Treprostinil, ein Prostazyklinanalogon, mittlerweile ebenfalls die Zulassung erhalten.8 Macitentan, ein Endothelin-Rezeptor-Antagonist, wird aktuell in dieser Indikation untersucht (NCT04271475).
Etabliert hat sich außerdem eine Kombinationstherapie mit PAH-Medikamenten bei Patienten mit schwerer PH. Ein Off-Label-Use kann hier erwogen werden.1
Pulmonale Ballonangioplastie (BPA)
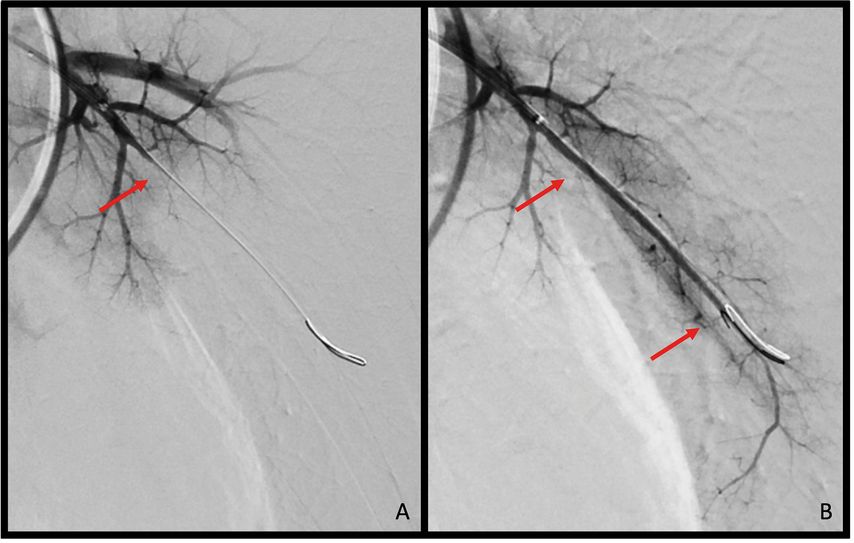
Bei der BPA handelt es sich um ein interventionelles Verfahren, das subsegmental gelegene Stenosen und Verschlüsse der Lungenarterien adressiert. Hierbei wird über einen venösen Zugang eine Schleuse eingebracht, über die mittels spezieller Führungskatheter und eines dünnen Drahts die Zielsegmentarterie erreicht wird. Anschließend wird über den liegenden Draht ein Ballonkatheter eingebracht. Obstruktionen werden so gezielt sondiert und mittels Ballonkatheter aufgedehnt (Abb. 3). Trotz der möglichen, zum Teil schweren Komplikationen, wie Gefäßverletzungen, pulmonaler Hämorrhagien oder Reperfusionsschäden, handelt es sich mittlerweile um ein etabliertes Verfahren.9,10
Abb. 3: Darstellung einer pulmonalen Ballonangioplastie: A) Subsegment 5 links mit Komplettverschluss (pfeilmarkiert), B) nach Intervention deutlich gebesserte Parenchymperfusion (pfeilmarkiert)
In der aktuellen europäischen Leitlinie wird die BPA aufgrund der gestiegenen Evidenz in den letzten Jahren bei inoperabler CTEPH empfohlen.1 Mit zunehmender Erfahrung konnte eine Senkung der Komplikationsraten beobachtet werden. Des Weiteren zeigte sich eine Besserung der Behandlungsergebnisse. Ähnlich zur PEA wird daher die Behandlung in einem Expertenzentrum empfohlen.11
Multimodale Therapiekonzepte
Kombinationen aller drei Therapiemodalitäten sind zunehmende Praxis, auch wenn derzeit keine eindeutigen Empfehlungen vorliegen.12 Bei Patienten mit inoperabler CTEPH und mit PH nach PEA sollen nach Empfehlung der ESC/ERS-Leitlinie multimodale Therapiekonzepte erwogen werden.1
Durch die medikamentöse Vorbehandlung mit Riociguat vor geplanter interventioneller Behandlung konnte eine deutliche Senkung der Komplikationsrate erzielt werden. Des Weiteren zeigte sich, dass die Kombination beider Therapieansätze besonders effektiv ist.13,14
Bei residueller/rezidivierender PH nach pulmonaler Endarteriektomie sollte eine gezielte medikamentöse Therapie angeschlossen werden. Liegen in der Bildgebung geeignete Zielgebiete vor, kann im Verlauf eine interventionelle Therapie angeboten werden.
Eine medikamentöse Behandlung vor geplanter PEA stellt einen Off-Label-Use dar und wird kontrovers diskutiert: Einer derzeit nicht durch Studien belegten Risikoreduktion steht die Sorge einer Verzögerung der chirurgischen Therapie gegenüber.15
Eine Kombination der chirurgischen und interventionellen Therapie in einem simultanen Eingriff kann in besonderen Fällen (z.B. Patienten mit schwerer PH und zentralen sowie distalen Gefäßveränderungen in der Bildgebung) sinnvoll sein.16
CTEPH-Zentrum
Aufgrund der Komplexität und der zunehmenden Anwendung multimodaler Therapiekonzepte sollte die Behandlung von CTEPH-Patienten in Expertenzentren erfolgen. Ein CTEPH-Zentrum soll ein Behandlungsvolumen von mindestens 50 PEA/Jahr und >100 BPA/Jahr durchführen, da dies mit niedrigen perioperativen und periinterventionellen Komplikations- und Mortalitätsraten sowie einer besseren Prognose korreliert.11
Nach erfolgter chirurgischer und/oder interventioneller Therapie soll nach 3–6 Monaten eine invasive Verlaufskontrolle mittels Rechtsherzkatheter-Untersuchung erfolgen. Grundsätzlich ist eine langfristige Betreuung der Patienten durch einen PH-Spezialisten mit jährlichen, nichtinvasiven Kontrollen empfohlen.1,17
Literatur:
1 Humbert M et al.: 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J 2022. doi: 10.1183/13993003.00879-2022 2 Mayer E et al.: Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: Results from an international prospective registry. J Thorac Cardiovasc Surg 2011; 141(3): 702-10 3 Guth S et al.: Current strategies for managing chronic thromboembolic pulmonary hypertension: results of the worldwide prospective CTEPH Registry; ERJ Open Res 2021; 7(3): 850-2020 4 Pepke-Zaba J et al.: Chronic thromboembolic pulmonary hypertension (CTEPH): Results from an international prospective registry. Circulation 2011; 124(18): 1973-81 5 Lankeit M et al.: Pulmonary endarterectomy in chronic thromboembolic pulmonary hypertension. J Heart Lung Transplant 2018; 37(2): 250-8 6 Quadery SR et al.: The impact of patient choice on survival in chronic thromboembolic pulmonary hypertension. Eur Respir J 2018; 52(3): 1800589 7 Ghofrani HA et al.: Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med 2013; 369: 319-29, 2013 8 Sadushi-Kolici R et al.: Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial. Lancet Respir Med 2019; 7(3): 239-48 9 Olsson KM et al.: Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic pulmonary hypertension: the initial German experience. Eur Respir J 2017; 49(6): 1602409 10 Wiedenroth CB et al.: Complications of balloon pulmonary angioplasty for inoperable chronic thromboembolic pulmonary hypertension: Impact on the outcome. J Heart Lung Transplant 2022;41(8): 1086-94 11 Brenot P et al.: French experience of balloon pulmonary angioplasty for chronic thromboembolic pulmonary hypertension. Eur Respir J 2019; 53(5): 1802095 12 Nick DPJ et al.: Chronic thromboembolic pulmonary hypertension. Eur Respir J 2019; 53(1): 180191513 Wiedenroth CB et al.: Sequential treatment with riociguat and balloon pulmonary angioplasty for patients with inoperable chronic thromboembolic pulmonary hypertension. Pulm Circ 2018; 8(3): 2045894018783996 14 Jaïs X et al.: Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): a multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study. Lancet Respir Med 2022; 10(10):961-71 15 Delcroix M et al.: Long-term outcome of patients with chronic thromboembolic pulmonary hypertension: Results from an international prospective registry. Circulation 2016; 133(9): 859-71 16 Wiedenroth CB et al.: Combined pulmonary endarterectomy and balloon pulmonary angioplasty in patients with chronic thromboembolic pulmonary hypertension. J Heart Lung Transplant 2015; 35(59): 591-6 17 Cannon E et al.: Dynamic risk stratification of patient long-term outcome after pulmonary endarterectomy: Results from the United Kingdom national cohort. Circulation 2016; 133: 1761-71
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...