Antithrombotische Therapie nach PCI bei Vorhofflimmern
Autoren:
Dr. med. Konrad Andreas Szawan
Prof. Dr. med. Oliver Gaemperli
Herzklinik Hirslanden
Zürich
Korrespondierender Autor:
Prof. Dr. med. Oliver Gaemperli
Herzklinik Hirslanden
Zürich
E-Mail: oliver.gaemperli@hirslanden.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei Patient:innen mit Vorhofflimmern und einem CHA2DS2-VA-Score ≥2 ist eine orale Antikoagulation zur Prävention kardioembolischer Ereignisse indiziert. Im Gegensatz dazu benötigen Patient:innen nach einem akuten Koronarsyndrom oder einer perkutanen Koronarintervention eine duale Thrombozytenaggregationshemmung zur Vermeidung von Stentthrombosen und Reduktion koronarischämischer Ereignisse. Eine Kombination beider Therapieregimes im Sinne einer Tripeltherapie (d.h. orale Antikoagulation und doppelte Plättchenhemmung kombiniert) erhöht jedoch signifikant das Blutungsrisiko und stellt damit behandelnde Ärzt:innen vor ein therapeutisches Dilemma: Es gilt, gleichzeitig koronarischämische sowie kardioembolische Ereignisse zu verhindern, ohne jedoch schwerwiegende Blutungskomplikationen in Kauf zu nehmen.
Keypoints
-
Bei Patient:innen mit Vorhofflimmern nach perkutaner Koronarintervention oder akutem Koronarsyndrom (PCI/ACS) erhöht eine dreifache antithrombotische Therapie (TAT: Aspirin + P2Y12-Rezeptor-Antagonist + OAK) das Blutungsrisiko erheblich.
-
Gemäss aktuellen Studien reduziert eine doppelte antithrombotische Therapie (DAT: OAK + P2Y12-Rezeptor-Antagonist) im Vergleich zu einer TAT Blutungen deutlich, ohne jedoch signifikant mehr ischämische Ereignisse aufzuweisen.
-
Die modernen direkten Antikoagulanzien (DOAK) sind gegenüber den traditionellen Vitamin-K-Antagonisten in den o.g. DAT- oder TAT-Regimen zu bevorzugen.
-
Aspirin kann in den meisten Fällen frühzeitig nach einer PCI abgesetzt werden (<7 Tage, häufig bereits nach Spitalentlassung).
-
Ab >1 Jahr nach PCI/ACS reicht in der Regel eine OAK-Monotherapie aus.
Ungefähr jeder/jede zehnte Patient:in, der/die ein akutes Koronarsyndrom (ACS) erleidet oder sich einer elektiven perkutanen Koronarintervention (PCI) unterzieht, hat gleichzeitig auch eine Indikation für eine orale Antikoagulation (OAK). In den allermeisten Fällen betrifft dies Patient:innen mit Vorhofflimmern (VHF) und einem erhöhten thromboembolischen Risiko (CHA2DS2-VA-Score ≥2). Dieses klinische Szenario stellt die behandelnden Ärzt:innen immer wieder vor ein therapeutisches Dilemma: Nach PCI (und nach ACS) hat sich die duale Plättchenhemmung (DAPT) (bestehend aus Acetylsalicylsäure [ASS] und einem P2Y12-Rezeptor-Antagonisten [P2Y12-Inh.]) gegenüber einer OAK in puncto Effektivität (weniger Stentthrombosen und koronarischämische Ereignisse) und Sicherheit (weniger Blutungskomplikationen) als klar überlegen erwiesen.1 Anders ist es beim VHF: Hier lassen sich kardioembolische Ereignisse deutlich effektiver mit einer OAK als mit einer DAPT reduzieren.2 Eine Kombination von DAPT und OAK im Sinne einer dreifachen («triple») antithrombotischen Therapie (TAT) führt allerdings zu einer exzessiven Erhöhung des Blutungsrisikos (schwerwiegende Blutungen: ca. 10%/Jahr, bei Hochrisikopatient:innen sogar bis zu 20%/Jahr).3
Lange Zeit galten ischämische Komplikationen, insbesondere Stentthrombosen, als die gefürchtetsten Komplikationen nach einem Herzinfarkt oder einer PCI, während Blutungskomplikationen von Kardiolog:innen eher vernachlässigt wurden. Eine klinisch schwerwiegende Blutung (engl. «major bleeding» bedeutet fatale Blutung, kritische Organblutung oder Blutung mit relevantem Hb-Abfall und Ec-Transfusion) hat allerdings die gleiche Mortalität wie ein postprozeduraler Myokardinfarkt (ca. 10% im ersten Jahr).4 Die Überalterung unserer Gesellschaft und das steigende Alter von PCI-Patient:innen tragen ebenfalls zur Zunahme von Blutungskomplikationen bei. Die Auswahl einer für dieses Patientenkollektiv zielführenden antithrombotischen Therapie stellt im Hinblick auf Effektivität (Prävention kardioembolischer sowie koronarischämischer Ereignisse) und Sicherheit (Vermeidung schwerwiegender Blutungskomplikationen) eine klinische Herausforderung dar und war in jüngster Zeit Gegenstand diverser randomisierter Studien. Diese bilden die Grundlage der aktuellen evidenzbasierten Empfehlungen und werden in der Folge genauer diskutiert.
Weniger ist mehr – die WOEST-Studie
Als die WOEST-Studie konzipiert wurde, war die gängige Praxis, nach PCI (oder ACS) bei VHF-Patient:innen häufig noch eine TAT für mindestens sechs Monate durchzuführen. Mit der Einführung modernerer Generationen an biokompatiblen «Drug-eluting Stents» (DES) wurden solch lange TAT-Behandlungszeiträume infrage gestellt. Die WOEST-Studie randomisierte 573 Patient:innen mit einer OAK-Indikation (70% davon hatten VHF) nach PCI (27% mit ACS) zu TAT (Vitamin-K-Antagonist [VKA] + ASS + Clopidogrel) versus doppelte antithrombotische Therapie (DAT) (VKA + Clopidogrel) für die Dauer von 12 Monaten.5 DAT führte nicht nur zu einer Reduktion von Blutungskomplikationen (19,4% vs. 44,4%; p<0,001), sondern zeigte auch kein Signal für ein erhöhtes Risiko für koronarischämische oder thromboembolische Ereignisse. Effektiv zeigte sich sogar eine signifikant niedrigere Mortalität mit der DAT im Vergleich zur TAT, auch wenn angemerkt werden muss, dass die Studie für diesen Endpunkt unzureichend gepowert war. Trotzdem war die WOEST-Studie die erste (wenn auch kleine) randomisierte Studie, die aufzeigte, dass es relativ sicher ist, bei VHF-Patient:innen Aspirin bereits unmittelbar nach der PCI zu sistieren, ohne dadurch ein erhöhtes Risiko für koronarischämische Ereignisse in Kauf nehmen zu müssen.
Antithrombotische Therapie in der DOAK-Ära
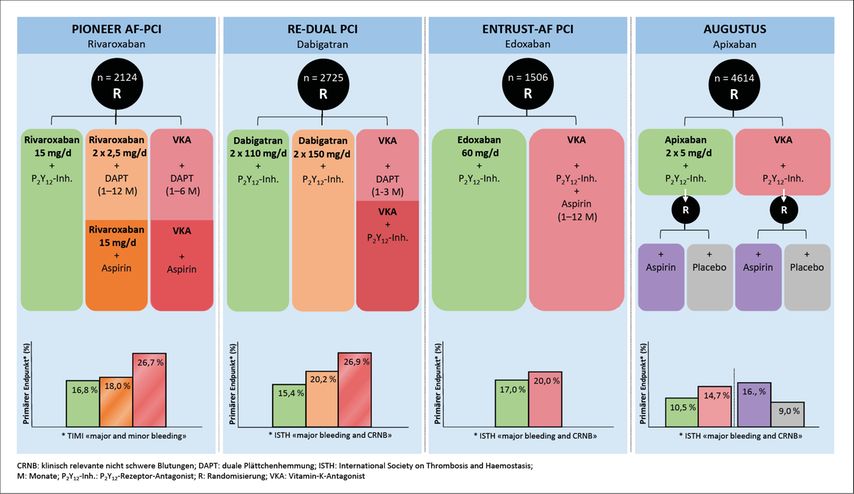
Parallel zu WOEST fand eine weitere wichtige Entwicklung statt, nämlich die Ablösung der traditionellen VKA durch die modernen (direkten) oralen Antikoagulanzien (DOAK) zur Schlaganfallprophylaxe bei nichtvalvulärem VHF (nvVHF). Mit ihren signifikant niedrigeren Raten an fatalen, intrakraniellen und anderweitig schwerwiegenden Blutungen bieten DOAK gegenüber VKA auch Vorteile für die Kombination mit Thrombozytenaggregationshemmern. Die vier in der Schweiz erhältlichen DOAK (der direkte Thrombininhibitor Dabigatran sowie die drei oralen Faktor-Xa-Hemmer Rivaroxaban, Apixaban und Edoxaban) waren entsprechend auch Gegenstand von vier randomisierten Studien, die unterschiedliche antithrombotische Regimes nach PCI bei Patient:innen mit nvVHF untersucht haben (Abb.1).
Abb. 1: Vorhofflimmern und perkutane Koronarintervention/akutes Koronarsyndrom: Studiendesigns und primäre Endpunkte randomisierter Studien
Die PIONEER-AF-PCI-Studie untersuchte 2124 Patient:innen mit nvVHF nach PCI (ca. 50% mit ACS) und verglich drei Strategien:6 einen DAT-Arm (Rivaroxaban 15mg/d + P2Y12-Inh. [in 95% Clopidogrel]), einen «Low-dose»-TAT-Arm (DAPT mit ASS und P2Y12-Inh. + Rivaroxaban 2,5mg 2x/d) und einen VKA-basierten TAT-Arm (DAPT + VKA). Die Dauer der TAT in den zwei letzteren Gruppen variierte je nach Stent-Typ und klinischer Situation, betrug jedoch bei 49% der Patient:innen 12 Monate. Nach einer Beobachtungsperiode von einem Jahr trat der primäre Endpunkt (klinisch signifikante Blutungen [«major and minor bleeding» gemäss TIMI]) signifikant seltener in den zwei Rivaroxaban-Gruppen auf (16,8% bzw. 18,0%) verglichen mit der VKA-basierten TAT-Gruppe (26,7%). Ischämische Ereignisse traten in allen Gruppen vergleichbar häufig auf.
In der RE-DUAL-PCI-Studie erhielten 2725 Patient:innen mit nvVHF nach PCI Dabigatran (110mg oder 150mg 2x/d) + P2Y12-Inh. (90% Clopidogrel, 10% Ticagrelor) oder eine VKA-basierte TAT.7 Die Dauer der TAT (ASS + P2Y12-Inh. + VKA) betrug einen (nach «Bare Metal Stent») bis drei Monate (nach DES). Nach einem mittleren Follow-up von circa 14 Monaten trat der primäre Endpunkt (schwere Blutung nach ISTH-Kriterien oder klinisch relevante nicht schwere Blutungen) unter Dabigatran signifikant seltener auf (15,4% und 20,2% vs. 26,9%; p<0,001). Die Wirksamkeit hinsichtlich ischämischer Ereignisse (Schlaganfall, Myokardinfarkt oder Stentthrombose) war zwischen den Gruppen vergleichbar.
Die ENTRUST-AF-PCI-Studie verglich Edoxaban 60mg/d + P2Y12-Inh. (93% Clopidogrel) mit einer klassischen VKA-basierten TAT bei 1506 Patient:innen mit nvVHF und PCI (52% davon mit ACS).8 Der primäre Endpunkt (schwere Blutung nach ISTH-Kriterien oder klinisch relevante nicht schwere Blutungen) trat in der DAT-Gruppe seltener auf als in der TAT-Gruppe (17,0% vs. 20,0%), wobei das Signifikanzniveau für statistische Überlegenheit («superiority») knapp verpasst wurde (p=0,115). Wie bei den zuvor genannten Studien gab es auch in ENTRUST-AF PCI keinen signifikanten Unterschied im kombinierten ischämischen Endpunkt (kardiovaskulärer Tod, Hirnschlag, systemische Embolie, Myokardinfarkt, Stentthrombose).
Die AUGUSTUS-Studie war durch ihr 2x2-faktorielles Design die methodologisch stärkste Studie, um zwei wichtige klinische Fragen unabhängig voneinander zu beantworten: 1) Über-/Unterlegenheit von DAT- gegenüber TAT-Regimes und 2) Über-/Unterlegenheit von DOAK-basierten gegenüber VKA-basierten Regimes bezüglich Blutungsendpunkten. In AUGUSTUS wurden 4614 Patient:innen mit nvVHF und PCI und/oder ACS (24% hatten rein medikamentös behandeltes ACS) in einem 2×2-faktoriellen Design randomisiert.9 Alle Patient:innen wurden mit einem P2Y12-Inh. (in 93% Clopidogrel) behandelt. Im ersten Stratum wurde Apixaban 5mg 2x/d mit einem VKA verglichen, im zweiten Stratum wurde ASS versus Placebo randomisiert. Nach sechs Monaten kam es unter Apixaban im Vergleich zu VKA zu einer signifikanten 31%igen Reduktion des primären Endpunktes (schwere Blutungen nach ISTH-Kriterien und klinisch relevante nicht schwere Blutungen) (10,5% vs. 14,7%), und zwar unabhängig davon, ob zusätzlich ASS oder Placebo verabreicht wurde. Im zweiten Stratum führte ASS erwartungsgemäss im Vergleich zu Placebo zu deutlich mehr Blutungen (16,1% vs. 9,0%). Wiederum zeigte sich kein Zusatznutzen der intensiveren Regimes (VKA vs. Apixaban oder ASS vs. Placebo) hinsichtlich ischämischer Ereignisse.
Einige wichtige methodologische Aspekte der vier oben diskutierten Studien sollten hervorgehoben werden: Jede Studie war aufgrund ihrer Grösse lediglich für ihren kombinierten Blutungsendpunkt gepowert, nicht für die (seltener auftretenden) ischämischen Endpunkte. Eine Metaanalyse der vier Studien zeigte allerdings einen Trend zu einer höheren Myokardinfarktrate sowie signifikant mehr Stentthrombosen mit den getesteten DAT-Regimen im Vergleich zu den TAT-Regimen. Eine Interpretation des Endpunktes Stentthrombose ist allerdings aufgrund unterschiedlicher Definitionen in den vier Studien schwierig.10 Trotzdem geben diese Resultate Anlass dazu, bei Patient:innen mit besonders hohem ischämischem Risiko eine TAT über >7 Tage in Betracht zu ziehen. Die in den vier Studien für DAT- bzw. TAT-Regimes verwendeten DOAK-Dosierungen entsprechen den jeweils in der Schweiz für die Schlaganfallprophylaxe zugelassenen Dosierungen (Tab.1). Eine Ausnahme ist die PIONEER-AF-PCI-Studie, in welcher eine reduzierte Rivaroxabandosierung von 15mg/d (10mg/d bei eingeschränkter Nierenfunktion) verwendet wurde.6 Aus diesem Grunde wurden in dieser Studie auch Patient:innen mit Schlaganfall in der Vorgeschichte ausgeschlossen.
Wie früh nach der PCI kann ASS gestoppt werden?
Von den beiden Thrombozytenaggregationshemmern wurde in allen bisher getesteten DAT-Regimen das ASS (und nicht der P2Y12-Inh.) weggelassen oder frühzeitig sistiert (Tab.1). Dies hat historische Gründe, da die ersten Thienopyridin-Studien in ihren Kontrollarmen (bestehend aus VKA + ASS) verhältnismässig hohe Stentthromboseraten aufwiesen.1 In den vier zuvor diskutierten DOAK-Studien wurden Patient:innen im Durchschnitt ein (PIONEER-AF PCI, RE-DUAL-PCI) bis sechs Tage (AUGUSTUS) nach PCI randomisiert. Folglich ist es in den meisten Fällen sicher, ASS bei Entlassung aus dem Spital nach PCI oder ACS zu sistieren.
Eine Post-hoc-Landmark-Analyse des ASS-Stratums von AUGUSTUS (d.h. der Studienarm, in welchem Patient:innen zu ASS vs. Placebo randomisiert wurden) zeigte, dass innerhalb des ersten Monats nach Randomisierung die Zunahme an Blutungskomplikationen durch ASS durch eine äquivalente Reduktion an ischämischen Komplikationen aufgewogen wird.11 Mehr als einen Monat nach Randomisierung zeigt sich hingegen kein ischämischer Benefit mehr von ASS, sondern nur noch eine Erhöhung der Blutungskomplikationen. Diese Risiko/Benefit-Ratio legt nahe, dass es kaum Gründe gibt, ein TAT-Regime über >1 Monat nach PCI (oder ACS) zu erstrecken.
Wie viele und welche Antithrombotika braucht es noch ein Jahr nach PCI?
Dieser Fragestellung widmeten sich zwei kürzlich publizierte randomisierte Studien aus dem asiatischen Raum: Die japanische AFIRE-Studie untersuchte erstmals bei 2236 Patient:innen mit nvVHF und stabiler koronarer Herzkrankheit (KHK) (d.h. entweder medikamentös behandelte KHK oder >1 Jahr nach PCI/Bypassoperation) eine Rivaroxaban-Monotherapie (in der für Japan zur Schlaganfallprophylaxe zugelassenen Dosierung von 15mg/d) gegenüber einer DAT mit Rivaroxaban + Thrombozytenaggregationshemmer (in 70% ASS).12 Die Studie wurde aufgrund einer erhöhten Gesamtmortalität sowie signifikant erhöhter Blutungskomplikationen im DAT-Arm vorzeitig abgebrochen. Die Rivaroxaban-Monotherapie führte nach einem Jahr zu einer signifikanten 41%igen Reduktion der Blutungsendpunkte (schwere Blutungen nach ISTH-Kriterien) sowie einer numerischen 28%igen Reduktion des kombinierten ischämischen Endpunktes (p<0,001 für «non-inferiority»).
Die jüngsten Daten stammen aus der koreanischen EPIC-CAD-Studie, die 1040 Patient:innen mit nvVHF und stabiler bzw. stabilisierter KHK (d.h. entweder medikamentös behandelte KHK oder >6 Monate nach elektiver PCI/Bypassoperation oder >1 Jahr nach ACS mit PCI) zu einer Edoxaban-Monotherapie (60mg/d) versus eine DAT bestehend aus Edoxaban + Thrombozytenaggregationshemmer (in 62% ASS) randomisierte.13 Nach einem Jahr trat der kombinierte Endpunkt (Tod, Myokardinfarkt, ungeplante Revaskularisation, Schlaganfall, systemische Embolie oder schwere Blutung) in der Monotherapiegruppe signifikant seltener auf (6,8% vs. 16,2%; p<0,001).
Zusammenfassung der Evidenz – Empfehlungen für die Praxis
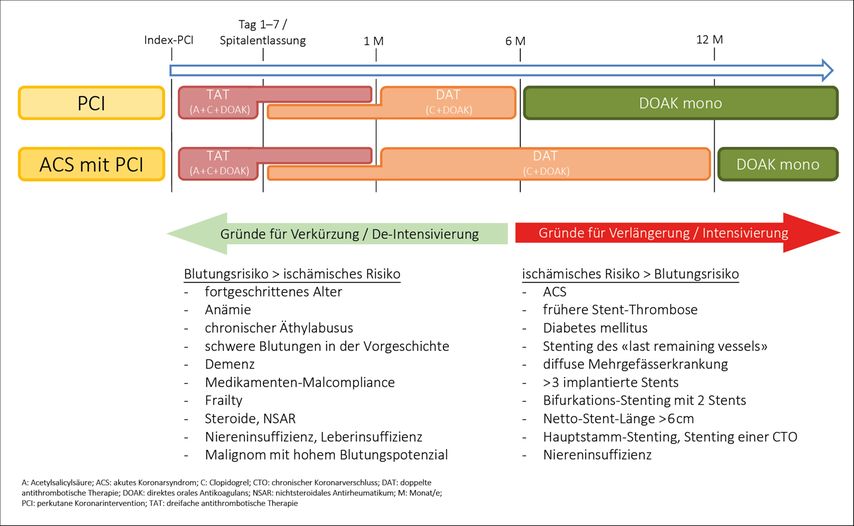
Die eingangs diskutierten Studien bilden die Evidenzgrundlage für die Therapieempfehlungen nach PCI/ACS bei VHF-Patient:innen und finden sich in ähnlichen oder leicht abgewandelten Versionen in diversen aktuellen europäischen und amerikanischen Richtlinien (KHK, VHF, ACS etc.). Abbildung 2 und Tabelle 1 geben eine vereinfachte Übersicht über diese Therapieempfehlungen: Unmittelbar postinterventionell wird eine TAT (DOAK, Clopidogrel, ASS) in der Regel für weniger als sieben Tage empfohlen. Im klinischen Alltag erfolgt das Absetzen der ASS-Therapie meist bereits bei Spitalentlassung. Mehr als ein Jahr nach PCI/ACS ist eine OAK-Monotherapie ausreichend. Eine zusätzliche Thrombozytenaggregationshemmung führt nur zu einer unnötigen Erhöhung der Blutungskomplikationen.
Abb. 2: Empfehlungen zur antithrombotischen Therapie in Abhängigkeit vom individuellen ischämischen und hämorrhagischen Risiko des Patienten/der Patientin (adaptiert und zusammengefasst aus den 2023 ESC-Guidelines für ACS, den 2024 ESC-Guidelines für VHF und den 2024 ESC-Guidelines für chronisches Koronarsyndrom)
Tab. 1: Empfehlungen zur antithrombotischen Therapie bei Patient:innen mit Vorhofflimmern nach PCI oder ACS
Für die klinische Praxis bedeutet dies, dass Patient:innen mit VHF nach PCI heute deutlich risikoärmer behandelt werden können als noch vor wenigen Jahren. Es gibt jedoch auch hier keine «Pauschalstrategie». Entscheidend ist die individuelle Anpassung der Therapieintensität bzw. -dauer in Abhängigkeit vom individuellen ischämischen bzw. hämorrhagischen Risiko. Die von den Fachgesellschaften vorgeschlagenen Therapiealgorithmen dienen hierfür als strukturelle Grundlage, müssen allerdings individuell angepasst werden und auch laufend vom behandelnden Ärzteteam reevaluiert werden.
Ebenfalls ist ein enger Austausch innerhalb des behandelnden Teams (interventionelle Kardiologin/interventioneller Kardiologe, Herzchirurg:in, zuweisende Kardiologin/zuweisender Kardiologe, Hausärztin/Hausarzt) wichtig. Neben dem antithrombotischen Regime sind noch weitere Massnahmen hilfreich, um das Blutungsrisiko unter intensivierten antithrombotischen Therapien weiter zu reduzieren (Tab.2). Insbesondere während der Dauer einer TAT oder DAT sind engmaschige klinische und laborchemische Kontrollen erforderlich. Die Patient:innen müssen auf Blutungsstigmata sensibilisiert und regelmässig auf das Risiko für okkulte Blutungen aufmerksam gemacht werden. Bei klinischen Problemfällen wie klinisch relevanten Blutungen, dringenden Operationen, Unfällen etc. empfiehlt sich in Bezug auf die antithrombotische Therapie die direkte Rücksprache mit den verantwortlichen interventionellen Kardiolog:innen.
Tab. 2: Weitere praktische Empfehlungen zur Reduktion des Blutungsrisikos bei Patient:innen mit Vorhofflimmern nach PCI oder ACS
Literatur:
1 Schomig A et al.: A randomized comparison of antiplateletand anticoagulant therapy after the placement of coronary-artery stents. N Engl J Med 1996; 334: 1084-9 2 Investigators AWGotA et al.: Clopidogrel plus aspirin versus oral anticoagulation for atrial fibrillation in the Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events (ACTIVE W): a randomised controlled trial. Lancet 2006; 367: 1903-12 3 van Rein N et al.: Major Bleeding Rates in Atrial Fibrillation Patients on Single, Dual, or Triple Antithrombotic Therapy. Circulation 2019; 139: 775-86 4 Valgimigli M et al.: Trade-off of myocardial infarction vs. bleeding types on mortality after acute coronary syndrome: lessons from the Thrombin Receptor Antagonist for Clinical Event Reduction in Acute Coronary Syndrome (TRACER) randomized trial. Eur Heart J 2017; 38: 804-10 5 Dewilde WJ et al.: Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Lancet 2013; 381: 1107-15 6 Gibson CM et al.: Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375: 2423-34 7 Cannon CP et al.: Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2017; 377: 1513-24 8 Vranckx P et al.: Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI): a randomised, open-label, phase 3b trial. Lancet 2019; 394: 1335-43 9 Lopes RD et al.: Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation. N Engl J Med 2019; 380: 1509-24 10 Gargiulo G et al.: Safety and efficacy outcomes of double vs. triple antithrombotic therapy in patients with atrial fibrillation following percutaneous coronary intervention: a systematic review and meta-analysis of non-vitamin K antagonist oral anticoagulant-based randomized clinical trials. Eur Heart J 2019; 40: 3757-67 11 Alexander JH et al.: Risk/benefit tradeoff of antithrombotic therapy in patients with atrial fibrillation early and late after an acute coronary syndrome or percutaneous coronary intervention: insights from AUGUSTUS. Circulation 2020; 141: 1618-27 12 Yasuda S et al.: Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019; 381: 1103-13 13 Cho MS et al.: Edoxaban antithrombotic therapy for atrial fibrillation and stable coronary artery disease. N Engl J Med 2024; 391: 2075-86
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...