Adipositas und Herzinsuffizienz –Volkskrankheiten und ihre Folgen
Autorin:
OÄ Dr. Regina Steringer-Mascherbauer
Leitung Referenzzentrum Pulmonale Hypertension,
Leitung Kardiale Magnetresonanztomographie (in Kooperation mit der Abt. für Radiologie), Stationsführung 9B SK
Ordensklinikum Linz
Übergewicht und Adipositas stellen weltweit eine Herausforderung dar. Die Prognosen für Österreich zumAnteil der adipösen Bevölkerung liegen im weltweiten Trend. 2035 werden circa 40% aller Männer und 28% aller Frauen an Adipositas erkrankt sein. Erschreckend sind die Voraussagen für Jugendliche: 20% aller Jungen und 12% aller Mädchen werden 2035 von Adipositas betroffen sein.1
Keypoints
-
Bei Adipositas vermehrtes viszerales Fettgewebe setzt übersteigert freie Fettsäuren frei, die ausgelösten Effekte am Herzmuskel können zu Adipositas-bedingter HFpEF führen.
-
Neurohumorale Mechanismen führen zu einer gesteigerten Akkumulation von Noradrenalin im Myokard, die die systolische Leistung des Herzmuskels verschlechtert.
-
Wichtig ist zu wissen, dass bei Adipositas-HFpEF die NT-proBNP-Werte niedriger und oftmals „normal“ sind.
-
Die medikamentöse Therapie der Adipositas-bedingten HFpEF unterscheidet sich derzeit nicht von der bei normgewichtigen Patienten mit HFpEF.
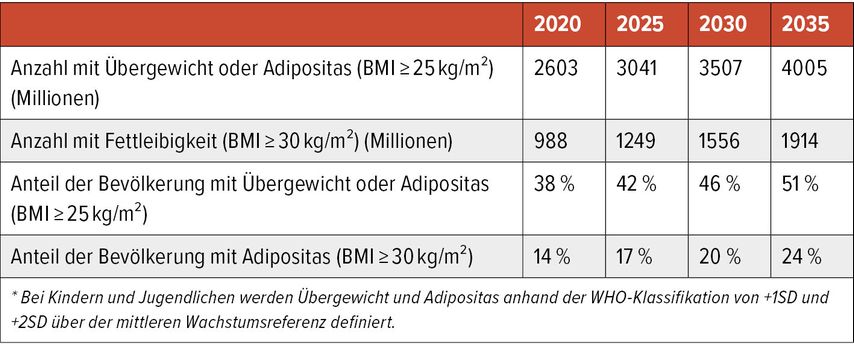
Im World Adipositas Atlas 2023 zeigt sich, dass der Anteil an übergewichtigen und adipösen Menschen überproportional steigt (Tab. 1).1 Demzufolge wird Adipositas mit ihren Komplikationen zur medizinischen und volkswirtschaftlichen Herausforderung werden. Ein Body-Mass-Index (BMI) von 25 bis <30kg/m2 wird als Übergewicht bezeichnet, ein BMI ≥30kg/m2gilt als Adipositas.
Tab. 1: (Prognostizierte) Anzahl der Menschen (Alter über 5 Jahre) und Anteil der Bevölkerung mit Übergewicht oder Adipositas*
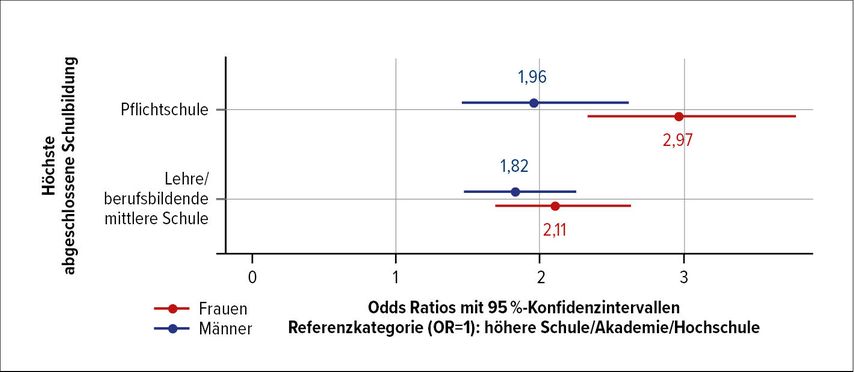
Es stellt sich die Frage, welche sozioökonomischen Determinanten Einfluss auf die Prävalenz von Adipositas bei Frauen und Männern haben. Daten, die in der österreichischen Gesundheitsbefragung 2019 erhoben wurden, zeigen, dass die Bildung in beiden Geschlechtsgruppen der einzige signifikante Faktor war (Abb. 1).2
Abb. 1: Prävalenz von Adipositas bei Frauen und Männern nach Bildung (modifiziert nach ATHIS – Austrian Health Interview Survey 2019, Statistik Austria)2
Übergewicht und Adipositaslebensgefährdend
Weltweit werden 4 Millionen Todesfälle in Zusammenhang mit erhöhtem BMI gebracht,40% der Todesfälle sind durch Übergewicht (BMI 25–29) bedingt.3
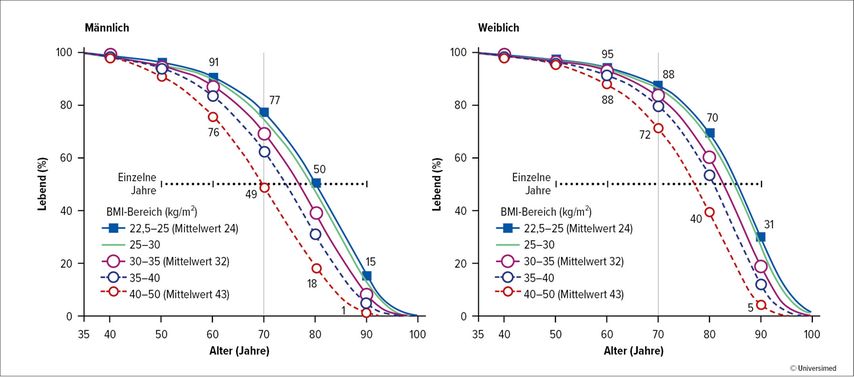
Laut Krishnan et al. liegt der ideale BMI zwischen 20 und 25kg/m2.4 Ein BMI <20 und >25kg/m2 ist in allen Altersgruppen sowohl bei Frauen als auch bei Männern mit einer erhöhten Mortalität behaftet. Die Daten basieren auf einer UK-Kohortenanalyse, bei der 3632674 Menschen ab einem Alter von 16 Jahren eingeschlossen wurden.
In der Kohorte von 1969648 Nichtrauchern kam es zu 188057 Todesfällen. Der BMI hatte eine J-förmige Assoziation mit der „overall mortality“. Die geschätzte Hazard-Ratio per 5kg/m2 Zunahme des BMI war 0,81 (95% CI: 0,80–0,82) unterhalb eines BMI von 25kg/m2 und 1,21 (1,20–1,22) oberhalb eines BMI von 25kg/m2. Es fand sich eine Assoziation zwischen BMI und allen Todesartenkategorien (Ausnahme Todesursache Verkehrsunfall).
Abb. 2: Body-Mass-Index und fallspezifische Mortalität untersucht an 900000 Erwachsenen (modifiziert nach Prospective Studies Collaboration 2009)6
Adipositas und kardiometabolische Erkrankungen
Adipositas ist assoziiert mit metabolischen und kardiovaskulären Erkrankungen. Nur 15–20% aller adipösen Menschen gelten als metabolisch gesund.5Dies bedeutet aber nicht, dass die metabolisch gesunden Adipösen eine normale Lebenserwartung haben. Witlock et al.führten eine Datenanalyse von 57 prospektiven Studien (Recruitmentjahre 1975–1985) mit 894576 Teilnehmern aus Westeuropa und Nordamerika mit einemMänneranteil von 61% und mittlerem BMI von 25kg/m2durch. Dabei zeigte sich, dass jede BMI-Zunahme um 5kg/m2 mit einer 30%höheren Gesamtmortalität und einer 40% höherenkardiovaskulären Mortalität (HR: 1,41; 95% CI: 1,37–1,45)einhergeht. Ein BMI von 30–35kg/m2reduziert das mediane Überleben um 2–4 Jahre, ein BMI von 40–45kg/m2 um 8–10 Jahre.6
Adipositas und Herzinsuffizienz
Epidemiologische Studien identifizierten eine starke unabhängige Beziehung zwischen Adipositas und der Entwicklung einer Herzinsuffizienz mit erhaltener Ejektionsfraktion (HFpEF).7–9
Im Gegensatz zur atherosklerotischen Gefäßerkrankung ist die Verbindung zwischen Adipositas und Herzinsuffizienz nicht durch die traditionellen kardiovaskulären Risikofaktoren erklärbar. HFpEF als Komplikation von vermehrtem Körperfett wird oft vernachlässigt und aus diesem Grund nicht diagnostiziert und nicht behandelt. Neue Daten zeigen, dass HFpEF eine direkte Folge der Adipositas ist. Durch multiple Effekte an der Myokardstruktur und -funktion, am Metabolismus und auch an der Lunge, den Skelettmuskeln sowie an Niere und Leber erfolgen durch eine systemische Inflammation eine neurohumorale Aktivierung, eine autonome Dysregulation und eine veränderte Hämodynamik, wodurch eine Erhöhung der Nachlast verursacht wird.10–14
Die Rolle des Fettgewebes
Viszerales Fettgewebe ist ein Prädiktor für ein abnormes metabolisches Profil.Dies führte zur Hypothese, dass viszerales Fettgewebe direkt eine Insulinresistenz, Inflammation, eineBeschleunigung des Alterungsprozesses und eine Mitochondriendysfunktion bedingt.15–18
Die Zunahme des Körperfettes kann durch Adipozytenhypertrophie oder durch Generierung neuer Adipozyten (Hyperplasie) erfolgen. Hypertrophie und Hyperplasie variieren von Person zu Person und von Fettdepot zu Fettdepot. Die Balance zwischen Hypertrophie und Hyperplasie hat einen Einfluss auf die metabolischen Konsequenzen der Adipositas. Hypertrophierte subkutane Adipozyten sind mit einem erhöhten kardiometabolischen Risiko verbunden.19
Vor 24 Jahren wurde postuliert, dass Typ-2-Diabetesdurch eine Adipozytenhypertrophie im subkutanen abdominellen Fettgewebe aufgrund einer fehlenden Differenzierung der Präadipozyten zu funktionierenden Fettspeicherzellen hervorgerufen wird.20 Hypertrophierte Adipozyten sind insulinresistent und haben einen größeren Lipolyseanteil. Hypertrophierte subkutane Adipozyten führen zu einer beträchtlichen Zunahme des viszeralen Fettgewebes. Hyperplasie führt zum Erhalt der subkutanen Fettzellgröße und -funktion und nur zu einer geringen Zunahme des viszeralen Fettgewebes. Die Hauptfunktion des Fettgewebes sind die Speicherung und Freisetzung von Fettsäuren. Es speichert die zirkulierenden Triglyzeride und freien Fettsäuren, die von den übrigen Geweben nicht für den Grundstoffwechsel benötigt werden.
Fettgewebe und Herzinsuffizienz
Gesundes Fettgewebe setzt freie Fettsäuren entsprechend dem Energiebedarf frei. Bei Adipositas vermehrtes viszerales Fettgewebe setzt übersteigert freie Fettsäuren in die Zirkulation frei, die wiederum deletäre Effekte am Herzmuskel bei Adipositas-bedingter HFpEF bedingen. Im Laufe der Zeit führen überschüssige freie Fettsäuren zur Fettspeicherung in ektopischen Depots (viszerales Fettgewebe, präkardiales Fettgewebe, Skelettmuskel, Leber).21
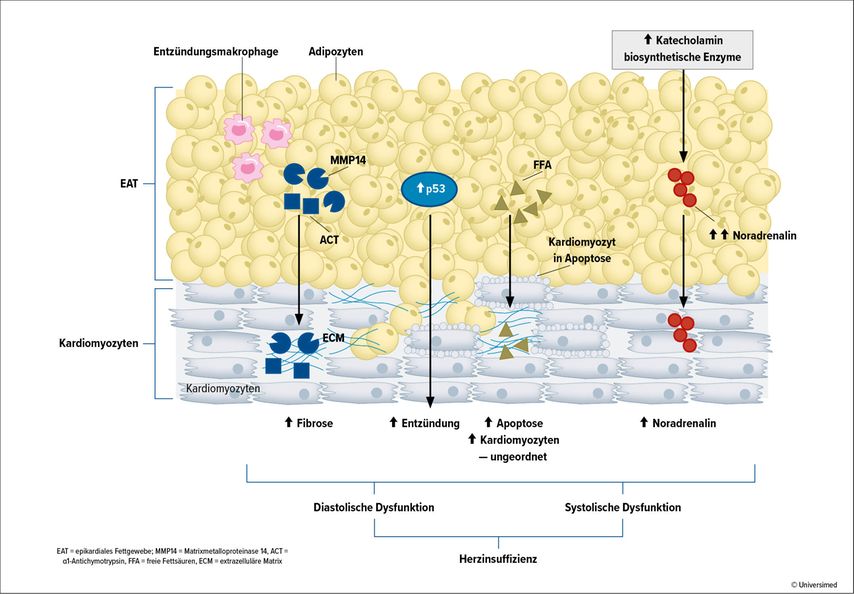
Epikardiales Fettgewebe ist ein Fettdepot, das zwischen Myokard und viszeralem Epikard liegt und vom Myokard nicht durch eine Faszie getrennt ist. Es spielt eine Rolle bei der Entwicklung kardiovaskulärer Erkrankungen durch komplexe Mechanismen wie z.B. proinflammatorische und profibrotische Proteome.22
Epikardiales Fettgewebsproteom trägt zur Entwicklung von Herzinsuffizienz durch parakrine Sekretion von profibrotischen Faktoren wie Alpha-1-Antichymotrypsin (ACT; auch Serpin A3) und durch Matrix-Metalloproteinase 14 (MMP14) und inflammatorische Marker, wie P53, und freie Fettsäuren (FFA) bei. Großes und fibrotisches epikardiales Fettgewebe kann die systolische und diastolische Funktion des Herzens beeinflussen. Neurohumorale Mechanismen wie z.B. erhöhte Katecholamin-Biosyntheseaktivität führen zu einer gesteigerten Akkumulation von Noradrenalin im Myokard, die die systolische Leistung des Herzmuskels verschlechtert (Abb. 3).22
Abb. 3: Epikardiales Fettgewebe trägt zur Entwicklung von Herzinsuffizienz bei, dargestellt sind spezifische Mechanismen, die diese mit Herzinsuffizienz in Verbindung bringen (modifiziert nach Giacobellis et al.: Nat Rev Cardiol 2022)22
Eine Zunahme des epikardialen Fettgewebes bei HFpEF bewirkt eine schwere hämodynamische Alteration, eine schwerere Störung des RV-PA-Couplings, eine ausgeprägtere LV-Fibrosesowie eine stark verminderte Belastungsbreite und führt zu einer höheren Hospitalisierungs- und Todesrate.23–28 Verringerung des epikardialen Fettgewebes führt zu einer Herzinsuffizienz mit reduzierter EF.27, 28
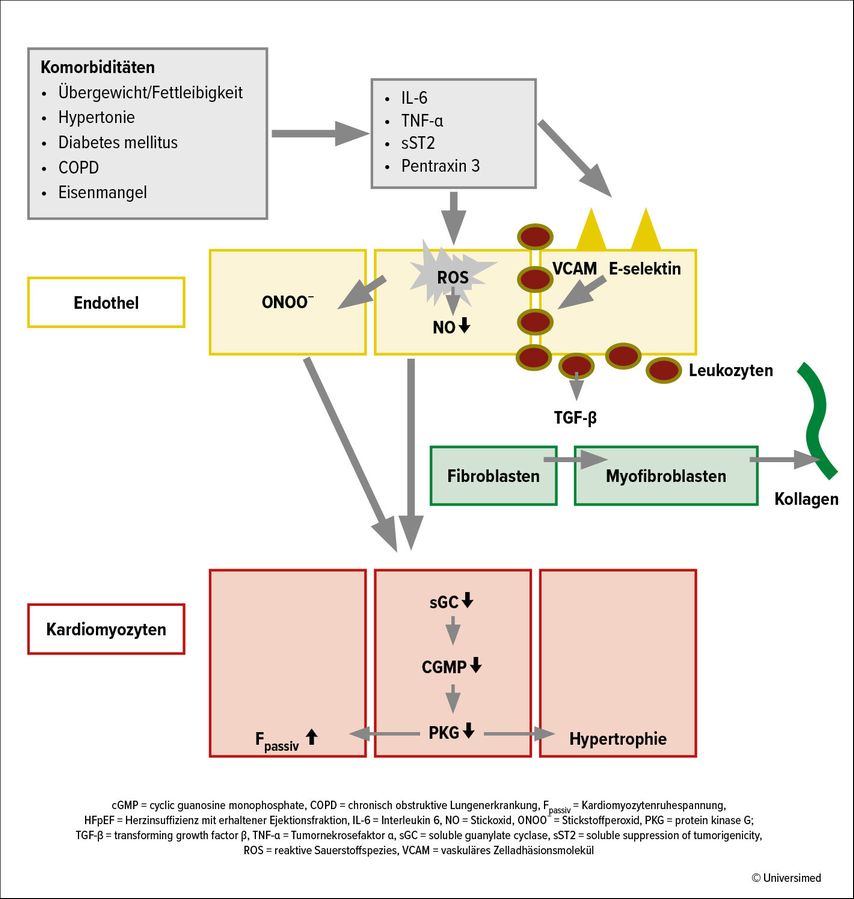
Das Paulus-Paradigma versucht, das myokardiale Remodeling und die myokardiale Dysfunktion bei HFpEF mit dem durch Komorbiditäten, vor allem durch Adipositas, bedingten systemischen proinflammatorischen Status zu erklären. Aufgrund des proinflammatorischen Status produzieren die koronaren mikrovaskulären Endothelzellen „reactive oxygen species“ (ROS), die die NO-Bioverfügbarkeit für die angrenzenden Kardiomyozyten vermindert.Dies führt dazu, dass die Proteinkinase-G(PKG)-Aktivität in den Kardiomyozyten abnimmt. Eine niedrige PKG-Aktivität führt zur Kardiomyozyten-Hypertrophie und verursacht so ein konzentrisches LV-Remodeling und eine „stiffness“ der Myozyten durch eine Hypophosphorilierung des großen Cytoskeletal-Proteins Titin. Steife Kardiomyozyten und erhöhte Kollagenablagerung durch Myofibroblasten verursachen die diastolische LV-Dysfunktion (Abb. 4).10
Abb. 4: Komorbiditäten fördern Myokarddysfunktion und Remodeling bei HFpEF (modifiziert nach Paulus WJ, Am Coll Cardiol 2013)10
Wichtig ist zu wissen, dass bei Adipositas-HFpEF die NT-proBNP-Werte niedriger und oftmals „normal“ sind.29
Therapeutische Optionen bei HFpEF
Therapeutische Optionen bei HFpEF umfassen Lebensstilmodifikation, bariatrische Chirurgie und medikamentöse Therapie.
Einfluss auf das epikardiale Fettgewebe kann durch Lebenstilmodifikation (Ernährungsumstellung und Steigerung der körperlichen Aktivität) genommen werden. In der Studie STEP-HFpEF30 zeigt sich im Placeboarm eine Senkung des Ausgangskörpergewichts von 2,6% in der Woche 52. Die Lebensstilmodifikation gehört somit zur Basistherapie der Adipositas-bedingten HFpEF.
Die medikamentöse Therapie der Adipositas-bedingten HFpEFunterscheidet sich derzeit nicht von der bei normgewichtigen Patienten mit HFpEF.Derzeit zugelassen für die Behandlung der HFpEF sind die SGLT2-Inhibitoren Empagliflozin (Studie EMPEROR preserved) und Dapagliflozin (Studie DELIVER). Einen besonders positiven Effekt zeigteder GLP-1-Agonist (Inkretinmimetikum) Semaglutid (STEP-HFpEF),30 mit einer Senkung des Körpergewichtes um 13,3% in Woche 52. Die GLP-1-Agonistentherapie zur Behandlung von Adipositas-bedingter HFpEF ist jedoch derzeit noch nicht zugelassen.
Eine Indikation für die bariatrische Chirurgie liegt bei einem BMI ≥40/m2 oder BMI ≥35/m2 plus 1 Adipositas-assoziierte Komorbidität vor.
Prävention von Adipositas durch Lebensstilmodifikation
Förderung der Bewegung und der gesunden Ernährung sollte bereits ab dem Kleinkindesalter mehr Bedeutung beigemessen werden, um in weiterer Folge die Adipositas-assoziierten kardiovaskulären Erkrankungen zu verhindern.
Literatur:
1 Adipositas World Atlas 2023 2 ATHIS – Austrian Health Interview Survey 2019 Statistik Austria 3 GBD 2015 Obesity Collaborators: Health effects of overweight and obesity in 195 countries over 25 years. N Engl J Med 2017; 377(1): 13-27 4 Krishnan et al.: Association of BMI with overall and cause-specific mortality: a population-based cohort study of 3·6 million adults in the UK. Lancet Diabetes Endocrinol 2018; 6(12): 944-53 5 Ferrannini E et al.: Insulin resistance and hypersecretion in obesity. European Group for the Study of Insulin Resistance (EGIR). J Clin Invest 1997; 100(5): 1166-73 6 Prospective Studies Collaboration: Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. Lancet 2009; 373(9669): 1083-96 7 Ho JE et al.: Predictors of new-onset heart failure: differences in preserved versus reduced ejection fraction. Circ Heart Fail 2013; 6(2): 279-86 8 Brouwers FP et al.: Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort:11-year follow-up of PREVEND. Eur Heart J 2013; 34(19): 1424-31 9 Pandey A et al.: Relationship between physical activity, body massindex, and risk of heart failure. J Am Coll Cardiol 2017; 69(9): 1129-42 10 Paulus WJ, Tschope C: A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol 2013; 62(4): 263-71 11 Borlaug BA et al.: Global cardiovascular reserve dysfunction in heart failure with preserved ejection fraction. J Am Coll Cardiol 2010; 56(11): 845-54 12 Obokata M et al.: Evidence supporting the existence of a distinct obese phenotype of heart failure with preserved ejection fraction. Circulation 2017; 136(1): 6-19 13 Mohammed SF et al.: Coronary microvascular rarefaction and myocardial fibrosis in heart failure with preserved ejection fraction. Circulation 2015; 131(6): 550-9 14 Kitzman DW, Lam CSP: Obese heart failure with preserved ejection fraction phenotype: from pariah to central player. Circulation 2017; 136(1): 20-3 15 Cefalu WT et al.: Contribution of visceral fat mass to the insulin resistance of aging. Metabolism 1995; 44(7): 954-9 16 Seidell JC et al.: Visceral fat accumulation in men is positively associated with insulin, glucose, and C-peptide levels, but negatively with testosterone levels. Metabolism 1990; 39(9): 897-901 17 Kuk JL et al.: Visceral fat is an independent predictor of all-cause mortality in men. Obesity (Silver Spring) 2006; 14(2): 336-41 18 Wang L et al.: Targeting p21(Cip1) highly expressing cells in adipose tissue alleviates insulinresistance in obesity. Cell Metab 2022; 34(1): 75-89 19 O’Connell J et al.: The relationship of omental, subcutaneous adipocyte size to metabolic disease in severe obesity. PLoS One 2010; 5(4): e9997 20 Danforth EJ: Failure of adipocyte differentiation causes type II diabetes mellitus? Nat Genet 2000; 26(1): 13 21 Goodpaster BH et al.: Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. Am J Clin Nutr 2000; 71(4): 885-92 22 Giacobellis et al.: Epicardial adipose tissue in contemporary cardiology. Nat Rev Cardiol 2022; 19(9): 593-606 23 Koepp KE et al.: Hemodynamic and functional impact of epicardial adipose tissue in heart failure with preserved ejection fraction. JACC Heart Fail 2020; 8(8): 657-66 24 Pugliese NR et al.: Impact of epi-cardial adipose tissue on cardiovascular haemodynamics, metabolic profile, and prognosis in heart failure. Eur J Heart Fail 2021; 23(11): 1858-71 25 Gorter TM et al.: Epicardial adipose tissue and invasive hemodynamics in heart failure with preserved ejection fraction. JACC Heart Fail 2020; 8(8): 667-76 26 van Woerden G et al.: Epicardial adipose tissue and outcome in heart failure with mid-range and preserved ejection fraction. Circ Heart Fail 2021; 15(3): e009238 27 Tromp J et al.: The diverging role of epicardial adipose tissue in heart failure with reduced and preserved ejection fraction: not all fat is created equal. Eur J Heart Fail 2021; 23(11): 1872-74 28 Tromp J et al.: Epicardial fat in heart failure with reduced versus preserved ejection fraction. Eur J Heart Fail 2021; 23(5): 835-8 29 Verbrugge FH et al.: Heart failure with preserved ejection fraction in patients with normal natriuretic peptide levels is associated with increased morbidity and mortality. Eur Heart J 2022; 43(20): 1941-51 30 Kosiborod MN et al.: Semaglutide in patients with heart failure with preserved ejection fraction and obesity. N Engl J Med 2023; 389(12): 1069-84
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...