Therapieoptimierung mit Studiendaten vom ASCO GU
Bericht:
Dr. Ine Schmale
Mehr als 5800 Teilnehmer*innen konnte die American Society of Clinical Oncology (ASCO) beim Genitourinary Cancers Symposium in San Francisco und online begrüssen und ihnen ein hochkarätiges Programm bieten. Unter den zahlreichen Studiendaten wurden auch Ergebnisse präsentiert, die neue Therapiestandards bei urologischen Entitäten definieren oder bestätigen.
Darolutamid + ADT und Docetaxel neuer Standard beim mHSPC
Die doppelblinde, placebokontrollierte Phase-III-Studie ARASENS untersuchte die Wirksamkeit und Sicherheit von Darolutamid in Kombination mit Androgendeprivationstherapie (ADT) und Docetaxel. Beim ASCO GU wurden Ergebnisse in Bezug auf das Krankheitsvolumen und das Progressionsrisiko zu Studienbeginn präsentiert.1 Die Ergebnisse bestätigen, dass Darolutamid plus ADT und Docetaxel als neuer Standard für die Behandlung von Patienten mit metastasiertem hormonsensitivem Prostatakarzinom (mHSPC) aller Risikogruppen erwogen werden sollten, schlussfolgerten die Autoren.
Ein hohes Krankheitsvolumen wird laut den CHAARTED-Kriterien definiert als das Vorhandensein von Viszeralmetastasen und ≥4 Knochenmetastasen mit ≥1 Metastase außerhalb der Wirbelsäule und des Beckens. Die Hochrisikoerkrankung wird laut LATITUDE-Kriterien definiert durch das Vorhandensein von ≥2 Risikofaktoren (Gleason Score ≥8, ≥3 Knochenmetastasen, Viszeralmetastasen). Von 1305 Studienteilnehmern der ARASENS-Studie zeigten 77% ein hohes Krankheitsvolumen und 70% eine Hochrisikoerkrankung entsprechend den CHAARTED- und LATITUDE-Kriterien.
Für Patienten mit hohem Krankheitsvolumen wurde mit Darolutamid das Risiko, zu versterben, gegenüber Placebo um 31% reduziert (HR: 0,69; 95% CI: 0,57–0,82). Das mediane Gesamtüberleben (OS) war für diese Patienten im Darolutamid-Arm noch nicht erreicht und betrug 42,4 Monate im Kontrollarm. Für Patienten mit geringem Krankheitsvolumen zeigte sich eine Aufspaltung der Kurven nach etwa drei Jahren, der Median wurde in den Kaplan-Meier-Kurven für beide Studienarme noch nicht erreicht (HR: 0,68; 95% CI: 0,41–1,13). Patienten mit Hochrisikoerkrankung hatten durch Darolutamid ein um 29% geringeres Risiko, zu versterben, im Vergleich zum Placebo-Arm (HR: 0,71; 95% CI: 0,58–0,86), mit einem nicht erreichten Median unter der Darolutamid-Kombination versus median 43,2 Monate im Placebo-Arm. Innerhalb der Niedrigrisikogruppe teilten sich die Kaplan-Meier-Kurven bereits am Anfang und es wurde eine 38%ige Reduktion des Risikos, zu versterben, beobachtet (HR: 0,62; 95% CI: 0,42–0,90). In beiden Studienarmen war der Median noch nicht erreicht. Bezüglich der Zeit bis zum kastrationsresistenten Stadium wurde ein noch deutlicherer Vorteil für alle Patientengruppen mit einer Hazard-Ratio zwischen 0,21 und 0,41 gesehen.
Olaparib + Abirateron beim CRPC
Mit der randomisierten, placebokontrollierten Phase-III-Studie PROpel wurde die zusätzliche Gabe von Olaparib zu Abirateron in der ersten Therapielinie des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) geprüft.2 Eingeschlossen wurden insgesamt 796 Patienten in einem Alter von median 69–70 Jahren. 28–29% der Patienten wiesen eine HRR- (homologe Rekombinationsreparatur)-Gen-Alteration auf, 69–70% zeigten keine HRR-Gen-Alteration und bei 2% war der HRR-Status unbekannt. BRCA-Mutationen lagen bei 10–12% der Patienten vor. Primärer Studienendpunkt war eine Verlängerung des radiologischen progressionsfreien Überlebens (rPFS).
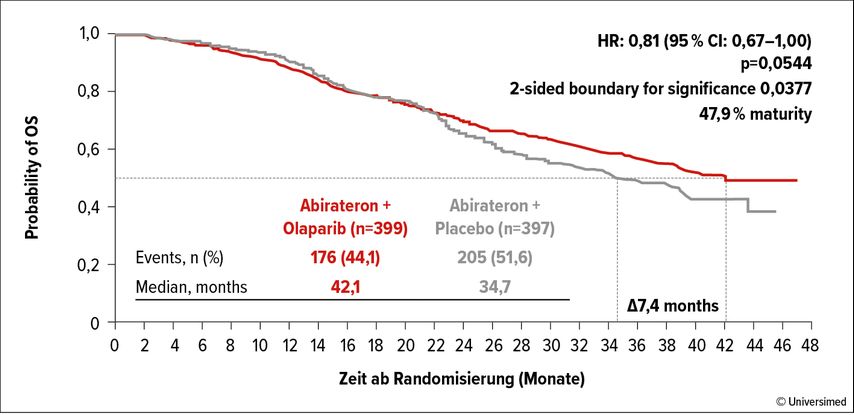
Mit einer medianen Nachbeobachtungszeit von 19 Monaten betrug das mediane rPFS 24,8 im Olaparib-Arm versus 16,6 Monate im Placebo-Arm (HR: 0,66; 95% CI: 0,54–0,81; p<0,0001). Dieser Vorteil wurde für alle untersuchten Subgruppen bestätigt. Die Reife für die OS-Ergebnisse betrug zum Zeitpunkt der präspezifizierten finalen Analyse 47,9%. Im Median lag das OS bei 42,1 versus 34,7 Monate mit einer Hazard-Ratio von 0,81 (95% CI: 0,67–1,00; p=0,0544) (Abb. 1). Bei Patienten mit HRR-Gen-Mutationen wurde eine 34%ige Reduktion des Risikos, zu versterben, beobachtet (HR: 0,66; 95% CI: 0,45–0,95), für Patienten ohne HRR-Gen-Mutationen war das Risiko um 11% reduziert (HR: 0,70–1,14). Im Median lebten Patienten im Kontrollarm 28,5 bzw. 38,9 Monate mit vs. ohne HRR-Gen-Mutationen, was auf den negativen prognostischen Einfluss einer HRR-Gen-Mutation hinweist. Im Studienarm mit Abirateron plus Olaparib war das mediane OS für Patienten mit HRR-Gen-Mutationen noch nicht erreicht und betrug 42,1 Monate für Patienten ohne HRR-Gen-Mutationen.
Abb. 1: Gesamtüberleben unter Abirateron plus Olaparib versus Abirateron plus Placebo. Modifiziert nach Clarke NW et al.2
Auch bezüglich weiterer sekundärer Endpunkte zeigte sich die Kombination von Abirateron plus Olaparib der Behandlung mit Abirateron plus Placebo überlegen. Die Zeit bis zur ersten nachfolgenden Therapielinie oder bis zum Tod (TFST) betrug median 24,6 vs. 19,4 Monate (HR: 0,76; 95% CI: 0,64–0,90). Der Median bezüglich der Zeit bis zum Progress unter der nachfolgenden Therapie (PFS2) war in beiden Studienarmen nicht erreicht (HR: 0,76; 95% CI: 0,59–0,99).
RCC: Langzeitergebnisse bestätigen OS-Benefit für TKI-IO-Kombination
Die Therapie des metastasierten Nierenzellkarzinoms (RCC) wird durch die immunonkologische (IO) Therapie mit Checkpoint-Inhibitoren in Kombination mit Tyrosinkinaseinhibitoren (TKI) geprägt. Für die Kombination von Nivolumab plus Cabozantinib in der Erstlinientherapie wurden beim diesjährigen ASCO GU bestätigende OS-Daten präsentiert und auch für Patient*innen mit Hirnmetastasen zeigte sich die IO-basierte Therapie als vorteilhaft.
In der randomisierten, offenen Phase-III-Studie CheckMate 9ER wurden insgesamt 651 Patient*innen mit unbehandeltem, fortgeschrittenem oder metastasiertem klarzelligemRCC bis zum Tumorprogress oder bis zu nicht akzeptabler Toxizität behandelt, davon 146 mit niedrigem, 376 mit mittlerem sowie 129 Patient*innen mit hohem Rezidivrisiko. Bei einem Viertel der Patient*innen wurde eine PD-L1-Expression ≥1% nachgewiesen. Mit einer medianen Nachbeobachtungszeit von 44 Monaten (minimal 36,5 Monaten) bestätigten die nun reiferen OS-Daten einen anhaltenden OS-Vorteil durch die Kombinationstherapie.3
Mit der längeren Nachbeobachtungszeit zeigte sich bezüglich des primären Endpunkts (progressionsfreies Überleben, PFS) weiterhin eine 42%ige Reduktion des Progressionsrisikos (HR: 0,58; 95% CI: 0,48–0,71). Innerhalb der Gruppe mit mittlerem oder hohem Risiko betrug die Reduktion des Risikos für einen Krankheitsprogress 45% (HR: 0,55; 95% CI: 0,45–0,69) und in der Gruppe mit niedrigem Risiko 25% (HR: 0,75; 95% CI: 0,50–1,13). Nach 36 Monaten lebten 20,5% versus 10,0% der Gruppe mit mittlerem/hohem Risiko und 25,4% vs. 16,1% der Niedrigrisikopatient*innen progressionsfrei.
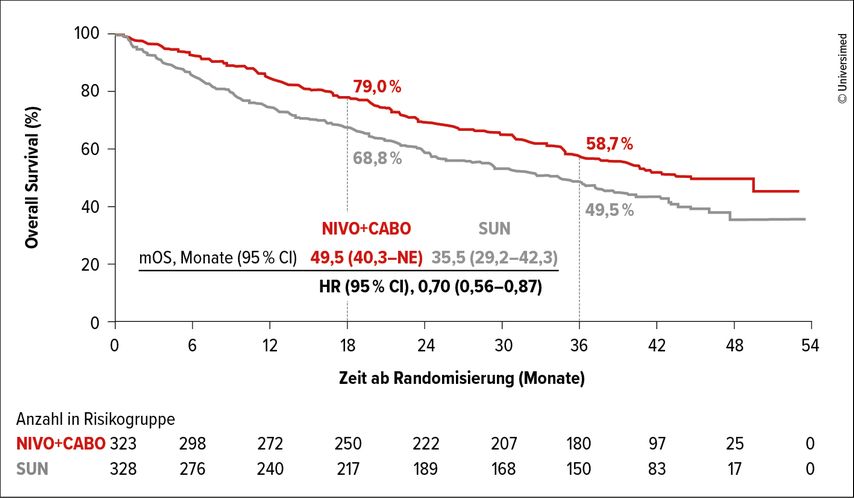
Die 3-Jahres-Analyse der OS-Ergebnisse zeigte für die ITT-Population eine signifikante Reduktion des Risikos, zu versterben, um 30% (HR: 0,70; 95% CI: 0,56–0,87), mit medianen Überlebenszeiten von 49,5 vs. 35,5 Monate und 36-Monats-OS-Raten von 58,7% vs. 49,5% (Abb. 2). Bezüglich der Risikogruppen bestätigte sich der signifikante OS-Vorteil für Patient*innen mit mittlerem und hohem Risiko (HR: 0,65; 95% CI: 0,51–0,83), nicht aber für die Niedrigrisikogruppe (HR: 1,07; 95% CI: 0,63–1,79). Auch in Bezug auf die Ansprechraten war die Kombinationstherapie mit Nivolumab plus Cabozantinib der Sunitinib-Therapie überlegen (55,7 vs. 28,4%). Ein komplettes Ansprechen wurde bei 12,4 vs. 5,2% der Patient*innen der ITT-Population beobachtet. Die mediane Zeit bis zum Ansprechen betrug 2,8 vs. 4,2 Monate und die mediane Dauer des Ansprechens 23,1 vs. 15,2 Monate. Aufgegliedert in die Risikogruppen war die Ansprechrate für alle Risikogruppen mit 37,7% vs. 10,3% (hohes Risiko), 57,4% vs. 28,7% (mittleres Risiko) und 66,2% vs. 44,4% (niedriges Risiko) höher unter Nivolumab plus Cabozantinib verglichen mit Sunitinib.
Abb. 2: Gesamtüberleben (OS) unter Nivolumab plus Cabozantinib versus Sunitinib. Modifiziert nach Burotto M et al.3
Multidisziplinärer Ansatz bei Patient*innen mit Hirnmetastasen
Da Patient*innen mit Hirnmetastasen häufig bei klinischen Studien ausgeschlossen werden, gingen Mitglieder des International Metastatic Renal Cell Carcinoma Database Consortium (IMDC) der Frage nach, wie hoch die Inzidenz der Hirnmetastasen bei RCC-Patient*innen zu Beginn der Erstlinientherapie ist, welche Faktoren prognostisch für den Therapieerfolg und den Krankheitsverlauf sind und welche Therapien derzeit bevorzugt angewendet werden.4
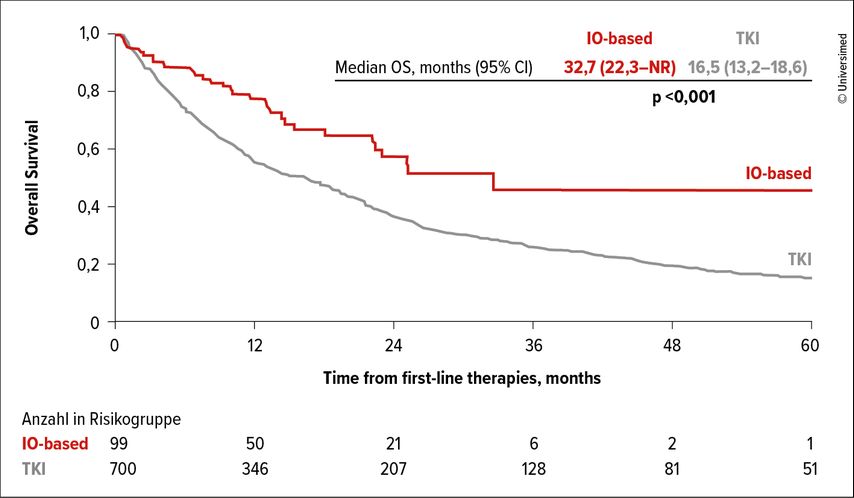
Von den auswertbaren 10224 Patient*innen des Registers, die seit 2004 aufgenommen wurden, wiesen 803 Patient*innen (7,9%) Hirnmetastasen auf. Sowohl unter IO als auch unter TKI war das OS mit median 32,7 vs. 47,2 Monate (p=0,090) bzw. 16,5 vs. 27,7 Monate (p<0,001) bei vorhandenen vs. nicht vorhandene Hirnmetastasen verkürzt. In der Kohorte der Patient*innen mit Hirnmetastasierung erhielten 99 Patient*innen eine IO-basierte Kombination, davon 81% Nivolumab plus Ipilimumab. 704 Patient*innen wurden mit einer TKI-Monotherapie behandelt, davon 76% mit Sunitinib. Ein Ansprechen auf die Erstlinientherapie wurde bei 41% der Patient*innen unter IO-basierter Therapie versus 31% unter TKI-Monotherapie gesehen, eine komplette Remission erreichten 7% versus 1% der Patient*innen. Das OS unter IO-basierter Therapie war mit median 32,7 Monaten signifikant länger verglichen mit der TKI-Monotherapie und einem medianen OS von 16,5 Monaten (p<0,001) (Abb. 3). In einer multivariaten Analyse wurde neben der Art der Erstlinientherapie (IO vs. TKI) (HR: 0,36; 95% CI: 0,21–0,61; p<0,001) auch die IMDC-Risikokategorie (HR: 0,43; 95% CI: 0,33–0,56; p<0,001) sowie die Durchführung einer stereotaktischen Operation (HR: 0,59; 95% CI: 0,44–0,79; p<0,001) oder der Neurochirurgie (HR: 0,60; 95% CI: 0,45–0,81; p<0,001) als prognostische Faktoren identifiziert. Bezüglich der chirurgischen und radiologischen Eingriffe wurden mit der stereotaktischen Operation und der Neurochirurgie längere OS-Ergebnisse verglichen mit der Ganzhirnbestrahlung oder keinem Eingriff erreicht (median 23,4 vs. 7,5 vs. 10,5 Monate). Die Therapie von Hirnmetastasen benötige einen multidisziplinären Ansatz, schlussfolgerten die Autoren.
Abb. 3: Gesamtüberleben (OS) von RCC-Patient*innen mit Hirnmetastasen unter IO-basierter versus TKI-Monotherapie. Modifiziert nach Takemura K et al.4
Quelle:
Genitourinary Cancers Symposium (ASCO GU), 16.–18. Februar 2023, San Francisco und virtuell
Literatur:
1 Hussain MH et al.: Efficacy and safety of darolutamide in combination with androgen-deprivation therapy and docetaxel by disease volume and disease risk in phase 3 ARASENS study. ASCO GU 2023, Abstr. #15 2 Clarke NW et al.: Final overall survival in PROpel: Abirateron and olaparib versus abiraterone and placebo as first-line therapy for metastatic castration-resistant prostate cancer. ASCO GU 2023, Abstr. #LBA16 3 Burotto M et al.: Nivolumab plus cabozantinib vs sunitinib for first-line treatment of advanced renal cell carcinoma: 3-year follow-up from the phase 3 CheckMate 9ER trial. ASCO GU 2023, Abstr. #603 4 Takemura K et al.: Outcomes of patients with brain metastases from renal cell carcinoma treated with first-line therapies: Results from the International Metastatic Renal Cell Carcinoma Database Consortium (IMDC). ASCO GU 2023, Abstr. #600
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...