Lymphomtherapie auf der Überholspur
Bericht:
Dr. med. Alexander Kretzschmar
Im Rahmen der 17. International Conference on Malignant Lymphoma (ICML) wurden aktuelle Fortschritte in der Behandlung von chronischer lymphatischer Leukämie (CLL) vorgestellt. Zudem wurden vielversprechende Ergebnisse für die CAR-T-Zell-Therapie bei primärem ZNS-Lymphom präsentiert. Auch im Bereich des Hodgkin-Lymphoms wurden neue Studienergebnisse berichtet, die bisherige Therapiestandards herausfordern.
BKT-Inhibitoren in der CLL-Therapie
In der Erstlinientherapie der aktiven CLL (Binet C oder Rai III–IV) wurde ein Update der SEQUOIA-Studie zu den Kohorten 1 und 2 vorgestellt. Darin erhielten Patient:innen ohne del(17p)-Mutation) ≥65 Jahre bzw. jüngere Patient:innen mit ausgeprägten Begleiterkrankungen entweder Zanubrutinib 160mg/bid oder Bendamustin 90mg plus Rituximab 375mg C1, danach 500mg C21–C6 (Kohorte 1). In Kohorte 2 erhielten Patient:innen mit del(17p)-Mutation nur Zanubrutinib. Kohorte 3 erhielt Zanubrutinib plus Venetoclax. Für Kohorte 2 zeigten sich nach 42 Monaten Follow-up ein progressionsfreies Überleben (PFS) von 79% und ein Gesamtüberleben (OS) von 90%. Zu diesen eigentlich sehr guten Daten wurden jedoch Vorbehalte bezüglich des korrekten Nachweises einer del(17p)-Mutation geäussert. In Kohorte 1 wurde nach 43,7 Monaten Follow-up für das PFS ein deutlicher Vorteil zugunsten von Zanubrutinib gemessen (Hazard-Ratio [HR]: 0,30; 95% Konfidenzintervall [KI]: 0,21–0,43).1
Ibrutinib ist bei der Erstlinientherapie der CLL und in der rezidivierten/refraktären Situation eine der empfohlenen Standardtherapien. Ghia et al. stellten hierzu einen indirekten Vergleich der drei randomisierten Phase-III-Studien RESONATE, ALPINE und ELEVATE-RR vor, in denen Ibrutinib (insgesamt n=785) mit Ofatumumab (n=195) bzw. Zanubrutinib (n=325) bzw. Acalabrutinib (n=265 bei Patient:innen mit del(11q) oder del(17p)-Mutation) verglichen wurden. Zur besseren Vergleichbarkeit wurden die drei Studienpopulationen hinsichtlich demografischer und medizinischer Charakteristika gematcht.
Das mediane Follow-up betrug 36,0 vs. 29,6 Monate (RESONATE adjustiert vs. ALPINE publiziert) und 36,1 vs. 40,9 Monate (RESONATE adjustiert vs. ELEVATE-RR publiziert). Die Auswertung ergab robuste Vorteile zugunsten von Ibrutinib beim PFS und beim Gesamtansprechen (ORR). Die 2-Jahres-PFS-Rate der Patient:innen unter Ibrutinib betrug in RESONATE (adjustiert) 81% (95% KI 74–90) und in ALPINE 66% (60–71). Das mediane PFS betrug 40,7 und 34,2 Monate (HR 0,57 [0,39–0,84]) zugunsten der RESONATE-Population (p=0,0048). Das ORR betrug 90% (86–94) und 74% (69–79) (p<0,0001). Im Vergleich zum Ibrutinib-Arm in der Studie ELEVATE-RR, der mehr Patient:innen mit genetischen Hochrisikofaktoren enthielt als in der ALPINE-Studie, hatten die Ibrutinib-Patient:innen in der RESONATE-Studie (adjustiert) eine höhere 2-Jahres-PFS-Rate: 79% (69–89) vs. 69% (64–75); der Unterschied war jedoch statistisch nicht signifikant. Das mediane PFS betrug 41,2 vs. 44,1 Monate (HR: 0,85; 0,55–1,3; p=0,46). Das ORR betrug 89% (83–95) und 80% (75–85) (p=0,0381).2
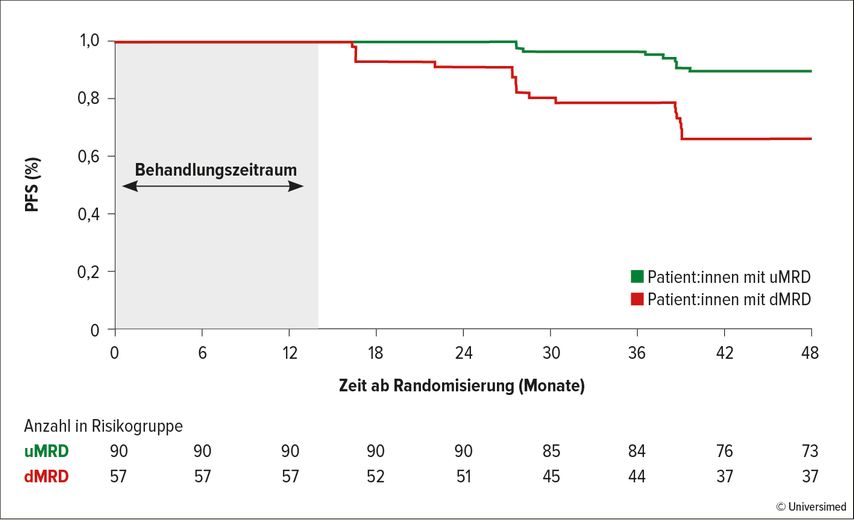
Das 4-Jahres-Update zur Erstlinientherapie mit Ibrutinib plus Venetoclax (MRD-gesteuert oder zeitlich feste Begrenzung) in der Phase-II-Studie CAPTIVATE zeigte für die Untergruppe vergleichsweise junger Patient:innen (im Mittel 59 Jahre) mit zeitlich begrenzter Therapiedauer von 15 Monaten nach median 49,8 Monaten Follow-up eine PFS-Rate von 79%, wobei die Gruppe mit del(17p)/TP53-Mutation mit 63% deutlich schlechter abschnitt. Wie bei den anderen zeitlich begrenzten Therapien mit Venetoclax profitierten vor allem Patient:innen mit nicht nachweisbarer Restaktivität im Blut (uMRD) vs. nachweisbare Restaktivität (dMRD) (Abb. 1). Erste Daten zur Rezidivtherapie mit Ibrutinib bei dieser Population zeigen laut Autor:innen ein gutes Ansprechen («best response» bzw. PFS).3
Abb. 1: Progressionsfreies Überleben: Landmarkanalyse nach MRD-Status nach Therapieende (nicht nachweisbare Restaktivität im Blut [uMRD] vs. nachweisbare Restaktivität[dMRD]) (mod. nach Ghia P.)3
CAR-T-Zellen bei ZNS-Lymphomen
Neben neuen Indikationen bei Mantelzelllymphom und rezidiviertem/refraktärem follikulärem Lymphom (r/rFL) könnten CAR-T-Zell-Therapien auch beim primären ZNS-Lymphom in Zukunft neue Massstäbe setzen. Allerdings gibt es derzeit nur einige retrospektive Studien. Eine französische Arbeitsgruppe präsentierte Real-Life-Daten aus der LOC-Datenbank. In der retrospektiven Studie wurden 25 Patient:innen (median 68 Jahre; Z.n. ≥2 Therapielinien einschliesslich HD-MTX) mit primärem ZNS-Lymphom und Rezidiv ohne systemische Beteiligung (rPCNSL). 9 Patient:innen wurden mit Axi-cel und 16 mit Tisa-cel behandelt. Die Kontrollgruppe waren rPCNSL-Patient:innen (≥3 Therapielinien), die nicht für eine Hochdosistherapie infrage kamen oder eine autologe Stammzelltransplantation (ASCT) erhalten hatten. Die CAR-T-Zellen erwiesen sich bei dieser rPCNSL-Population als hochwirksam. Das mediane Follow-up betrug 16 Monate. 60% erreichten eine Komplettremission (CR) und 20% eine partielle Remission (PR; ORR: 80%). 20% erlitten einen Progress. Das 12-Monats-PFS betrug 41%, das 12-Monats-OS (Gesamtüberleben) 58%. Allerdings sind die Daten noch unreif.4
Prognostisch günstig war das Erreichen einer Remission vor Beginn der CAR-T-Zell-Therapie. Patient:innen mit CR bzw. PR erreichten zu 77% ein rezidivfreies Überleben (RFS). Bei Patient:innen mit stabiler Erkrankung (SD) betrug das RFS nur 22% (p=0,02). Die CAR-T-Zell-Therapien schneiden beim PFS und OS signifikant besser ab als ein historisches LOC-Vergleichskollektiv (jeweils p < 0,001). Bei den Toxizitätsdaten entsprach die Rate der Zytokin-Release-Syndrome (CRS) derjenigen bei systemischen Lymphomen. Immuneffektorzell-assoziierte Neurotoxizitätssyndrome (ICANS) traten bei etwa zwei Dritteln der Patient:innen auf (Grad I–II: 48%; Grad III–IV: 20%; Todesfälle: 4%), bei 12% dauerten die neurologischen Symptome ≥3 Monate. Die ICANS-Rate der beiden CAR-T-Zell-Therapien war vergleichbar (Axi-cel: 22%; Tisa-cel: 19%).4
Neue Standards beim Hodgkin-Lymphom?
Ein weiterer Schwerpunkt beim ICML 2023 lag auf Neuerungen in der Therapie des Hodgkin-Lymphoms (HL). Hervorzuheben sind die drei neuen Studien ABVDDD-DI, ICI-AVD, und BrECADD zur Erstlinientherapie des fortgeschrittenen HL, mit denen auch die bisherigen Standards herausgefordert wurden. In der italienischen ABVDDD-DI-Studie erwies sich die dosisintensivierte Frontline-ABVD-Therapie als überlegen gegenüber einem PET-adaptierten ABVD. Die Studie unterstützt damit das Konzept einer frühen intensiven Therapie des fortgeschrittenen HL.5
Bereits auf dem ASCO 2023 als neuer Standard gefeiert wurde die Studie SWOG S1826. In dem Head-to-head-Vergleich von Nivolumab vs. Brentuximab Vedotin, beide in Kombination mit AVD als Erstlinientherapie, wurde der primäre Endpunkt, eine signifikante Verlängerung des PFS bei Patient:innen mit fortgeschrittenem klassischem Hodgkin-Lymphom (cHL), erreicht (1-Jahres-PFS: N-AVD: 945; BV-AVD: 86%; HR 0,48; 0,27–0,87). Das Sicherheitsprofil von N-AVD wurde gegenüber BV-AVD als günstig beurteilt.6
In der HD21-Studie der Deutschen Hodgkin Studiengruppe (GHSG) wurde der chemotherapeutische Standard (BEACOPP) beim fortgeschrittenen Hodgkin-Lymphom mit einer Alternativbehandlung (BrECADD) verglichen. Die Studie erreichte vorzeitig ihren primären Endpunkt der Nichtunterlegenheit. Auch die 3-Jahres PFS-Rate war unter BrECADD höher.7
Quelle:
17. International Conference on Malignant Lymphoma (ICML), 13.–17. Juni 2023, Lugano
Literatur:
1 Shadman M: Zanubrutinib (zanu) vs bendamustine + rituximab (BR) in patients (pts) with treatment-naïve (TN) CLL/SLL: extended follow-up of the SEQUOIA study. ICML 2023; Session Long term results of CLL trials 2 Ghia P et al.: Ibrutinib (Ibr) for treatment of relapsed-refractory (R/R) chronic lymphocytic leukemia (CLL): a matching-adjusted indirect comparison of 3 randomized phase 3 trials. ICML 2023; Abstr.#342 3 Ghia P: Fixed-duration ibrutinib + venetoclax in chronic lymphocytic leukemia (CLL)/small lymphocytic lymphoma (SLL): 4-y follow-up from the FD cohort of the phase 2 CAPTIVATE study. ICML 2023; Late Breaking Abstracts 4 Choquet S et al.: CAR-T cells radically modify the management of relapsed/refractory primary cerebral lymphomas. Real life results of the French LOC Network. ICML 2023; Abstr. #016 5 Pinto A: Frontline intensified ABVD demonstrates superior efficacy than PET-adapted ABVD in advanced Hodgkin Lymphoma: the FIL-Rouge Phase 3 Trial by the Fondazione Italiana Linfomi. ICML 2023; Plenary Session 6 Herrera AF: Nivolumab(N)-AVD improves progression-free survival compared to brentuximab vedotin (bv)-avd in advanced stage (as) classic Hodgkin Lymphoma (HL): Results of SWOG S1826. ICML 2023; Plenary Session 7 Borchmann P: BrECADD is non-inferior to eBEACOPP in patients with advanced stage classical Hodgkin Lymphoma: efficacy results of the GHSG phase III HD21 trial. ICML 2023; Session Immunotherapy for aggressive lymphomas
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...