Intraoperative Diagnostik in der Pankreaschirurgie: Beurteilung und Bedeutung des Resektionsstatus
Institut für Pathologie
Heinrich-Heine-Universität und Universitätsklinikum Düsseldorf
Noch immer stellt die vollständige Resektion die einzige Chance auf Heilung für Patienten mit einem duktalen Adenokarzinom des Pankreas dar. Eine besondere Bedeutung kommt hierbei der Beurteilung der Resektionsränder im Rahmen der intraoperativen Schnellschnittdiagnostik zu, die eine praktikable und zuverlässige Methode darstellt. Um eine Schnellschnittdiagnose richtig einordnen zu können, müssen Möglichkeiten und Limitationen der Untersuchung reflektiert werden.
Keypoints
-
Die intraoperative Diagnostik in der Pankreaschirurgie betrifft im Wesentlichen die Beurteilung der „echten“ Resektionsränder (Pankreasabsetzungsrand, Gallengangabsetzungsrand), mit dem Ziel, eine R0-
Resektion zu ermöglichen. -
Die intraoperative Beurteilung der Resektionsränder in der Pankreaschirurgie ist eine sehr zuverlässige Methode.
-
Mögliche Fallstricke beinhalten chronisch-entzündliche Veränderungen im Bereich des Pankreasresektionsrandes sowie die Beurteilung intraduktaler Proliferate im Pankreasresektionsrand (IPMN, PanIN).
-
In der Zukunft könnten Methoden zur Detektion molekularer Veränderungen, wie Digital-droplet-PCR, Massenspektrometrie-Imaging oder bioelektronische Sensoren, in die intraoperative Diagnostik mit eingebunden werden.
Praktische Durchführung
Intraoperative Diagnostik (Schnellschnittdiagnostik) kann prinzipiell im pathologischen Institut oder direkt im Operationssaal durchgeführt werden. Bei einer Durchführung im OP-Saal selbst kann der Operateur den befundenden Pathologen vor Ort bei der Präparateorientierung unterstützen, was bei komplexen Präparaten hilfreich sein kann. Zudem entfällt der Zeitverlust durch den Probentransport vom OP-Saal ins pathologische Institut. Andererseits ist diese Variante mit höheren Kosten verbunden (Equipment für den Schnellschnitt im OP-Bereich, eigens im OP-Bereich tätiger Pathologe) und das Hinzuziehen eines zweiten Pathologen in schwierigen Fällen ist nicht ohne Weiteres möglich. Erfolgt die Schnellschnittdiagnostik im pathologischen Institut, ist dies kostengünstiger und eine Zweitmeinung kann unkompliziert eingeholt werden. Allerdings entsteht durch den Probentransport ein geringer Zeitverlust.
In der Pankreaschirurgie ist das Ziel der Schnellschnittdiagnostik im Wesentlichen die Beurteilung der Resektionsränder. Diese lassen sich in „transection margins“ (Gallengangabsetzung, Pankreasparenchymabsetzung, selten Gefäßabsetzungen) und „circumferential resection margins“ (CRM, peripankreatische Weichgewebsflächen) einteilen. Die CRM werden hinsichtlich ihrer Nomenklatur und Bedeutung kontrovers diskutiert; in europäischen Zentren beinhalten diese meist die ventrale und dorsale Pankreasfläche sowie die mediale Gefäßfurche. Im Schnellschnitt spielen allerdings lediglich die „transection margins“ eine Rolle, welche beispielsweise als Flachschnitte perpendikulär zur Längsachse des Pankreas-/Gallengangs im Schnellschnitt aufgearbeitet werden können. Die Beurteilung der CRM-Flächen wäre im Rahmen des Schnellschnitts zum einen zu aufwendig, zum anderen kann hier bei einer R1-Situation meist keine Nachresektion erfolgen. Die CRM sollten daher anhand eines standardisierten Schemas im Rahmen des definitiven Präparatezuschnitts aufgearbeitet werden.1–3
Indikation
Ziel der Schnellschnittunterschung der Resektionränder ist es, eine R1-Situation intraoperativ zu erkennen, um eine direkte Nachresektion zu ermöglichen, durch die dann eine R0-Situation erreicht werden kann. Der hierdurch tatsächlich erreichte Überlebensvorteil ist Gegenstand kontroverser Diskussion. In einer multizentrischen Studie zeigten Patienten, bei denen eine R0-Situation an der Pankreasparenchymabsetzung erst durch eine Nachresektion (nach initialer R1-Situation in der intraoperativen Schnellschnittdiagnostik) erreicht wurde, ein ähnlich schlechtes Überleben wie Patienten mit definitiver R1-Situation, während Patienten, bei denen bereits im ersten Schnellschnitt eine R0-Situation vorlag, ein deutlich längeres Überleben zeigten.4 Dem widersprechend wurde in einer neueren Studie ein signifikant längeres Überleben von Patienten mit R0-Situation nach Nachresektion im Vergleich zu Patienten mit definitiver R1-Situation gezeigt.5 Solche Unterschiede können in der mangelnden Standardisierung der Aufarbeitung und Befundung begründet sein, beispielsweise der Definition des R0-Status (R0-Status bereits bei Abwesenheit von Tumorzellen im direkten Resektionsrand vs. R0-Status nur bei Abstand der Tumorzellen von mindestens 1mm zum Resektionsrand).1–3,6 In Hinblick auf die Tumorbiologie insbesondere maligner Tumoren sollte eine R0-Situation Ziel jeder onkologischen Resektion mit kurativem Hintergrund sein.
Qualität
Die Qualität der Schnellschnittdiagnostik ist im Allgemeinen und in der Pankreaschirurgie sehr hoch.
In der Pankreaskarzinomchirurgie sind falsch negative Ergebnisse (nicht erkannte R1-Situation) in der intraoperativen Diagnostik sehr selten und machen deutlich unter 5% aus, wobei falsch positive Ergebnisse sogar in weniger als 1% der Fälle vorliegen.4,7
Auch für intraduktale papillär-muzinöse Neoplasien (IPMN), Vorläuferläsionen des invasiven Pankreaskarzinoms, konnte in einer großen Fallserie gezeigt werden, dass intraoperative Diagnosen in 94% der Fälle am Paraffinmaterial bestätigt werden können.8
Besondere Herausforderungen und Fallstricke
Die hohe Treffgenauigkeit der Methode sollte nicht darüber hinwegtäuschen, dass die intraoperative Untersuchung des Pankreasschnittrandes auch für erfahrene Pathologen eine Herausforderung darstellen kann.
Häufig existieren im Bereich des Resektionsrandes obstruktiv-entzündliche Veränderungen mit Atrophie des azinären Pankreasparenchyms. Die azinäre Atrophie kann zur sogenannten azinär-duktalen Metaplasie (ADM) mit Ausbildung sogenannter tubulärer Komplexe führen. Diese reaktiven duktulären Proliferate können Karzinomdrüsen imitieren. Hilfreich in der Abgrenzung zum Karzinom ist zum einen die in der Übersichtvergrößerung erkennbare erhaltene Läppchenarchitektur, zum anderen sind es die weniger ausgeprägte Eosinophilie des Zytoplasmas und das Fehlen von Mitosen (Abb.1).
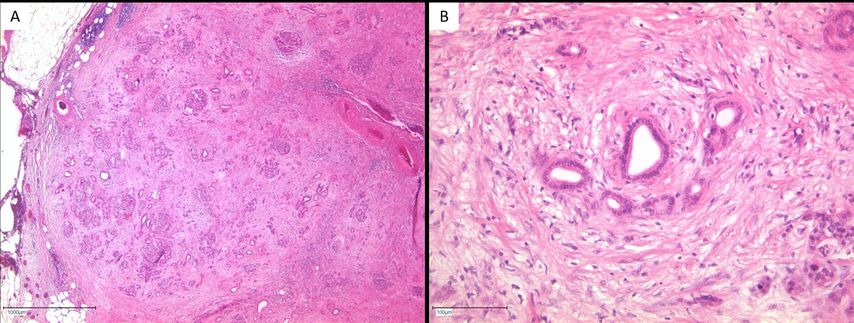
Abb. 1: (A) Im Resektionsrand eines Pankreasresektates (Operation bei Verdacht auf Pankreaskopfkarzinom) sind intraoperativ irreguläre tubuläre Strukturen eingebettet in kollagenes Bindegewebe zu sehen (HE, 25 x). In der Übersichtsvergrößerung ist jedoch eine erhaltene organoide Läppchenstruktur des atrophischen Parenchyms erkennbar. (B) In der höheren Vergrößerung sieht man weder eine distinkte Eosinophilie des Zytoplasmas noch sieht man Mitosen (HE, 200 x). Somit handelt es sich hier um tubuläre Komplexe im Rahmen entzündlich-atrophischer Veränderungen und nicht um Karzinomdrüsen im Resektionsrand
Eine weitere Herausforderung stellen Vorläuferläsionen des Pankreaskarzinoms dar. IPMN (intraduktale papillär-muzinöse Neoplasien) sind üblicherweise über 1cm große intraduktale Neoplasien mit papillär aufgeworfenem muzinösem Epithel und können in verschiedene Kategorien unterteilt werden. Man unterscheidet in der Bildgebung bzw. makroskopisch einen Hauptgang- und einen Seitengangtyp sowie mikroskopisch Low-Grade- und High-Grade-IPMN sowie je nach Morphologie und immunhistochemischem Markerprofil verschiedene histologische Subtypen. Hauptgang-IPMN sind im Vergleich zu Seitengang-IPMN weitaus öfter High-Grade-Läsionen mit/ohne invasivem Karzinom und sind bei positivem Schnittrand in der intraoperativen Diagnostik mit einer höheren Rezidivrate (25% vs. 14%) sowie einem kürzerem Gesamtüberleben verbunden.9 Seitengang-IPMN hingegen sind bei Diagnosestellung meist Low-Grade-Läsionen, rezidivieren insgesamt seltener und können multifokal auftreten,10 weshalb dem Schnellschnitt bei reinen Seitengang-IPMN keine große Bedeutung zukommt.
Neben IPMN sind auch PanIN (pankreatische intraepitheliale Neoplasien) intraepitheliale Neoplasien des Pankreas. PanIN sind per definitionem kleiner als 0,5cm und können ebenfalls in Low-Grade- und High-Grade-Läsionen eingeteilt werden. Da das Progressionsrisiko von Low-Grade-PanIN extrem niedrig ist, können diese in der Schnellschnittdiagnostik vernachlässigt werden.11 High-Grade-PanIN werden hinsichtlich ihres Progressionsrisikos und ihrer prognostischen Bedeutung kontrovers diskutiert12,13 und sollten im Schnellschnitt mitgeteilt werden.
PanIN sind rein anhand ihrer Epithelmorphologie nicht von Ausläufern der IPMN vom gastrischen histologischen Subtyp zu unterscheiden (Abb. 2).11,14 Bei Nachweis von muzinösen intraepithelialen Proliferaten mit gastrischer Epitheldifferenzierung kann daher im Schnellschnitt die Formulierung „intraduktale muzinöse Zellproliferate, low grade/high grade“ gewählt werden und die abschließende Beurteilung am Hauptpräparat erfolgen.15 Hilfreich ist insbesondere in solchen Fällen das frühzeitige intraoperative Mitteilen der klinisch-radiologischen Verdachtsdiagnose an den Pathologen.
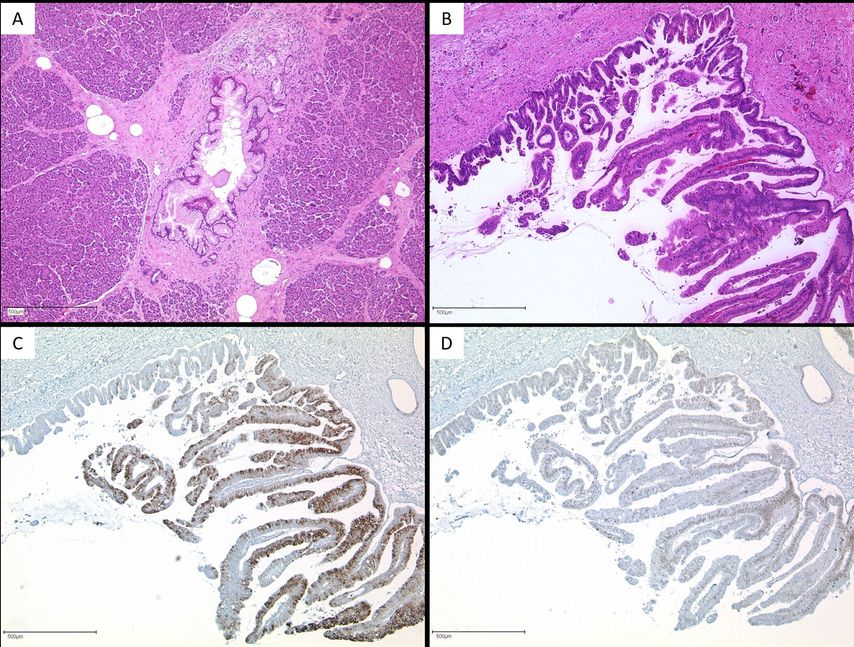
Abb. 2:(A) Im Resektionsrand eines Pankreasresektates (Operation bei Verdacht auf IPMN) ist intraoperativ eine muzinöse Epithelproliferation mit geringgradigen Atypien nachweisbar (HE, 50 x). Hier könnte es sich um eine PanIN low grade oder um Ausläufer einer IPMN low grade vom gastrischen Typ handeln. (B) Im Resektionspräparat kann dann eine IPMN mit villösen Papillen und hochgradigen Kernatypien nachgewiesen werden (HE, 50 x). Immunhistochemisch exprimiert diese IPMN MUC2 (C, 50 x) und CDX2 (D, 50 x). Es handelt sich demnach um eine IPMN high grade vom intestinalen Typ. Die Proliferation im Resektionsrand wird demnach nicht als Ausläufer der IPMN, sondern als PanIN low grade klassifiziert
Entwicklungen der Zukunft
Mittlerweile werden in Studien zahlreiche mögliche Alternativen bzw. Ergänzungen zur „konventionellen“ Schnellschnittdiagnostik untersucht.
Beispielsweise konnte gezeigt werden, dass die Untersuchung des KRAS-Mutationsstatus von Pankreasresektionsrändern, ermittelt mittels ultrasensitiver Digital-droplet-PCR von Gewebeabstrichen der Resektionsränder, eine ähnliche prädiktive Qualität bezogen auf das rezidivfreie Überleben aufweist wie die histopathologische Untersuchung der Resektionsränder.16
Auch andere hochsensitive Methoden zur Detektion relevanter molekularer Informationen, beispielsweise basierend auf Massenspektrometrie-Imaging oder bio-elektronischen Sensoren,17 sind derzeit in der Entwicklung und könnten in der Zukunft für derartige Fragestellungen genutzt werden.
Literatur:
1 Esposito I et al.: Most pancreatic cancer resections are R1 resections. Ann Surg Oncol 2008; 15: 1651-60 2 Schlitter AM, Esposito I: Definition of microscopic tumor clearance (R0) in pancreatic cancer resections. Cancers (Basel) 2010; 2: 2001-10 3 Verbeke CS: Resection margins in pancreatic cancer. Surg Clin North Am 2013; 93: 647-62 4 Kooby DA et al.: Value of intraoperative neck margin analysis during whipple for pancreatic adenocarcinoma: a multicenter analysis of 1399 patients. Ann Surg 2014; 260: 494-501; discussion 501-3 5 Zhang B et al.: Revision of pancreatic neck margins based on intraoperative frozen section analysis is associated with improved survival in patients undergoing pancreatectomy for ductal adenocarcinoma. Ann Surg 2019; doi: 10.1097/SLA. 0000000000003503 6 S3-Leitlinie Exokrines Pankreaskarzinom, Langversion 1.0. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF), 2013 7 Hermanek P: Intraoperative Diagnostik des Pankreascarcinoms. Langenbecks Arch Chir 1983; 359: 289-99 8 Couvelard A et al.: Frozen sectioning of the pancreatic cut surface during resection of intraductal papillary mucinous neoplasms of the pancreas is useful and reliable: a prospective evaluation. Ann Surg 2005; 242: 774-80 9 Marchegiani G et al.: Patterns of recurrence after resection of Ipmn: who, when, and how? Ann Surg 2015; 262: 1108-14 10 Kloppel G et al.: Intraductal neoplasms of the pancreas. Semin Diagn Pathol 2014; 31: 452-66 11 Basturk O et al: A revised classification system and recommendations from the Baltimore Consensus Meeting for Neoplastic Precursor Lesions in the Pancreas. Am J Surg Pathol 2015; 39: 1730-41 12 Konstantinidis IT et al.: Incidentally discovered pancreatic intraepithelial neoplasia: what is its clinical significance? Ann Surg Oncol 2013; 20: 3643-7 13 Matthaei H et al.: Presence of pancreatic intraepithelial neoplasia in the pancreatic transection margin does not influence outcome in patients with R0 resected pancreatic cancer. Ann Surg Oncol 2011; 18: 3493-9 14 Hruban RH et al.: An illustrated consensus on the cclassification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol 2004; 28: 977-87 15 Adsay V et al.: Pathologic evaluation and reporting of intraductal papillary mucinous neoplasms of the pancreas and other tumoral intraepithelial neoplasms of pancreatobiliary Tract: Recommendations of Verona Consensus Meeting. Ann Surg 2016; 263: 162-77 16 Kim SJ et al.: Prediction of recurrence with Kras mutational burden using ultrasensitive digital polymerase chain reaction of radial resection margin of resected pancreatic ductal adenocarcinoma. Pancreas 2019; 48: 400-11 17 Macchia E al.: Single-molecule detection with a millimetre-sized transistor. Nat Commun 2018; 9: 3223
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...