Hochrangige Neuigkeiten zum Umgang mit dem Lungenkarzinom
Leiter der pneumo-onkologischen <br>Ambulanz und Tagesklinik<br>Abteilung für Innere Medizin und Pneumologie<br>Karl-Landsteiner-Institut für Lungenforschung und<br>pneumologische Onkologie<br>Klinik Floridsdorf, Wien<br>E-Mail: maximilian.hochmair@gesundheitsverbund.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auch im virtuellen Format hat die Jahresversammlung der European Society of Medical Oncology (ESMO) viele für die Therapie von Lungenkarzinompatienten wegweisende Studien bereitgehalten. Im Folgenden eine Übersicht über die wichtigsten – im Wesentlichen Vorträge aus den Oral Sessions.
Lungenkarzinom im frühen Stadium
Zu Lungenkarzinomen im frühen Stadium wurden in der Plenarsitzung zwei wichtige Themen adressiert: die postoperative Bestrahlung bei pN2-Patienten und die Erhaltungstherapie mit Osimertinib. Auch zum frühen Stadium wurden beim ESMO-Meeting die Ergebnisse der Phase-II-Studie PRINCEPS und die 4-Jahres-Daten der Phase-III-Studie PACIFIC gezeigt.
PORT bei pN2 nicht sinnvoll
Bezüglich der postoperativen Bestrahlung besteht die wichtige Fragestellung, ob in einer postoperativen pN2-Situation ohne vorherige Strahlentherapie eine postoperative Strahlentherapie (PORT) – wie sie derzeit häufig auf individueller Basis durchgeführt wird – von Nutzen ist. Um dieses Vorgehen prospektiv zu untersuchen, wurde die Lung-ART-Studie durchgeführt, in der Patienten mit pN2-Situation nach Operation randomisiert eine postoperative Bestrahlung oder keine Bestrahlung erhielten.1 Insgesamt wurden 501 Patienten eingeschlossen. Die beiden Studienarme wurden anhand der histologischen Subgruppen und des Tumorstadiums stratifiziert und wiesen eine gut vergleichbare Patientencharakteristik auf. Die typischerweise durchgeführte Operation in etwa 80% der Fälle war eine Lobektomie. Der primäre Endpunkt, das krankheitsfreie Überleben, war nicht signifikant unterschiedlich, aber es wurde ein Trend mit Vorteil der postoperativen Radiotherapie gesehen. Ebenfalls einen Vorteil der PORT gab es bezüglich eines weniger häufig auftretenden mediastinalen Rückfalls (25,0% vs. 46,1%). In der PORT-Gruppe wurden allerdings häufiger Todesfälle (14,6% vs. 5,3%) beobachtet. Bezüglich des Gesamtüberlebens (OS) wurde mit der Studie ein klares Zeichen gesetzt, da in der PORT-Gruppe kein Nutzen verzeichnet werden konnte: Nach 3 Jahren lebten 66,5% der Patienten im PORT-Arm versus 68,5% der Patienten im Kontrollarm. Daraus resultiert die klare Empfehlung, in der pN2-Situation keine Bestrahlung mehr durchzuführen. Cave! Dies betrifft nicht die Patienten, bei denen eine R1-Resektion durchgeführt wurde, sondern nur Patienten mit postoperativer pN2-Situation.
Osimertinib im adjuvanten Setting bei EGFR-Mutation
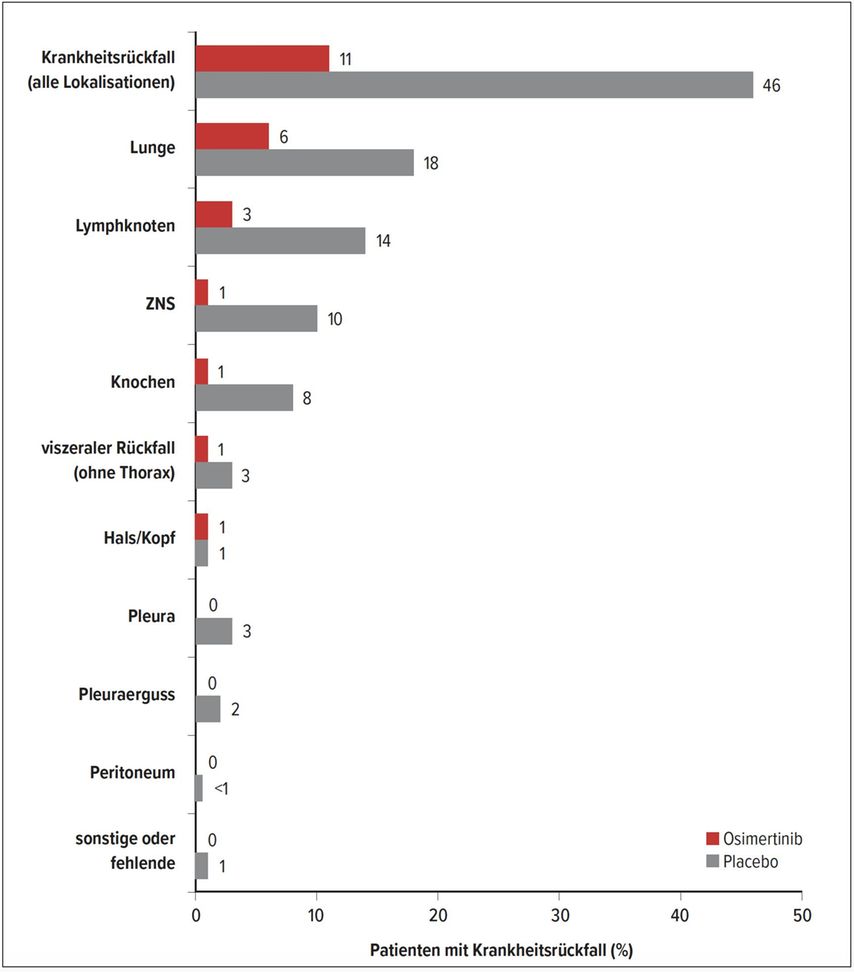
In der ADAURA-Studie erhielten Patienten mit EGFR-mutiertem Lungenkarzinom nach Operation optional eine Chemotherapie und danach randomisiert Osimertinib (n=339) oder Placebo (n=343). Ausgenommen waren Patienten mit Strahlentherapie, also Patienten mit PORT, die es entsprechend der oben beschriebenen Lung-ART-Studie in Zukunft nicht mehr geben sollte. Beim ASCO-Meeting 2020 wurden bei Patienten im Stadium II und IIIA klar positive Daten für den primären Endpunkt, das krankheitsfreie Überleben, mit einer Hazard-Ratio von 0,17 gezeigt. Beim ESMO-Meeting wurden die Ergebnisse um die interessante Auswertung des Rückfallmusters erweitert.2 Typischerweise kam es bei den 11% der Patienten mit Rückfall unter Osimertinib eher zu einem lokalen Progress (38%) als zu Fernmetastasen (62%). Im Placeboarm waren 48% der Patienten progredient, wobei häufiger Fernmetasten (61%) als lokale Rezidive (39%) auftraten. Es wurde in der Auswertung bestätigt, dass Osimertinib gut hirngängig ist: Ein Rezidiv wurde selten im Hirn beobachtet (1%) und damit der prophylaktische Effekt bezüglich der Entwicklung von Hirnläsionen gezeigt (Abb. 1).
Messung des Ansprechens nach neoadjuvanter Immuntherapie
In der Studie PRINCEPS wurden 30 Patienten mit Atezolizumab behandelt und 4 Wochen später operiert.3 Die Patienten wurden mit Blutabnahme, Rebiopsie durch die Operation und PET-CT bzw. CT-Monitoring sehr gut kontrolliert. In der Patientencharakteristik zeigte sich das klassische für eine Operation geeignete Patientenkollektiv. Die Behandlung mit Atezolizumab wurde gut vertragen und es konnten keine neuen Sicherheitssignale identifiziert werden. Laut RECIST-1.1-Kriterien sprachen einige der Patienten auf die einzelne Atezolizumab-Gabe gut an. Schaut man sich hingegen das pathologische Ansprechen an, so wurde ein weitaus deutlicheres Ansprechen verglichen mit dem RECIST-Ansprechen gesehen. Beim metabolischen Ansprechen mittels PET/CT war das Bild konträr, mit wenigen Remissionen. Korrelationen zwischen pathologischem und RECIST-Ansprechen oder pathologischem und metabolischem Ansprechen waren nicht gegeben. Eine wichtige Frage beim Re-Staging nach der Induktion mit einer Immuntherapie ist somit, welches Verfahren nun als geeignetes Werkzeug verwendet werden sollte. Was in der Studienauswertung bestätigt werden konnte, ist eine gute Korrelation zwischen PD-L1 und Immuntherapie im höheren PD-L1-Bereich.
4-Jahres-Update der PACIFIC-Studie
Ebenfalls gezeigt wurde das 4-Jahres-Update der PACIFIC-Studie, in der die Patienten nach postoperativer Chemoradiotherapie, im günstigsten Fall innerhalb der ersten zwei Wochen, Durvalumab oder Placebo erhalten hatten. Die Daten erinnern daran, wie stark Durvalumab nach der simultanen Chemoradiotherapie wirkt.4 Die Wirksamkeit ist auch nach 4 Jahren noch klar gegeben, mit einer Hazard-Ratio von 0,71 (Abb. 2). Für Patienten mit nicht resezierbarem Stadium-III-NSCLC bei Progressionsfreiheit nach Radiochemotherapie also eine klare Empfehlung, den PACIFIC-Ergebnissen mit der Durvalumab-Gabe zu folgen.
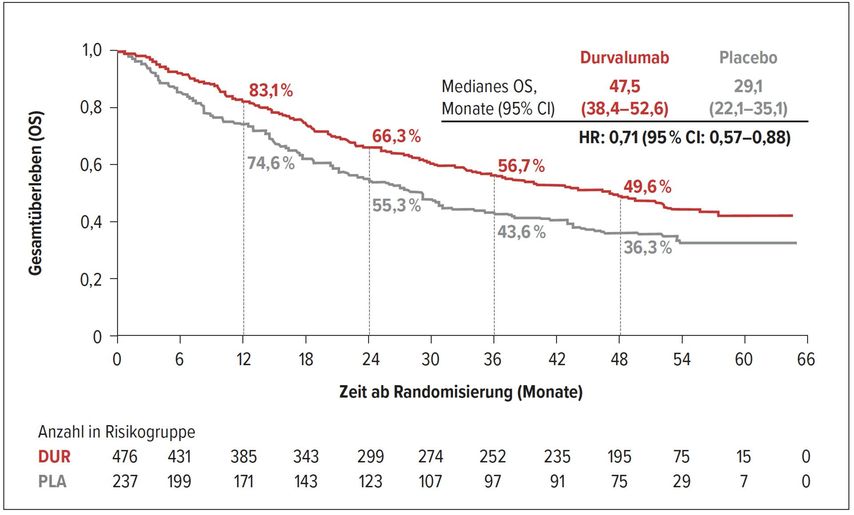
Abb. 2: Gesamtüberleben unter Therapie mit Durvalumab versus Placebo (nach Faivre-Finn C et al.)4
Zielgerichtete Therapien
Im Bereich der zielgerichteten Therapien wurden wichtige Studien zu neuen Substanzen, neuen Kombinationen und auch zu neuen Zielstrukturen gezeigt. Es ist zu erwarten, dass zukünftig weitere Therapien für selektierte Patientengruppen zur Verfügung stehen werden.
Lorlatinib vs. Crizotinib bei ALK-positivem NSCLC
Die sicherlich wichtigste in der ESMO-Plenarsitzung zum Themenkomplex der zielgerichteten Therapien präsentierte Studie ist die CROWN-Studie.5 Patienten mit einer ALK-Translokation wurden randomisiert mit Lorlatinib (1x täglich) oder Crizotinib (2x täglich) behandelt. Ein Vorteil der Wahl von Crizotinib als Kontrolle ist die leichtere Vergleichbarkeit mit anderen Erstlinienstudien – bei fehlendem Head-to-Head-Vergleich. In der CROWN-Studie war ein Cross-over nicht erlaubt, wodurch die Studie die Frage nach einer besseren Sequenz nicht beantworten kann. Es konnte aber eindrücklich gezeigt werden, dass Lorlatinib dem Crizotinib in der ersten Therapielinie überlegen ist. Bei den eingeschlossenen Patienten handelte es sich um typische ALK-positive Patienten. Ein Viertel der Patienten wies Hirnmetastasen auf. Der primäre Endpunkt (progressionsfreies Überleben) wurde, mit einer beeindruckenden Hazard Ratio von 0,28 in der Gesamtgruppe, sehr klar zugunsten von Lorlatinib erreicht (Abb. 3). Die Auswertung entsprechend den Prüfärzten resultierte sogar in einer Hazard-Ratio von 0,21. Im Vergleich mit anderen Erstlinientherapien setzt die CROWN-Studie ein klares Zeichen für Lorlatinib. Alle Subgruppen profitierten. Mit regelmäßigen Schädel-MRTs wurde auch der Vorteil in Bezug auf die Zeit bis zum intrakraniellen Progress schön herausgearbeitet. Es wurde gezeigt, dass die Hirndurchgängigkeit gegeben ist und der Progress auch im Hirn verhindert wird. Im Gesamtüberleben wurde eine Tendenz des Vorteils für Lorlatinib beobachtet, reifere Daten sind für eine Aussage aber sicherlich noch abzuwarten. Bezüglich der Nebenwirkungen wurden keine Überraschungen berichtet. Im Nebenwirkungsprofil sind Ödeme, Lipidämie und auch kognitive Effekte unter Lorlatinib zu sehen. In der Analyse der Lebensqualität wurde eine Überlegenheit für Lorlatinib gezeigt.
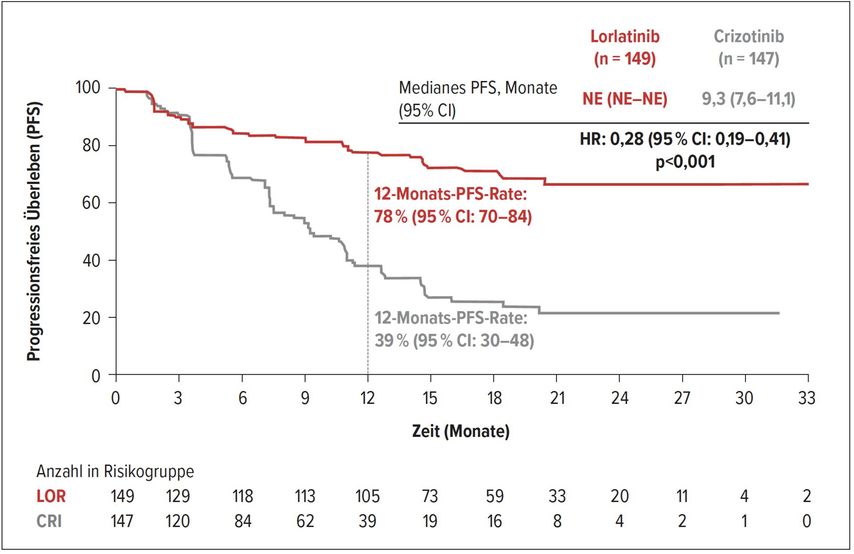
Abb. 3: Progressionsfreies Überleben unter Therapie mit Lorlatinib versus Crizotinib (nach Solomon B et al.)5
Sotorasib bei KRASG12C-Mutation
Zur KRAS-Mutation wurden beim Lungenkarzinom lange keine erfolgreichen Daten gesehen. Nun wurde beim ESMO-Meeting die Phase-I-Studie CodeBreaK 100 zur Substanz AMG 510, Sotorasib, bei Patienten mit fortgeschrittenem NSCLC und KRAS-Punktmutation G12C vorgestellt.6 Etwa 13% der NSCLC-Patienten weisen besagte Punktmutation auf. Sotorasib blockiert interzellulär selektiv den KRASG12C-Rezeptor. In der Dosisfindungsstudie wurden insgesamt 59 Patienten eingeschlossen und 34 Patienten mit der höchsten Dosierung (960mg), die für die weitere Entwicklung gewählt wurde, behandelt. Sotorasib wurde generell gut vertragen, mit Grad-3-Nebenwirkungen bei wenigen Patienten (16,9%) und selten auftretenden Grad-4-Nebenwirkungen (1,7%). Im Nebenwirkungsprofil fielen insbesondere gastrointestinale Nebenwirkungen auf, wie Durchfall, Übelkeit und Leberwertanstieg. Eine Krankheitskontrolle wurde bei um die 90% der Patienten beobachtet, ein Ansprechen bei einem Drittel der Patienten. Das PFS lag bei 6,3 Monaten. Eine Wirksamkeit wurde auch dann gesehen, wenn neben der KRAS-Mutation auch andere Mutationen nachgewiesen werden konnten. Dies sind starke Daten aus einer erstmalig bei KRAS-Mutation durchgeführten Studie, die uns den Einsatz des KRASG12C-Blockers bei den selektierten Patienten erlaubt. In welcher Therapielinie Sotorasib letztendlich optimal eingesetzt werden wird, bleibt in weiteren Studien mit mehr Patienten zu untersuchen.
EGFR- + MET-Blockade mit Amivantamab/Lazertinib
Eine weitere interessante Studie, die Phase-I-Studie CHRYSALIS, untersuchte einen EGFR-MET-Antikörper (Amivantamab) in Kombination mit einem EGFR-TKI der dritten Generation (Lazertinib).7 Eingeschlossen wurden 91 Patienten entweder in der ersten Therapielinie oder nach Versagen von Osimertinib. Die Verträglichkeit war gut, mit den typischen EGFR- und MET-Inhibitor-assoziierten Nebenwirkungen. Bei den Osimertinib-resistenten Patienten wurde ein Ansprechen bei 36% und eine Krankheitskontrolle bei 60% der Patienten gesehen. Patienten in der ersten Therapielinie sprachen zu 100% auf die Kombinationstherapie an. Hier zeichnet sich also ab, dass wir demnächst über eine Therapie nach Osimertinib-Versagen verfügen.
Studien zur Kombination von Anti-EGFR- und Anti-VEGF-Therapie
Ebenfalls interessant ist eine Studie, in der die Kombination Osimertinib plus Bevacizumab bei EGFR-mutierten NSCLC-Patienten betrachtet wurde.8 Das etwas enttäuschende Ergebnis der WJOG8715L-Studie zeigt keinen Vorteil durch die zusätzliche Bevacizumab-Gabe (HR: 1,44). Die Kombination wird wahrscheinlich nicht weiterverfolgt werden.
Die Kombination von Apatinib plus Gefitinib versus Gefitinib wurde in der ACTIVE-Studie in der Erstlinientherapie bei EGFR-mutierten NSCLC-Patienten untersucht.9 Auch wenn heute Gefitinib in der Erstlinie eher nicht mehr zum Einsatz kommt, so konnte in dieser Studie zumindest ein Vorteil der kombinierten Therapie mit einer Hazard-Ratio von 0,71 gezeigt werden. Dass Apatinib der stärkere VEGFR2-Rezeptor-Inhibitor im Vergleich zu Ramucirumab ist, lässt sich ob desFehlens eines Head-to-Head-Vergleichs anhand der vorgestellten Daten nur vermuten. Die Verträglichkeit war prinzipiell gut.
Real-World-Daten aus Europa zu EGFR-Testung
Dazu passend noch die REFLECT-Studie, die retrospektiv Daten von Patienten ausgewertet hat, die EGFR-Inhibitoren der ersten oder zweiten Generation gefolgt von Osimertinib erhalten haben.10 Die Testung auf eine T790M-Mutation fand bei den europäischen Patienten im Rezidiv nach EGFR-TKI-Therapie nur in 71% der Fälle statt. Bei den getesteten Patienten wiesen nahezu 60% eine EGFRT790M-Mutation auf, von denen aber wiederum nur 66% eine Osimertinib-Therapie erhielten. Die Analyse beantwortet die Sequenzfrage sicher nicht, gibt aber einen Überblick über die derzeitige Therapiesituation in Europa. Österreich mit guten Möglichkeiten zur Testung und Therapie steht sicherlich besser da als der europäische Durchschnitt.
Kleinzelliges Lungenkarzinom
Auch für die Therapie des kleinzelligen Lungenkarzinoms sind in letzter Zeit mehr Therapieoptionen verfügbar geworden. Insbesondere die Behandlung mit Immuntherapien hat sich für einen Teil der Patienten als erfolgreich erwiesen. Nun wird nach Biomarkern geforscht, die eine Verbesserung der Patientenselektion ermöglichen.
Seit Ende August ist Durvalumab plus Chemotherapie (Etoposid plus Platin) zur Behandlung von Patienten mit fortgeschrittenem kleinzelligem Lungenkarzinom (ESSCLC) auf Basis der CASPIAN-Studie zugelassen. Bereits beim ASCO 2020 wurde ein Update der CASPIAN-Daten präsentiert, das einen OS-Vorteil für die Durvalumab-haltige Kombination mit einer Hazard-Ratio von 0,73 zeigte. Beim ESMO-Meeting wurde nun eine Auswertung der CASPIAN-Studie zur Tumorlast in Gewebeproben (tTMB) präsentiert.11 Es wurde für die Tripelkombination kein Nutzen der Bestimmung des tTMB zur Patientenselektion gesehen.
Auch für die IMpower133-Studie gab es ein Update zur zusätzlichen Gabe von Atezolizumab zu Carboplatin plus Etoposid als Erstlinientherapie bei Patienten mit ES-SCLC. Für dieses Regime, das schon seit einem Jahr Standardtherapie ist, wurde der Vorteil gegenüber der alleinigen Chemotherapie mit einer Hazard-Ratio von 0,76 bestätigt. Beim diesjährigen ESMO-Meeting wurden die Daten der Patienten mit versus ohne langfristiges Überleben zur besseren Patientenselektion verglichen.12 PD-L1-Status und tTMB qualifizierten nicht als Biomarker für den Nutzen einer Immuntherapie. Es konnten in der Analyse zwar prognostische Parameter, wie Alter, Allgemeinzustand, Tumorlast oder LDH-Wert, bestätigt werden, diese sind aber zur Selektion für eine Immuntherapie ebenfalls nicht geeignet.
Eine kombinierte Immuntherapie mit Nivolumab plus Ipilimumab zeigte nach Chemoradiotherapie keinen Vorteil für die Prognose der SCLC-Patienten. In der STIMULI-Studie wurden SCLC-Patienten simultan chemoradiotherapiert und erhielten danach randomisiert Nivolumab plus Ipilimumab oder Beobachtung.13 Leider brachte die Immunkombination weder bezüglich des PFS noch des OS einen Vorteil.
Metastasiertes nicht kleinzelliges Lungenkarzinom
Die Immuntherapie hat sich in der Behandlung des metastasierten NSCLC etabliert. Beim ESMO-Kongress wurde die Monotherapie mit Pembrolizumab in der Langzeitbeobachtung bestätigt und Ergebnisse mit weiteren Checkpoint-Inhibitoren wurden vorgestellt. Auch im Stadium IV stehen Biomarker im Fokus der Forschung.
5-Jahres-Update der KEYNOTE-024-Studie
Zur Therapie von Patienten mit NSCLC im Stadium IV und PD-L1 TPS ≥50% wurden beim ESMO-Meeting die 5-Jahres-Daten der KEYNOTE-024-Studie präsentiert.14 In der Phase-III-Studie wurde Pembrolizumab mit platinhaltigen Chemotherapiedoubletten verglichen. Die Studie erlaubte einen Cross-over, der von mehr als der Hälfte der Patienten desChemotherapiearms genutzt wurde. Die 5-Jahres-Daten zeigen trotz dieser Konstellation einen klaren Vorteil für die Patienten, wenn Pembrolizumab eingesetzt wird (Abb. 4). Mit einer 5-Jahres-OS-Rate von 31,9% stellte der Diskutant der Studie in Aussicht, dass womöglich ein Teil der Patienten mit der Immuntherapie geheilt werden kann.
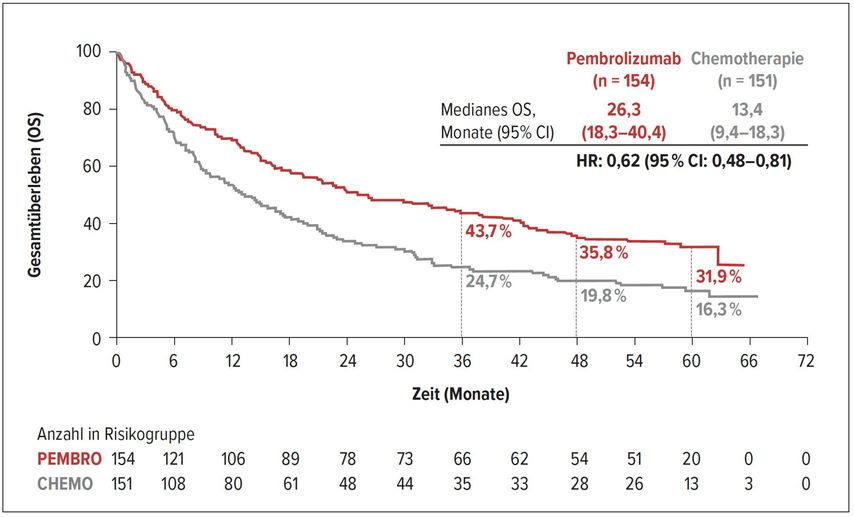
Abb. 4: Gesamtüberleben unter Therapie mit Pembrolizumab versus Chemotherapie (nach Brahmer J et al.)14
Cemiplimab plus Chemotherapie in der EMPOWER-Studie
In einem ähnlichen Design wie der KEYNOTE-024 wird auch in der EMPOWER-Studie ein PD-1-Inhibitor, in diesem Fall Cemiplimab mit einer Gabe alle drei Wochen, plus Chemotherapie gegen Chemotherapie bei NSCLC-Patienten mit PD-L1 ≥50% verglichen.15 In die Studie konnten Patienten mit Hirnmetastasen eingeschlossen werden. Insgesamt wurden 710 Patienten in die Studie rekrutiert. Der Cross-over war erlaubt. In der Studiendurchführung fällt auf, dass 235 Patienten noch einmal auf den PD-L1-Status nachgetestet wurden und nur 88 dieser Patienten PD-L1 ≥50% aufwiesen. Somit erhielten letztendlich insgesamt 563 Patienten mit hoher PD-L1-Expression die Studienmedikation. Besonders auch, dass die Patientencharakteristik verhältnismäßig viele Raucher aufwies. Beim Gesamtüberleben wurde mit einer Hazard-Ratio von 0,57 (Abb. 5) und beim progressionsfreien Überleben mit einer Hazard-Ratio von 0,54 ein klarer Vorteil der Immuntherapie für die PD-L1-positiven Patienten gesehen. Auch für die ITT-Population wurde der Vorteil durch die zusätzliche Cemiplimab-Gabe beobachtet. In der Subgruppe der hirnmetastasierten Patienten wurde ebenfalls der klare Vorteil für die Cemiplimab-Therapie gesehen, sodass Patienten mit Hirnmetastasen entsprechend Cemiplimab erhalten sollten. Bezüglich des Ansprechens wurde auch der Vorteil für die Immuntherapie gezeigt. Eine Korrelation von PD-L1-Expression und OS sowie PFS wurde festgestellt: je höher die PD-L1-Expression, desto besser der Therapieerfolg. Die Lebensqualität und die Sicherheit waren unter Cemiplimab gegenüber der Chemotherapie verbessert.
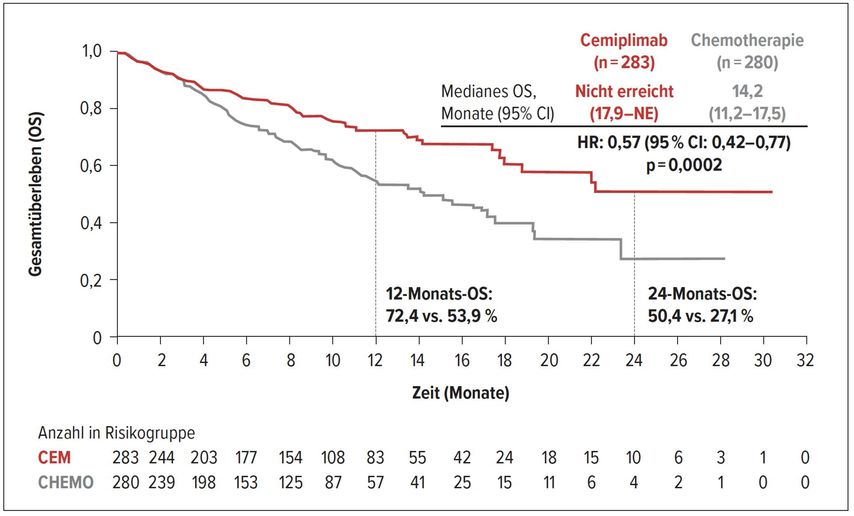
Abb. 5: Gesamtüberleben der Population mit PD-L1≥50% unter Therapie mit Cemiplimab versus Chemotherapie (nach Sezer A et al.)15
PIONeeR-Biomarker-Projekt für Immuntherapien
In einem sehr ausgedehnten und komplexen Projekt wird versucht, Biomarker für die Immuntherapie zu entwickeln.16 Bisher ist PD-L1 der einzige verwendete Biomarker und es werden sicherlich weitere für die Patientenselektion benötigt. Die Auswertung der ersten 100 Patienten im prospektiven PIONeeR-Biomarker-Projekt zeigen vielversprechende Daten mit verschiedenen neuen Biomarkern, wie der PD-L1-Zelldichte, zytotoxischen T-Zellen auf der Tumorzelle oder in der Tumorumgebung etc., die in der Zukunft zur Patientenselektion eingesetzt werden könnten.
Kombinationstherapien beim nicht squamösen NSCLC
In einer japanischen Studie, die leider bezüglich des Gesamtüberlebens negativ ausgefallen ist, wurde Nivolumab zusätzlich zu Carboplatin, Paclitaxel und Bevacizumab placebokontrolliert geprüft.17 Für das PFS wurde ein signifikanter Vorteil mit einer Hazard-Ratio von 0,56 für das Nivolumab-haltige Regime gesehen. Der Vorteil schlug sich nicht im Gesamtüberleben nieder (HR: 0,85), sodass dieses Regime wohl in der Praxis nicht umgesetzt werden wird.
In einer weiteren interessanten einarmigen Phase-II-Studie wurde Atezolizumab plus Bevacizumab in der ersten Therapielinie beim fortgeschrittenen nichtsquamösen NSCLC und PD-L1-TPS ≥50% untersucht.18 Nahezu jeder der 39 eingeschlossenen Patienten konnte von der Therapie profitieren. Das mediane PFS betrug 15,9 Monate. Eine Phase-III-Studie zur weiteren Entwicklung von Atezolizumab plus Bevacizumab wird dreiarmig gegen das IMpower150-Regime (Chemotherapie plus Atezolizumab plus Bevacizumab) und die Atezolizumab-Monotherapie durchgeführt.
Literatur:
1 Le Péchoux C et al.: An international randomized trial comparing post-operative radiotherapy (PORT) to no PORT, in patients with completely resected NSCLC and mediastinal N2 involvement. Primary end-point analysis of Lung ART (IFCT-0503, UK NCRI, SAKK) NCT00410683. ESMO 2020, Abstr. #LBA3_PR 2 Tsuboi M et al.: Osimertinib adjuvant therapy in patients with resected EGFR mutated NSCLC (ADAURA): CNS disease recurrence. ESMO 2020, Abstr. #LBA1 3 Besse B et al.: Neoadjuvant atezolizumab for resectable non-small cell lung cancer: Results from the phase II PRINCEPS trial. ESMO 2020, Abstr. #1215O 4 Faivre-Finn C et al.: Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase 3 pacific trial. Abstr. #LBA49 5 Solomon B et al.: Lorlatinib vs crizotinib in the first-line treatment of patients with advanced ALK-positive non-small cell lung cancer: Results of the phase 3 CROWN study. ESMO 2020, Abstr. #LBA2 6 Hong DS et al.: Durability of clinical benefit and biomarkers in patients with advanced non-small cell lung cancer (NSCLC) treated with AMG 510 (sotorasib): CodeBreaK 100. ESMO 2020, Abstr. #1257O 7 Cho BC et al.: Amivantamab (JNJ-61186372), an EGFR-MET bispecific antibody, in combination with lazertinib, a 3rd generation EGFR tyrosine kinase inhibitor, in advanced EGFR-mutant NSCLC. ESMO 2020, Abstr. #1258O 8 Toi Y et al.: A randomized phase II study of osimertinib with or without bevacizumab in advanced lung adenocarcinoma patients with EGFR T790M mutation. ESMO 2020, Abstr. #1259O 9 Zhang L et al.: ACTIVE: Apatinib plus gefitinib versus placebo plus gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant (EGFRm) non-small cell lung cancer (NSCLC): A multicenter, randomized, double-blind, placebo-controlled phase III trial (CTONG1706). ESMO 2020, Abstr. #LBA50 10 Addeo A et al.: Real-world treatment patterns, clinical outcome and EGFR/T790M testing practices in patients with EGFRm advanced NSCLC and 1L EGFR TKI therapy – a retrospective multinational study (REFLECT). ESMO 2020, Abstr. #1299P 11 Goldman J et al.: Durvalumab (D)-tremelimumab (T) + platinum-etoposide (EP) in 1L ES-SCLC: Characterization of long-term clinical benefit and tumour mutational burden (TMB) in CASPIAN. ESMO 2020, Abstr. #LBA86 12 Liu SV et al.: IMpower133: Characterisation of long-term survivors treated first line with chemotherapy ± atezolizumab in extensive-stage small cell long cancer. ESMO 2020, Abstr. #1781MO 13 Peters S et al.: Consolidation ipilimumab and nivolumab vs observation in limited stage SCLC after chemo-radiotherapy – results from the ETOP/IFCT 4-12 STIMULI trial. ESMO 2020, Abstr. #LBA84 14 Brahmer J et al.: KEYNOTE-024 5-year OS update: First-line pembrolizumab vs platinum-based chemotherapy in patients with metastatic NSCLC and PD-L1 tumor proportion score ≥50%. ESMO 2020, Abstr. #LBA51 15 Sezer A et al.: EMPOWER-Lung 1: Phase 3 first-line cemiplimab monotherapy vs platinum-doublet chemotherapy in advanced non-small cell lung cancer with programmed cell death-ligand 1 (PD-L1) ≥50%. ESMO 2020, Abstr. #LBA52 16 Barlesi F et al.: Precision immuno-oncology for advanced non-small cell lung cancer patients treated with PD1/L1 immune checkpoint inhibitors: A first analysis of the PIONeer project. ESMO 2020, Abstr. #LBA53 17 Lee JS et al.: ONO-4538-52/TASUKI-52 - Randomized phase III trial of nivolumab in combination with carboplatin, paclitaxel, and bevacizumab as first-line treatment for patients with advanced or recurrent non-squamous NSCLC. ESMO 2020, Abstr. #LBA54 18 Seto T et al.: WJOG @BE Study: A phase II study of atezolizumab with bevacizumab for non-squamous non-small-cell lung cancer with high PD-L1 expression. ESMO 2020, Abstr. #LBA55
Das könnte Sie auch interessieren:
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Ausgezeichnete Studien aus dem Bereich der Hämatologie
Im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie werden jedes Jahr diverse Preise und ...
Therapiestandards: aktuelle Entwicklungen
Die Therapiestandards beim Mantelzelllymphom (MCL) sind aktuell im Wandel: Vor Kurzem erfolgten Zulassungen von Inhibitoren der Bruton-Tyrosinkinase (BTKi) in Kombination mit ...