Gentherapie der Hämophilie, Blutkonserven aus dem Labor
Bericht:
Philipp Grätzel von Grätz
Transfusionsmedizin ist mehr als das Management von Blutbanken und die Verteilung von Blutkonserven. Gentherapien, Klimawandel und moderne Stammzellverfahren machen aus der Transfusionsmedizin ein Gebiet am Puls der Zeit, dessen Themen in viele andere Disziplinen ausstrahlen.
Jahrzehntelang gab es bei der Behandlung von Menschen mit Hämophilie kaum Innovationen. Faktorkonzentrate und rekombinante Gerinnungsfaktorpräparate waren der Standard. Neuerungen beschränkten sich allenfalls auf die seit etwa 15 Jahren aufkommenden digitalen Anwendungen zur Therapiebegleitung.
In den letzten Jahren hat sich das aber grundlegend geändert: „Wir erleben in der Hämophilietherapie eine Revolution“, berichtet PD Dr. Kristina Hölig von der Transfusionsmedizin am Universitätsklinikum Dresden. Wie viele andere Expert:innen diskutierte sie die neuesten Entwicklungen im Bereich der Transfusionsmedizin und Immunhämatologie auf der Jahrestagung 2023 der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie (DGTI).
Große Sprünge in Hämophilietherapie
Begonnen hat die Revolution der Hämophilietherapie mit der Zulassung von Faktorpräparaten mit verlängerter Halbwertszeit (EHL-FVIII/-FIX) ab dem Jahr 2015. Drei Jahre später wurde mit dem bispezifischen Antikörper Emicizumab, der den Faktor VIII imitiert und bei Hämophilie A zum Einsatz kommt, die erste Non-Faktor-Therapie zugelassen. Erstes Einsatzgebiet von Emicizumab war die Hemmkörperhämophilie. Mittlerweile habe die Behandlung aber längst alle Hämophiliepatient:innen jeden Alters erreicht, sagt Dr. Karolin Trautmann-Grill, ebenfalls Dresden.
Im Vergleich zur Prophylaxe mit Faktorpräparaten ist die Prophylaxe mit dem Antikörper sehr komfortabel: Er wird alle sieben bis 28 Tage subkutan injiziert. „Wichtig zu wissen ist, dass er eine schwere in eine milde Hämophilie verwandelt. Bei Blutungen ist weiterhin Faktor VIII nötig“, so Trautmann-Grill. Auch nicht unwichtig für die breite Ärzt:innenschaft: Emicizumab führt dazu, dass Ergebnisse der partiellen Thromboplastinzeit (PTT) und der klassischen Faktor-VIII-Messung nicht verwertbar sind. Zur Gerinnungsmessung müssen chromogene Faktor-VIII-Tests genutzt werden.
Gentherapie der Hämophilie: Strukturvorgaben für Deutschland
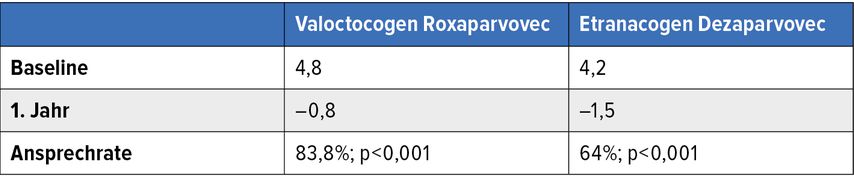
Ein weiterer Ecksteinin der Revolutionder Hämophilietherapie sind, neben den EHL-Faktorpräparaten und der Non-Faktor-Therapie,Gentherapien. Die ersten beiden, je eine für Hämophilie A und B, erreichen in diesen Monaten die Versorgung in Deutschland (Tab. 1). Zwei weitere sollen bald folgen. Damit kommt für Hämophiliepatient:innen eine zusätzliche, komplett andere Therapieoption hinzu, die aber auch neue Anforderungen an die Versorgungsstrukturen stellt.
Tab. 1: Effektive Reduktion der jährlichen Blutungsrate durch einmalige Injektion der ersten beiden zugelassenen Gentherapien bei Hämophilie, Valoctocogen Roxaparvovec für Hämophilie A und Etranacogen Dezaparvovec für Hämophilie B. Modifiziert nach Ozelo MC et al. und Pipe SW et al.1,2
Gewissermaßen taufrisch zur DGTI-Jahrestagung in Berlin wurden im Rahmen der Qualitätssicherungs-Richtlinie des Gemeinsamen Bundesausschusses (G-BA) für Advanced Therapeutic Medicinal Products (ATMP) die Strukturvorgaben für die Gentherapie in Deutschland vorgelegt.
Prof. Dr. Hermann Eichler von der Transfusionsmedizin des Universitätsklinikums Homburg/Saar gab dazu einen Überblick. Die Strukturvorgaben bauen auf der existierenden Zertifizierung zur Struktur- und Prozessqualität von Hämophiliezentren auf, die die Gesellschaft für Thrombose- und Hämostaseforschung (GTH) schon vor einigen Jahren in ein Zertifizierungsprogramm gegossen hat.
Die personellen und organisatorischen Anforderungen seien in vielen Bereichen ähnlich, so Eichler. Was sich beim G-BA im Moment nicht finde, sei das von der Arbeitsgruppe Hämophilie der GTH ausgearbeitete „Hub and Spoke“-Modell, bei dem die Verantwortlichkeiten für die Versorgung von Gentherapiepatient:innen auf durchführende und zuweisende Zentren verteilt werden.
Eine spannende Frage ist natürlich auch, welche Patient:innen für eine Gentherapie infrage kommen. Geld werde dabei eher nicht das Thema sein, so Eichler. Ziel bei den laufenden Preisverhandlungen zur Gentherapie sei es, dass die Versorgung nicht teurer werde als die derzeitige, ohnehin teure Standardtherapie. Wichtig für die aktuelle Kommunikation mit Patient:innen sei, dass sich auch noch andere Therapien in Entwicklung befänden, etwa extrem lang wirksame EHL-Produkte, die bei Injektion einmal wöchentlich Talspiegel von 40 Prozent erreichen.
Auch sei denkbar, dass künftige Gentherapien, welche die CRISPR/Cas9-Technologie anstelle vonAAV-Vektoren nutzen, möglicherweise weniger Hepatotoxizität zeigen als jene mit Virusvektoren. All das könnten Gründe sein, noch etwas abzuwarten. „Am Ende ist es eine individuelle Entscheidung des Patienten“, schließt Eichler.
Klimawandel: neue Blutproduktrisiken ante portas?
Intensiv diskutiert wurde bei der DGTI-Tagung in Berlin auch die Sicherheit von Blutprodukten. Hier steht die Transfusionsmedizin vor alten und neuen Herausforderungen.
Blutprodukte sind – wie seit Jahren schon – knapp, gleichzeitig stellt sich mit neuen Spender:innengruppen sowie mit durch Klimawandel und globale Reisetätigkeit mitverursachten Veränderungen beim Erregerspektrum die Frage, ob die bisherigen Maßnahmen zur Sicherstellung der mikrobiellen Unbedenklichkeit von Blutprodukten noch ausreichen. Das West-Nil-Virus ist ein Prototyp für einen mit Klimawandel und Reisetätigkeit in Zusammenhang stehenden Keim, auf den Blutprodukte mittlerweile getestet werden.
Über eine andere Erkrankung berichtet PD Dr. Harald Schennach vom Zentralinstitut für Bluttransfusion an den Tirol-Kliniken in Innsbruck: die Babesiose. Babesien sind Protozoen, die hämolytische Anämien verursachen, welche tödlich verlaufen können. Am bekanntesten ist die Babesiose als „Hundemalaria“. Humanpathogene Babesien sind insbesondere B. microti, die v.a. in den USA vorkommen, und B.divergens, die in Europa beheimatet sind.
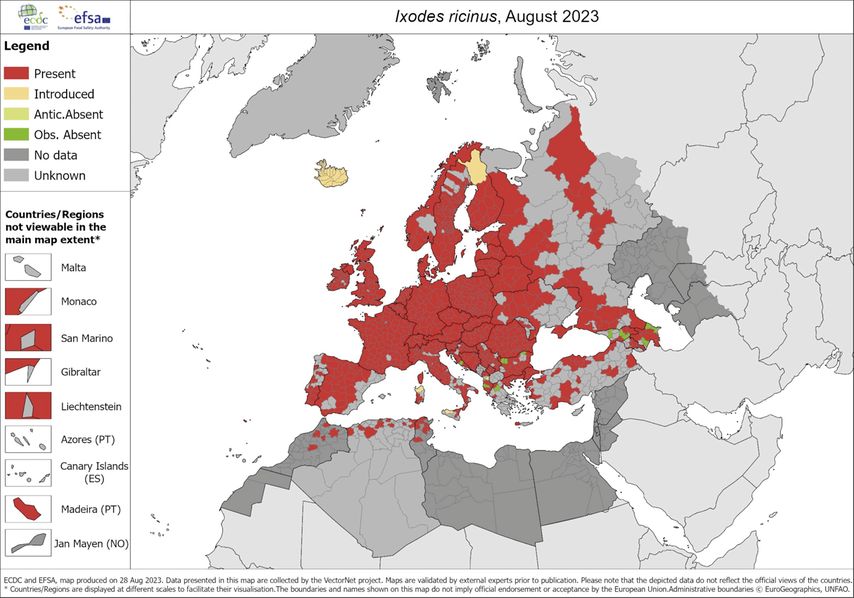
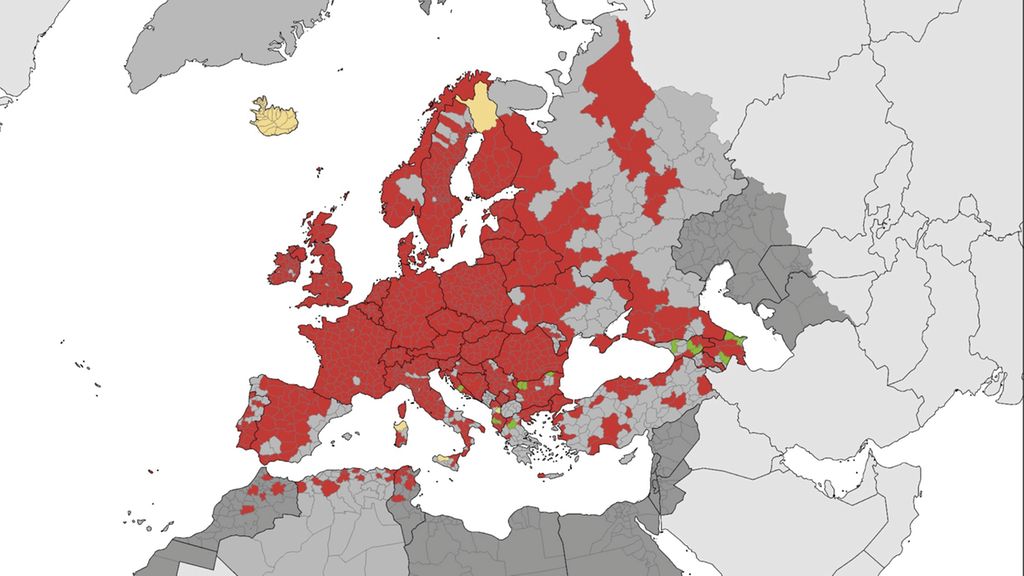
Übertragen werden Babesien durch Zecken, die sich dank Klimawandel immer weiter ausbreiten (Abb. 1). Auch Transfusionen sind ein wichtiger Vektor. Das betrifft vor allem B. microti in den USA. 250 Übertragungen über Blutprodukte wurden dort bisher beschrieben, mit immerhin 20 Prozent Sterblichkeit. „Die Babesiose ist damit nach der Malaria die am häufigsten über Transfusionen übertragene parasitäre Erkrankung“, so Schennach.
Abb. 1: Ixodes ricinus, der „Gemeine Holzbock“, hat mittlerweile nahezu ganz Europa kolonisiert. Durch ihn steigt die Gefahr der Kontamination von Blutkonserven durch von Zecken übertragene Erreger. Modifiziert nach ECDC, August 2023
Auch in Europa werden vermehrt Babesien gefunden. Aber ist das ein Problem für Transfusionen? Rein rechnerisch ergibt sich aus Zeckenuntersuchungen in Tirol eine Übertragungswahrscheinlichkeit von derzeit 24 Übertragungen von B. divergens und sechs Übertragungen von B. microti pro 100000 Spenden.
Eine aktuelle Studie aus Tirol hat in Kooperation mit dem Bayerischen Roten Kreuz 8000 Blutspender:innen gescreent, bei denen die übliche Rückstellfrist von acht Wochen nach (bekanntem) Zeckenstich eingehalten wurde. Bei diesen Spender:innen wurden keine Babesien gefunden. Aktuell sieht Schennach aufgrund dieser Ergebnisse also noch keinen Grund, so systematisch zu testen wie in den USA. „Ein Vigilanzsystem wird aber nötig werden“, so der Mediziner.
Moderne Pathogeninaktivierung hat es in Deutschland noch schwer
Vigilanz ist das eine, Erregerbeseitigung das andere. Prof. Dr. Axel Seltsam vom Blutspendedienst des Bayerischen Roten Kreuzes plädiert in Berlin dafür, moderne Verfahren der Pathogeninaktivierung verstärkt bei Blutprodukten einzusetzen, um deren Sicherheit zu erhöhen. Solche Verfahren nutzen UV-Licht und photoaktive Substanzen, um Nukleinsäuren und damit die Lebensader kontaminierender Mikroorganismen zu zerstören.
Der Vorteil ist klar: Solche Verfahren funktionieren erregerunabhängig, auch ohne spezifisches Testen. Für Plasmaprodukte sind sie längst im Einsatz. Dank innovativer Weiterentwicklungen funktionieren die lichtbasierten Verfahren heute aber auch mit zellulären Blutprodukten. Sinnvoll sei das insbesondere bei Thrombozytenkonzentraten (TK), so Seltsam. Bei etwa jeder zehntausendsten TK-Transfusion komme es zu einer transfusionsbedingten Sepsis. Dieses Risiko lasse sich reduzieren, und gleichzeitig werde es durch die Pathogeninaktivierung möglich, die TK nicht mehr nur vier, sondern vielleicht sieben bis zehn Tage zu lagern.
Mittlerweile gibt es weltweit zwei zugelassene Produkte für die Pathogeninaktivierung bei TK, die in vielen Ländern schon genutzt werden, in Deutschland aber bisher nicht. Um eine Nutzung zu etablieren, müssten die Verfahren durch Institutionen wie die Bundesärztekammer und das Paul-Ehrlich-Institut sowie durch die Fachgesellschaften zum Therapiestandard erhoben werden. Künftig könnten analoge Inaktivierungen auch bei Erythrozytenkonzentraten (EK) funktionieren. Das ist allerdings wegen des Hämoglobins technisch etwas schwieriger. Deswegen gibt es für EK bisher noch keine zugelassenen Systeme.
Kommen die Konserven bald aus dem Labor?
Wegen der Knappheit von Blutprodukten ruhen viele Hoffnungen auf ihrer künstlichen Herstellung. Transfusionsmediziner:innen reden hier von „Blood Pharming“. „Wir stehen vor einer entscheidenden Zeit“, ist Prof. Dr. Torsten Tonn vom DRK Blutspendedienst Nord-Ost überzeugt. „Neue Technologien machen es zunehmend möglich, Erythrozyten in Kultur zu züchten und/oder Hämoglobin so zu verkapseln, dass es als künstliches Blut eingesetzt werden könnte.“
Künstliche Blutprodukte würden auf absehbare Zeit sicher nicht alle Transfusionen ersetzen, betont Tonn. Aber gerade in bestimmten Problemkonstellationen könnten sie gute Dienste leisten, etwa bei chronischem Transfusionsbedarf und bei Menschen mit sehr seltenen Blutgruppenkonstellationen: „Die können wir heute oft nicht adäquat versorgen.“
Zu den vielleicht spannendsten Entwicklungen im Bereich Blutersatz zählen Blutprodukte, die mithilfe von Stammzelltechnologie aus induzierten pluripotenten Stammzellen (iPS) herangezogen werden. „Hier bietet sich in Kombination mit der Genschere-Technologie die Möglichkeit, Blutgruppenantigene so zu eliminieren, dass die Produkte universell verwendbar sind“, so Tonn.
Details berichtet in Berlin Constanca Ferreira di Figueiredo, Professorin für Regenerative Zelltherapien an der Medizinischen Hochschule in Hannover. Sie arbeitet an Bioreaktoren für Thrombozyten. Konkret nutzt sie iPS-Zellen, um daraus Megakaryozyten heranzuziehen, die in Empfänger:innen antigenmodifizierte Thrombozyten mit möglichst geringer Immunogenität produzieren. Dazu werden noch im Stadium der iPS-Zellen mithilfe von lentiviralen Vektoren die HLA-Antigene herunterreguliert.
Dass der Ansatz funktioniert und von den übertragenen Megakaryozyten stammende Blutplättchen tatsächlich in der Zirkulation der Empfänger:innen auftauchen, haben die Forschenden aus Hannover anhand mehrerer Tiermodelle gezeigt. „Wir denken, dass wir nicht mehr allzu weit von einem klinischen Einsatz entfernt sind“, sagt Figueiredo in Berlin.
Quelle:
57. Jahrestagung der Deutschen Gesellschaft für Transfusionsmedizin und Immunhämatologie e.V. (DGTI) gemeinsam mit der 31. Jahrestagung der Deutschen Gesellschaft für Immungenetik (DGI), 11.–13. September, Düsseldorf
Literatur:
1 Ozelo MC et al.: N Engl J Med 2022; 386: 1013-25 2 Pipe SW et al.: N Engl J Med 2023; 388: 706-18
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...