Wenn eine schwere Diagnose auf die Sehnsucht trifft
Autor:innen:
Dr. med. Marcel Steinmann
Präsident FertiSave
Frauenklinik
Abteilung für Reproduktionsmedizin und Gynäkologische Endokrinologie
Luzerner Kantonsspital, Luzern
E-Mail: marcel.steinmann@luks.ch
Prof. Dr. med. Alexandra Kohl Schwartz
Frauenklinik
Abteilung für Reproduktionsmedizin und Gynäkologische Endokrinologie
Luzerner Kantonsspital, Luzern
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Brustkrebs ist die häufigste Krebserkrankung bei Frauen und betrifft zunehmend auch diejenigen im reproduktiven Alter. Neben der optimalen Therapie rückt oft der Kinderwunsch in den Mittelpunkt. Dank modernster Behandlungen überleben immer mehr Betroffene, und die Reproduktionsmedizin eröffnet neue Wege zu einer sicheren Schwangerschaft – ohne die onkologische Prognose zu verschlechtern.
Einfluss der Brustkrebstherapie auf die Fertilität
Die Behandlung von Brustkrebs kann die Fruchtbarkeit erheblich beeinträchtigen, insbesondere durch die gonadotoxischen Effekte der Chemotherapie. Besonders betroffen sind Regime, die Alkylanzien, Anthrazykline oder Taxane enthalten.1 Der negative Einfluss auf die ovarielle Reserve ist dosis- und substanzabhängig, wobei auch patientenspezifische Faktoren wie das Alter und die vorhandene ovarielle Reserve sowie krankheitsspezifische Aspekte, etwa Mutationen in Hochrisiko-Genen wie BRCA, eine Rolle spielen. Chemotherapeutika schädigen die Eizellen direkt, indem sie DNA-Schäden verursachen und damit die Follikelreserve reduzieren. Zudem können sie die Funktion der Eierstöcke durch Durchblutungsstörungen und die Hormonproduktion beeinträchtigen, was zu einer vorzeitigen Ovarialinsuffizienz führen kann.2
Neben der Chemotherapie kann auch die Immuntherapie die Fruchtbarkeit beeinflussen, wenngleich die genauen Mechanismen weniger erforscht sind. Während die Gonadotoxizität von Tamoxifen nicht eindeutig geklärt ist, wird von GnRH-Agonisten kein signifikanter negativer Effekt erwartet.3
Möglichkeiten zum Schutz der Fertilität
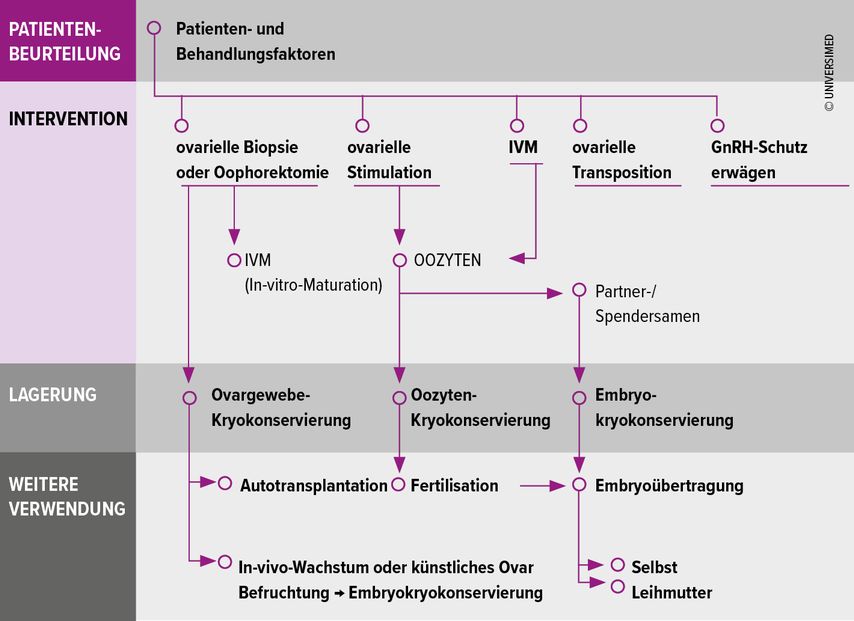
Aufgrund des Risikos einer Ovarialinsuffizienz und des damit verbundenen Fertilitätsverlustes sollten alle Patientinnen mit Brustkrebs, die eine gonadotoxische Therapie erhalten, frühzeitig über dieses Risiko aufgeklärt und über fertilitätserhaltende Massnahmen informiert werden.4 In der Sprechstunde für Fertilitätserhalt erfolgt zunächst eine Standortbestimmung mit Erfassung der ovariellen Reserve mittels Anti-Müller-Hormon (AMH) im Serum und der Bestimmung der Anzahl antraler Follikel im Ultraschall. Zudem werden das geplante Therapieregime, das Alter der Patientin, mögliche Vorerkrankungen und ihre individuellen Wünsche berücksichtigt. Auf dieser Basis werden die verfügbaren Optionen zum Fertilitätserhalt besprochen (Abb. 1).
Abb. 1: Möglichkeiten zum Fertilitätserhalt bei Frauen nach ESHRE (modifiziert nach ESHRE Guideline Group on Female Fertility Preservation et al.)5
Die ovarielle Stimulation zur Kryokonservierung von Eizellen oder Zygoten ist die First-Line-Massnahme zum Fertilitätserhalt.5 Die Stimulation kann zu jedem Zeitpunkt des Zyklus begonnen werden, individuell abgestimmt entweder als einmalige oder als doppelte Stimulation («double stimulation»). Die Kryokonservierung von Eizellen bietet den Vorteil guter Raten von reproduktivem Erfolg und ist eine etablierte, routinemässig eingesetzte Methode, zu der es umfangreiche klinische Erfahrung gibt. Zudem ermöglicht sie im Falle einer Hochrisikomutation eine spätere genetische Untersuchung der Embryonen mittels Präimplantationsdiagnostik (PGT). Eine zentrale Frage bleibt, ob die hormonelle Stimulation die onkologische Prognose negativ beeinflussen könnte, da sie kurzfristig zu einem Anstieg der Hormonspiegel führt. Die Estradiolkonzentrationen sind während der Stimulation nur für 7 bis 14 Tage erhöht und werden durch die zusätzliche Gabe von Aromatasehemmern6 begrenzt. Ein Progesteronanstieg wird durch den Einsatz eines GnRH-Agonisten7 zur Ovulationsinduktion und den Verzicht auf eine Lutealphasenunterstützung verhindert. Da primär die Kombination aus Estradiol und Progesteron als tumorproliferativ gilt,8 wird das onkologische Risiko aus endokrinologischer Sicht als minimal eingestuft. Zahlreiche Studien bestätigen diese Einschätzung: Das krankheitsfreie Überleben wird durch eine ovarielle Stimulation nicht negativ beeinträchtigt.9 Eine Verzögerung der onkologischen Therapie durch die Stimulation um bis zu 60 Tage hat keinen negativen Einfluss auf die Prognose von Brustkrebspatientinnen.10 Diese Erkenntnisse unterstützen die sichere Integration der Oozytenkryokonservierung in die Behandlungsstrategie zum Fertilitätserhalt bei Frauen mit Brustkrebs.
Eine weitere Möglichkeit zur Fertilitätsprotektion ist die Kryokonservierung von Ovargewebe nach laparoskopischer Gewebeentnahme, welches im Falle einer prämaturen Ovarialinsuffizienz retransplantiert werden kann. Diese Methode ermöglicht nicht nur eine Wiederherstellung der Fruchtbarkeit, sondern kann auch die endokrine Funktion der Eierstöcke zumindest temporär erhalten. Das Retransplantat ist in der Regel nach 3–6 Monaten postoperativ aktiv.11 Die Methode wird zunehmend eingesetzt und gilt mittlerweile nicht mehr als experimentell. Ein theoretisches Risiko besteht in der Retransplantation maligner Zellen, jedoch wurde dies bisher in keinem Fall belegt.12
Die ovarielle Suppression mit GnRH-Agonisten zielt darauf ab, die Ovarien vor den gonadotoxischen Effekten der Chemotherapie zu schützen. Die multizentrische PROMISE-Studie13 konnte zeigen, dass der Einsatz von GnRH-Agonisten mit einer geringeren Rate an prämaturer Ovarialinsuffizienz sowie einer höheren Schwangerschaftsrate nach der Therapie assoziiert ist. Zudem kann die durch GnRH-Agonisten induzierte Amenorrhö während der Chemotherapie auch aus onkologischer Sicht vorteilhaft sein. Bezüglich der onkologischen Prognose scheinen GnRH-Agonisten keinen negativen Einfluss auf das Gesamtüberleben oder das krankheitsfreie Überleben zu haben. Daher werden sie beim Mammakarzinom – im Gegensatz zu anderen Tumorentitäten – häufig eingesetzt.
Fertilitätserhalt für alle?
Fertilitätsprotektive Massnahmen sind primär dann indiziert, wenn ein relevantes gonadotoxisches Risiko besteht, sich die Patientin im fertilen Alter befindet und eine ausreichende ovarielle Reserve vorliegt – vorausgesetzt, der Fertilitätserhalt ist erwünscht. Dabei müssen die Voraussetzungen für eine Kostenübernahme gemäss Anhang 1 der Krankenpflege-Leistungsverordnung (KLV) berücksichtigt werden. Eine Leistungspflicht der Krankenkassen besteht für postpubertäre Jugendliche und Erwachsene bis zum vollendeten 40. Lebensjahr, wenn das Risiko einer therapiebedingten persistierenden Amenorrhö durch die Krebsbehandlung über 20% beträgt. Beim Mammakarzinom gilt gemäss dem Manual der Schweizerischen Gesellschaft der Vertrauensärzte aktuell noch eine untere Altersgrenze von 30 Jahren. Zudem wird gemäss dem eidgenössischen Fortpflanzungsmedizingesetz eine kurative Behandlungsintention vorausgesetzt, um das Kindeswohl zu gewährleisten. Des Weiteren muss eine spätere Schwangerschaft mit der Erkrankung und der Therapie vereinbar und die Risiken einer fertilitätsprotektiven Massnahme gering sein. Die Lagerdauer kryokonservierter Proben für Krebspatientinnen ist unbegrenzt, jedoch ist die Kostenübernahme durch die Krankenkasse auf fünf Jahre limitiert und kann bei persistierender Amenorrhö um weitere fünf Jahre verlängert werden. Da die Verwendungsrate kryokonservierter Proben insgesamt noch niedrig ist, sollte die Integration fertilitätsprotektiver Massnahmen stets individuell geprüft werden – sowohl unter medizinischen als auch unter Kosten-Nutzen-Aspekten.
Realisierung des Kinderwunsches nach Brustkrebserkrankung
Mehrere Studien haben die onkologische Sicherheit einer Schwangerschaft nach Brustkrebs untersucht. Eine Metaanalyse von Lambertini et al.14 konnte zeigen, dass eine Schwangerschaft nach einem Hormonrezeptor-positiven Mammakarzinom nicht mit einer schlechteren Prognose assoziiert ist – im Gegenteil: Sie ist mit einem längeren Gesamtüberleben verbunden. Ein möglicher Erklärungsansatz für das verlängerte Gesamtüberleben nach einer Schwangerschaft ist die Hypothese, dass protektive immunologische Effekte während Schwangerschaft und Stillzeit eine Rolle spielen. Auch die vorübergehende Unterbrechung der endokrinen Therapie zur Realisierung eines Kinderwunsches ist eine Option. Der POSITIVE-Trial15 hat gezeigt, dass Frauen mit frühem Hormonrezeptor-positivem Brustkrebs die adjuvante endokrine Therapie pausieren können, um zu konzipieren, ohne erhöhte Rezidivrate. Allerdings beziehen sich diese Ergebnisse ausschliesslich auf Frühstadien des Hormonrezeptor-positiven Mammakarzinoms, und es sind Daten eines längeren Follow-ups nötig, um die langfristige Sicherheit zu bestätigen. Weitere Resultate werden für 2029 erwartet.
Nach einer Chemotherapie wird eine Latenzzeit von mindestens zwölf Monaten16 empfohlen, bevor eine Schwangerschaft angestrebt wird. Bei Anwendung eines SERM (z.B. Tamoxifen) wird ein Intervall von drei Monaten empfohlen, um ein vollständiges Washout bis zur Konzeption zu gewährleisten.17 Bei einer Immuntherapie (z.B. Trastuzumab oder Pembrolizumab) beträgt die empfohlene Wartezeit um die sechs Monate, wobei hier die Datenlage dünn ist und die Empfehlungen je nach Immuntherapeutikum stark variieren.18 Werden diese Zeiträume eingehalten, gibt es nach aktuellem Wissensstand kein erhöhtes Risiko für Fehlgeburten oder Fehlbildungen. Die Schwangerschaften von «cancer survivors» verlaufen jedoch häufiger komplizierter, insbesondere bei geringem Intervall zur Systemtherapie. Die neonatalen Risiken sind vergleichbar mit der Allgemeinbevölkerung. Insgesamt ist eine Schwangerschaft nach überstandener Brustkrebserkrankung in vielen Fällen möglich und sicher für Mutter und Kind.19
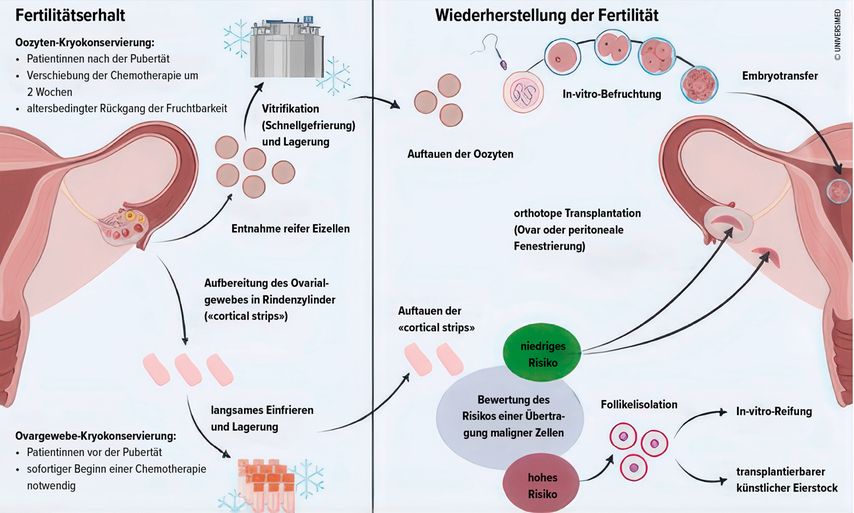
Die Fragen nach der optimalen Vorgehensweise bei Kinderwunsch nach Mammakarzinom ist abhängig von der ovariellen Funktion. Diese kann sich nach einer gonadotoxischen Therapie erholen, wobei oft unklar ist, wann und für wie lange. Patientinnen sollten daher informiert werden, dass ein spontan wiederkehrender Zyklus nicht ungewöhnlich ist. Falls die Familienplanung noch offen ist, sollten sie sich frühzeitig für eine Standortbestimmung melden. Dabei werden die hormonelle Konstellation, die Fertilitätsreserve sowie mögliche Sterilitätsfaktoren (z.B. Tubenfaktor, Spermiogramm) abgeklärt, um gemeinsam mit dem Paar einen individuellen Plan zur Kinderwunschrealisierung zu entwickeln. Liegt ein ovulatorischer Spontanzyklus vor, kann zunächst eine Spontankonzeption über 6 bis 12 Monate versucht werden. Ein Zyklusmonitoring mit gegebenenfalls Ovulationsinduktion kann angeboten werden. Falls nötig, kann eine stimulierte Behandlung mit getimtem Geschlechtsverkehr oder intrauteriner Insemination (IUI) erwogen werden. Bei reduzierter ovarieller Reserve oder weiteren Sterilitätsfaktoren wie Tubenfaktor oder schwerem andrologischem Faktor können eine In-vitro-Fertilisation (IVF) oder eine intrazytoplasmatische Spermieninjektion (ICSI) notwendig sein. Retrospektive Kohortenstudien20 mit begrenzten Daten deuten darauf hin, dass eine hormonelle Stimulation nach überstandenem Brustkrebs sicher ist und kein erhöhtes Rezidivrisiko darstellt. Besteht eine sekundäre Amenorrhö bzw. eine Ovarialinsuffizienz, kann – sofern vor der Krebstherapie fertilitätserhaltende Massnahmen getroffen wurden – auf kryokonservierte Eizellen oder Ovargewebe zurückgegriffen werden (Abb. 2). Kryokonservierte Eizellen werden aufgetaut, mit Spermien des Partners befruchtet und nach Embryokultur erfolgt der Embryotransfer. Kryokonserviertes Ovarialgewebe kann laparoskopisch retransplantiert werden. Falls sich die ovarielle Funktion wiederherstellt, kann zunächst eine Spontankonzeption angestrebt werden, wobei auch hier grosszügig ein Zyklusmonitoring angeboten werden sollte. Falls keine Schwangerschaft eintritt oder weitere Sterilitätsfaktoren bestehen, gibt es die Option einer IVF/ICSI – im natürlichen Zyklus, mit milder oder konventioneller Stimulation. Ist die ovarielle Reserve erschöpft und steht keine zuvor kryokonservierte Fertilitätsreserve zur Verfügung, besteht die Möglichkeit der Eizellspende, die derzeit nur im Ausland möglich ist, jedoch nach dem Bundesratsbeschluss vom 30.01.2025 künftig auch in der Schweiz erlaubt sein könnte. Eine weitere Option ist die Adoption.
Insgesamt bleibt die Vorgehensweise individuell anzupassen, wobei stets die Wünsche des Paares sowie medizinische und fertilitätsrelevante Faktoren, darunter die ovarielle Reserve, der Zyklusstatus, die hormonelle Konstellation und weitere Sterilitätsfaktoren, berücksichtigt werden.
Spezialfall: Patientinnen mit einer BRCA-Mutation
Frauen mit einer BRCA1-Mutation haben gemäss einigen Studien21,22 eine verminderte ovarielle Reserve, die zudem schneller abnimmt, was ihr Risiko für eine vorzeitige Ovarialinsuffizienz unabhängig von einer Krebstherapie erhöht. Neben dem onkologischen Risiko sind sie besonders vulnerabel gegenüber den gonadotoxischen Effekten einer Chemo- oder Systemtherapie. Zudem besteht das Risiko der Weitergabe der Mutation an Nachkommen. Daher erfordert der Fertilitätserhalt bei diesen Patientinnen besondere Aufmerksamkeit und frühzeitige Planung.
Die Oozytenkryokonservierung scheint auch bei BRCA-Mutations-Trägerinnen gemäss begrenzten Datensätzen23 sicher zu sein und bietet die Option der genetischen Untersuchung der Embryonen mittels Präimplantationsdiagnostik (PGT). Im Falle einer Retransplantation des Ovargewebes wird empfohlen, das transplantierte Ovargewebe nach abgeschlossener Familienplanung zu entfernen, um das Risiko einer späteren malignen Entartung zu minimieren. Die vorläufigen Daten einer Studie von Magaton et al.24 deuten darauf hin, dass eine künstliche Befruchtung nach Brustkrebs auch bei vorliegender BRCA-Mutation als sicher gilt und weder maternale noch neonatale Risiken birgt.
Ganzheitliche Betreuung und Unterstützung während der Kinderwunschbehandlung
Die Zeit der Kinderwunschbehandlung nach einer überstandenen Krebserkrankung ist für viele Paare von emotionaler und psychischer Belastung geprägt. Daher ist es essenziell, ihnen während des gesamten Prozesses psychologische und emotionale Unterstützungsmöglichkeiten anzubieten. Die Betreuung sollte interdisziplinär und in enger Zusammenarbeit zwischen Psychologie, Onkologie, Reproduktionsmedizin, Gynäkologie und Senologie erfolgen. Besonders beachtet werden muss die psychosexuelle Gesundheit,25 da es oft durch behandlungsassoziierte Folgen wie genitale Atrophie und emotionale Belastung zu sexuellen Dysfunktionen kommen kann. In diesen Fällen können die Zusammenarbeit mit Sexualtherapeuten sowie die Behandlung von Genitalatrophie und Libidostörungen mittels lokaler Massnahmen hilfreich sein. Ressourcen wie FertiOnco, Netzwerke wie FertiPROTEKT und FertiSave, aber auch Selbsthilfegruppen und psychoonkologische Angebote können die Patientinnen weiter unterstützen. Eine ganzheitliche Betreuung trägt wesentlich zur Verbesserung der Lebensqualität dieser Patientinnen bei.26
Zukunftsperspektiven
Aktuell gibt es Forschungsansätze zur medikamentösen Fertilitätsprotektion, beispielsweise durch Apoptosehemmer,27 die den Zelltod von Oozyten während der Chemotherapie verhindern sollen. Weitere Entwicklungen betreffen die In-vitro-Maturation28 von Primordialfollikeln aus Ovargewebe, die Generierung von Eizellen aus Keimbahnstammzellen sowie die Verbesserung der Transplantationseffektivität bei Ovargewebetransplantationen. Gross angelegte Studien wie FertiTOX29 werden in Zukunft weitere Erkenntnisse liefern und die Beratung betroffener Frauen weiter optimieren.
Fazit und Ausblick
Zusammenfassend lässt sich festhalten, dass jeder Frau mit Brustkrebs und offener Familienplanung im Falle einer gonadotoxischen Therapie eine fertilitätsprotektive Massnahme angeboten werden sollte. Die vorhandenen Optionen gefährden die Patientinnen nicht, erfordern jedoch eine sorgfältige Abwägung und individuelle Planung. Frauen mit Kinderwunsch nach überstandener Brustkrebserkrankung kann häufig eine Schwangerschaft ermöglicht werden – und dies ohne erhöhtes Rezidivrisiko, wobei die Datengrundlage noch begrenzt ist. Besonders für molekulare Subtypen wie das tripelnegative Mammakarzinom oder fortgeschrittene Tumorstadien sowie für längere Follow-up-Zeiträume sind weitere gross angelegte Studien erforderlich. Eine reproduktionsmedizinische Standortbestimmung sollte frühzeitig erfolgen, um individuelle Optionen aufzuzeigen und gezielte Unterstützung zu ermöglichen. Nebst der Fertilität gilt ein besonderes Augenmerk dem Verlust der ovariellen Funktion und dem damit verbundenen Risiko einer prämaturen Ovarialinsuffizienz (POI). Diese kann erhebliche kardiovaskuläre, metabolische, osteoporotische und kognitive Langzeitfolgen mit sich bringen, weshalb betroffene Frauen gut betreut und eng angebunden werden müssen.
Literatur:
1 Sachdev PA et al.:Breast cancer treatment and fertility preservation: a narrative review of impacts, strategies and ethical considerations. Curr Oncol Rep 2024; 26(12): 1575-85 2 Vuong S, Warner E: Breast cancer survivorship among younger patients: challenges and opportunities—narrative review. Ann Palliat Med 2024; 13(5): 1246-57 3 Dittrich R et al.: Fertility preservation for patients with malignant disease. Guideline of the DGGG, DGU and DGRM (S2k-Level, AWMF Registry No. 015/082, November 2017) – recommendations and statements for girls and women. Geburtshilfe Frauenheilkd 2018; 78(6): 567-84 4 Peccatori FA et al.: Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 160-70 5 ESHRE Guideline Group on Female Fertility Preservation et al.: ESHRE guideline: female fertility preservation. Hum Reprod Open 2020; 2020(4): hoaa052 6 Ferreiro E et al.: Aromatase inhibitors for ovarian stimulation in patients with breast cancer. Curr Drug Targets 2020; 21(9): 910-21 7 Cavagna M, DzikA: Depot GnRH-agonist trigger for breast-cancer patient undergoing ovarian stimulation resulted in mature oocytes for cryopreservation: a case report. Reprod Biomed Online 2011: 22(3): 317-9 8 Roussouw JE et al.: Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288(3): 321-33 9 Sonigo C et al.: Disease-free survival does not differ according to fertility preservation technique for young women with breast cancer. Fertil Steril 2023; 119(3): 465-73 10 De Melo Gagliato D et al.: Impact of Delayed neoadjuvant systemic chemotherapy on overall survival among patients with breast cancer. Oncologist 2020; 25(9): 749-57 11 Ghunaim S et al.: Fertility preservation in patients with BRCA mutation. Ecancermedicalscience 2020; 14: 1033 12 Rosendahl M et al.: The safety of transplanting cryopreserved ovarian tissue in cancer patients: a review of the literature. J Assist Reprod Genet 2013; 30(1): 11-24 13 Lambertini M et al.: Long-term outcomes with pharmacological ovarian suppression during chemotherapy in premenopausal early breast cancer patients. J Natl Cancer Inst 2022; 114(3): 400-8 14 Arecco L et al.: Safety of pregnancy after breast cancer in young women with hormone receptor-positive disease: a systematic review and meta-analysis. ESMO Open 2023; 8(6): 102031 15 Partridge AH et al.: Interrupting endocrine therapy to attempt pregnancy after breast cancer. N Engl J Med 2023; 388(18): 1645-56 16 Hartnett KP et al.: Pregnancy after cancer: Does timing of conception affect infant health? Cancer 2018; 124(22): 4401-7 17 Buonomo B et al.: Tamoxifen exposure during pregnancy: a systematic review and three more cases. Breast Care 2020; 15(2): 148-56 18 Mittra A et al.: Outcomes of pregnancy during immunotherapy treatment for cancer: analysis of clinical trials sponsored by the National Cancer Institute. Oncologist 2021; 26(10): e1883-6 19 Lambertini M et al.: Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2020; 31(12): 1664-78 20 Condorelli M et al.: Impact of ARTs on oncological outcomes in young breast cancer survivors. Hum Reprod 2021; 36(2): 381-9 21 Giordano S et al.: Association of BRCA1 mutations with impaired ovarian reserve: connection between infertility and breast/ovarian cancer risk. J Adolesc Young Adult Oncol 2016; 5(4): 337-43 22 Son KA et al.: Association of BRCA mutations and anti-müllerian hormone level in young breast cancer patients. Front Endocrinol (Lausanne) 2019; 11: 10: 235 23 Condorelli M et al.: Safety of assisted reproductive techniques in young women harboring germline pathogenic variants in BRCA1/2 with a pregnancy after prior history of breast cancer. ESMO Open 2021; 6(6): 100300 24 Magaton IM et al.: O-087 Use and safety of assisted reproductive technology in young BRCA carriers with a pregnancy after treatment for breast cancer: results from an international cohort study. Human Reproduction 2024; 39(1): doi: 10.1093/humrep/deae108.093 25 Kaufmann R et al.: From diagnosis to survivorship addressing the sexuality of women during cancer. Oncologist 2024; 29(12): 1014-23 26 Javan Biparva A et al.: Global quality of life in breast cancer: systematic review and meta-analysis. BMJ Support Palliat Care 2024; 13(e3): e528-36 27 Luan Y et al.: Inhibitors of apoptosis protect the ovarian reserve from cyclophosphamide. J Endocrinol 2019; 240(2): 243-56 28 Malo C et al.: In vitro growth of human follicles: current and future perspectives. Int J Mol Sci 2024; 25(3): 1510 29 Von Wolff M et al.: Evaluation of the gonadotoxicity of cancer therapies to improve counseling of patients about fertility and fertility preservation measures: protocol for a retrospective systematic data analysis and a prospective cohort study. JMIR Res Protoc 2024; 13: e51145 30 Cacciottola L et al.: Ovarian tissue and oocyte cryopreservation priorto iatrogenic premature ovarian insuaiciency. Best Pract Res Clin Obstet Gynaecol 2022; 81: 119-33
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...
TNM-Staging nach NACT und Anforderungen im Rahmen klinischer Studien
Die Pathologie beeinflusst massgeblich das Management von Patient:innen mit Mammakarzinom nach NACT. Zudem sind die Kenntnis der initialen Tumorbiologie und die Korrelation mit dem ...