Sonografische Beurteilung der Fertilität
Autoren:
Dr. med. Philipp Quaas
Frauenklinik/Poliklinik, Universitätsspital Basel
E-Mail: philipp.quaas@usb.ch
Dr. med. Alexander Quaas
Reproduktionsmedizin und gynäkologische Endokrinologie (RME), Universitätsspital Basel
E-Mail: alexander.quaas@usb.ch
Die Sonografie ist ein wichtiges Hilfsmittel bei der fertilitätsbezogenen Diagnostik und Therapie. Basis der sonografischen Beurteilung der Fruchtbarkeit ist der Menstruationszyklus. Analog zu diesem sollte ein sogenanntes «Zyklusmonitoring» erfolgen, das der Ärztin bzw. dem Arzt weitreichende Informationen in Hinblick auf die Fertilität ermöglichen kann.
Keypoints
-
Die Sonografie ist ein wichtiges Hilfsmittel bei der Beurteilung der Fruchtbarkeit.
-
Grundlage der sonografischen Fertilitätsdiagnostik ist der Menstruationszyklus.
-
Das sogenannte «Zyklusmonitoring» kann der Ärztin bzw. dem Arzt weitreichende Informationen in Hinblick auf die Fertilität ermöglichen.
-
In der Praxis ist eine ultraschallbasierte Diagnostik meist ausreichend, um der Patientin eine orientierende Standortbestimmung in Hinblick auf ihre Fruchtbarkeit geben zu können.
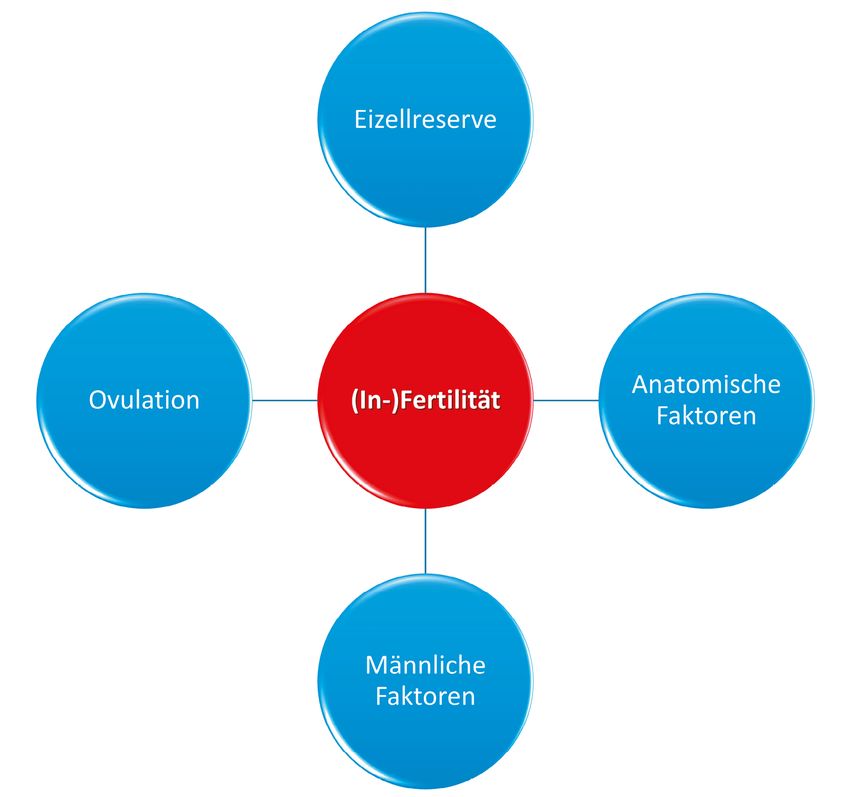
Der Begriff «Fertilität» definiert sich wie folgt: die Fähigkeit eines Organismus zur Fortpflanzung bzw. Reproduktion. Dies bedeutet beim Menschen, dass sowohl die Frau als auch der Mann in der Lage sein müssen, eine Schwangerschaft zu erzeugen (Konzeption), und dass die Frau fähig ist, eine Schwangerschaft auszutragen. Die «fertile oder reproduktive Phase» zieht sich bei der Frau von der Menarche bis zur Menopause und beim Mann von der Pubertät bis möglicherweise ins höhere Alter.1 Tritt bei einem gesunden Paar nach zwölf Monaten ungeschütztem und regelmässigem Geschlechtsverkehr keine Spontankonzeption ein, so spricht man von «Infertilität». Dieser Zustand wird von der World Health Organization (WHO) nach der International Classification of Diseases, 11th Revision (ICD-11), als «Krankheit des weiblichen oder männlichen Reproduktionssystems» definiert. Es wird geschätzt, dass weltweit etwa 48 Millionen Paare bzw. 186 Millionen Menschen von Infertilität betroffen sind.2 Bei der Aufarbeitung der Fertilität bzw. Infertilität eines Individuums oder Paares spielen verschiedene Aspekte und Faktoren eine Rolle. Essenziell wichtig ist hierbei eine fundierte Kenntnis der physiologischen Abläufe und Mechanismen in der menschlichen Reproduktion. Diese führt in der Folge zu einem besseren Verständnis der potenziellen Störfaktoren, die in diesem System vorliegen können. Leidet ein Paar seit einem Jahr oder länger an ungewollter Kinderlosigkeit trotz «Verkehr zum Optimum (VZO)», so liegen die Ursachen dieser Unfruchtbarkeit zu einem Drittel bei der Frau, zu einem Drittel beim Mann und zu einem Drittel bei den Partnern gemeinsam.3 Zur Abklärung der (In-)Fertilität hat sich aus Erfahrung ein Schema bewährt, das vier Faktoren bzw. Einflusskriterien beinhaltet: Eizellreserve und ovulatorische Menstruationszyklen sowie anatomische und männliche Faktoren (Abb. 1). Der Ultraschall liefert die Möglichkeit, wertvolle Informationen aus allen vier Bereichen zu sammeln.
Sonografisches «Zyklusmonitoring» mit Beurteilung der Ovarialreserve
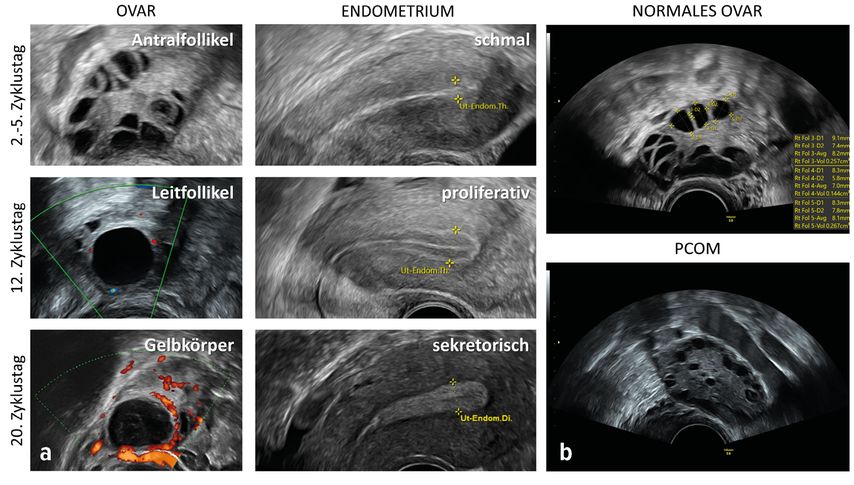
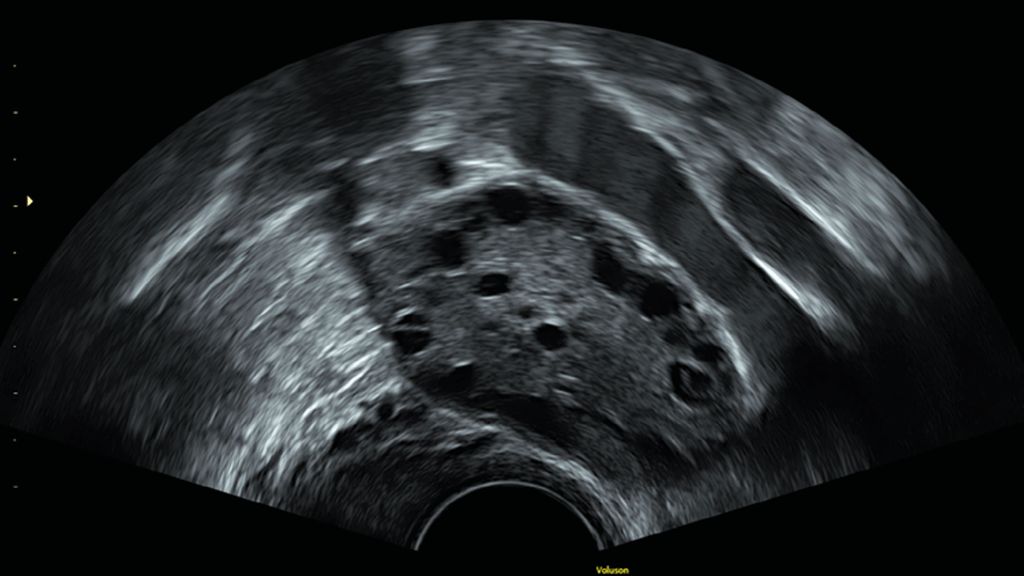
Zur sonografischen Beurteilung der Fertilität empfiehlt es sich, ein sogenanntes «Zyklusmonitoring» durchzuführen. Hierbei erfolgt an verschiedenen Tagen im Zyklus ein transvaginaler Ultraschall zur Begutachtung der reproduktiven Organe. Uterus und Adnexe weisen hier entsprechend den zyklischen Veränderungen von Östrogen und Progesteron bestimmte physiologische und ggf. auch nicht physiologische Charakteristika auf, die von der Untersucherin bzw. vom Untersucher erhoben werden können (Abb. 2, Abb. 3). Die erste Ultraschalluntersuchung im Rahmen des Zyklusmonitorings sollte am Zyklusanfang, also am Zyklustag 2–5, erfolgen. Dies ist der richtige Zeitpunkt, um die Eizellreserve der Patientin zu bestimmen, da zu diesem Zeitpunkt die Antralfollikel in den Ovarien «synchronisiert» und dementsprechend gleichmässig gross sein sollten (etwa 2–8mm). Die Untersucherin bzw. der Untersucher zählt hierzu möglichst genau die Anzahl der Eibläschen in beiden Eierstöcken. Die Summe der gezählten Follikel beider Ovarien ergibt dann den sogenannten «antral follicle count (AFC)», welcher relativ gut mit dem sogenannten Anti-Müller-Hormon (AMH) korreliert.4 Das AMH wiederum ist ein laborchemischer Parameter, der zu einer relativ akkuraten Quantifizierung der Eierstockreserve einer Frau herangezogen werden kann.5 Diese nimmt bekanntermassen im Laufe des Lebens einer Frau stetig ab, damit sinkt auch der messbare AFC mit zunehmendem Alter der Patientin.6 Frauen mit polyzystischem Ovarsyndrom (PCOS) haben in der Regel eine ausserordentlich hohe Eizellreserve, diese lässt sich sonografisch an einer charakteristischen, polyzystischen Ovarmorphologie (PCOM) erkennen. Die zahlreichen und verhältnismässig kleinen Antralfollikel sind hier in den Ovarien «perlschnurartig» angeordnet (Abb. 2b).7
Zur sonografischen Fertilitätsabklärung am Zyklusanfang gehören neben der Bestimmung der Eizellreserve einer Frau weitere Untersuchungsaspekte. Diese beinhalten das Vorhandensein von Ovarialzysten, wie z.B. Dermoiden oder Endometriomen. Uterusanatomie und -auffälligkeiten sollten beschrieben werden. Hierbei können z.B. Myome oder eine ausgeprägte Retroflexio uteri von Bedeutung sein. Es sollte auch die Mobilität von Uterus und Adnexen untersucht werden (Stichwörter: «sliding sign» und «kissing ovaries»). Ist diese eingeschränkt und liegt bei der Patientin ein sonopalpatorisch leicht auslösbarer Schmerz im (kleinen) Becken vor, so können sich daraus Hinweise auf eine möglicherweise bestehende Endometriose oder Adenomyose ergeben.8
Die zweite Ultraschalluntersuchung im Rahmen des Zyklusmonitorings sollte in der Zyklusmitte, also etwa am 12. Zyklustag, erfolgen. Der genaue Termin für die mittzyklische Untersuchung muss dem individuellen Zyklus der jeweiligen Frau angepasst werden. Hauptaugenmerk bei dieser Untersuchung sollte auf dem Vorhandensein eines Leitfollikels (dominanter Follikel, etwa 12–20mm) sowie der Endometriumbeschaffenheit liegen. Das durch Östrogeneinfluss proliferierte Endometrium sollte hier eine homogene und trilineare Struktur aufweisen (Abb. 2). Die Endometriumdicke wird bei dieser Gelegenheit in sagittaler Ebene gemessen, sie hat aber eine, auf die Fertilität bezogen, untergeordnete prognostische Aussagekraft – wichtiger sind nach momentaner Datenlage die Endometriumbeschaffenheit und -struktur.9–12
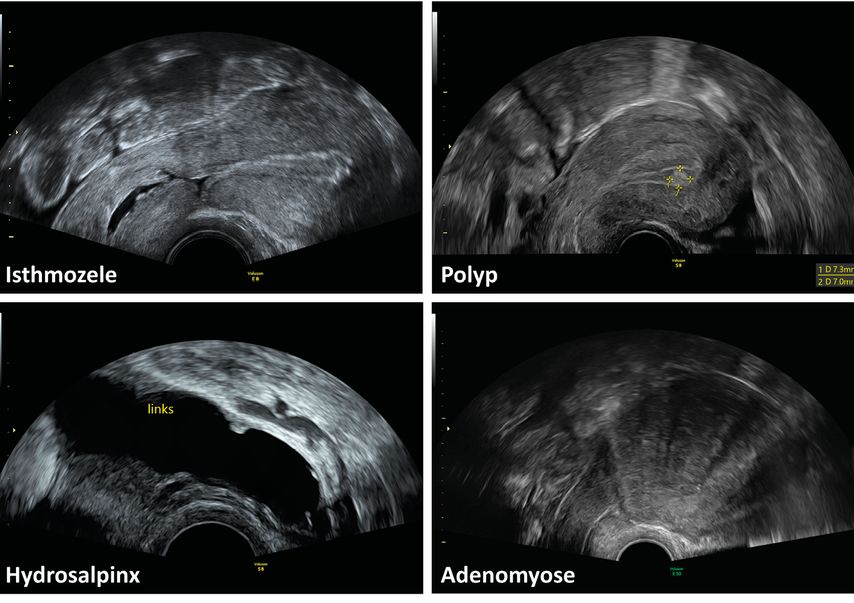
Die mittzyklische bzw. direkt präovulatorische Untersuchung bietet eine ausgezeichnete Gelegenheit, um möglicherweise fertilitätseinschränkende Pathologien von Uterus und Adnexen auszuschliessen bzw. zu erkennen, da die physiologischerweise erhöhten Serumöstrogenspiegel bestimmte Auffälligkeiten «demaskieren». So lassen sich mit Flüssigkeit gefüllte (z.B. Zervixschleim) und damit sonografisch echoleere Strukturen gut abgrenzen und beurteilen. Beispiele hierfür sind die Isthmozele (mit/ohne Serometra) und die Hydrosalpinx. Da das Endometrium zum Zeitpunkt dieser Untersuchung gleichmässig proliferiert sein sollte, lassen sich hier auch bestimmte Strukturveränderungen gut untersuchen. Diese beinhalten z.B. Polypen, submuköse Myome, Restmaterial einer vorangegangenen Schwangerschaft oder Konturveränderungen durch eine Adenomyose. Klassischerweise ist bei Letzterer die Junktionalzone unscharf abgegrenzt und es zeigt sich eine Wandasymmetrie. Weitere charakteristische Zeichen können sein: inhomogen aufgelockertes und ggf. zystisch verändertes Myometrium sowie das sogenannte «fan sign» (Abb. 3).13 Ein Sonderfall der Endometriumpathologien ist das Asherman-Syndrom, das sich durch folgende sonografische Auffälligkeiten zeigen kann: mittzyklisch schmales Endometrium mit unterbrochener Junktionalzone, hyperechogene Inseln, Synechien und Flüssigkeitsansammlungen im Endometrium.14 Besteht der Verdacht auf das Vorliegen eines Asherman-Syndroms, so sollte als nächster Schritt eine Hydrosonografie erfolgen (siehe Abschnitt «Sonografische Zusatzuntersuchungen»).
Optimalerweise sollte zum Zeitpunkt der mittzyklischen Untersuchung noch keine Ovulation stattgefunden haben. Ein sprungreifer Leitfollikel zeigt sich im Ultraschall rund und echoleer sowie glatt begrenzt. Sonografische Zeichen des Eisprungs können sein: Entrundung, freie Flüssigkeit im Douglas sowie intrafollikulär gleichmässig echogene Areale («Ovulationsschleier»).
Als dritte und letzte Untersuchung im Rahmen des Zyklusmonitorings bietet sich (optional) eine Ultraschalluntersuchung in der Lutealphase an (etwa am 20. Zyklustag). Hier sollte ein Gelbkörper mit einem vaskulären «ring of fire» im Doppler-Ultraschall darstellbar sein, das Endometrium hat einen echoreich aufgebauten, «sekretorischen» Charakter (Abb. 2a). Sind diese Kriterien erfüllt, so gilt ein stattgehabter Eisprung als sonografisch bestätigt.
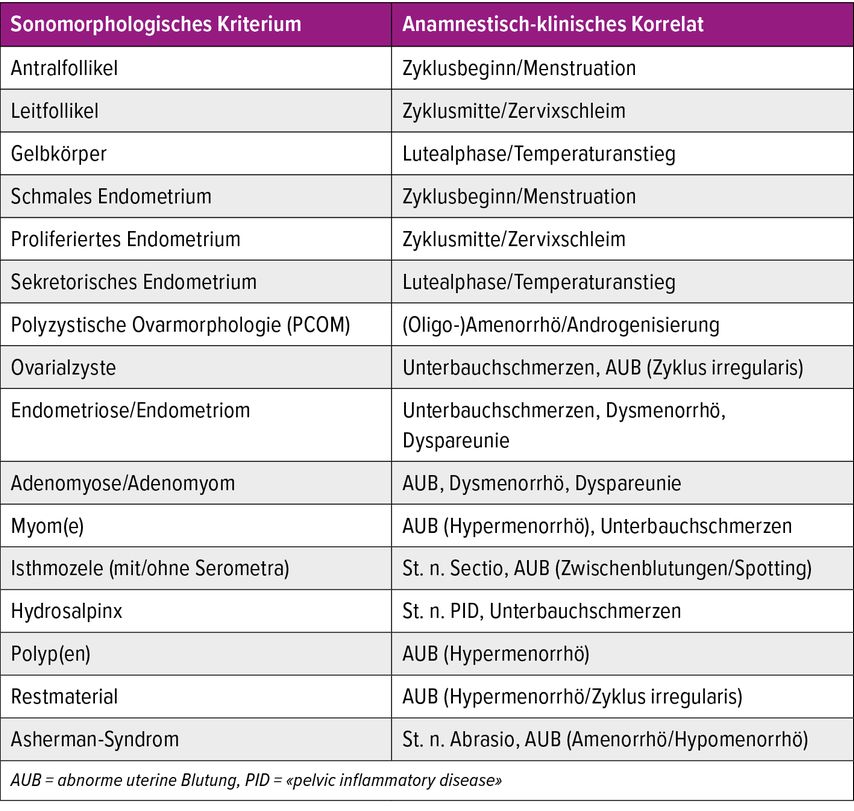
Zu den hier genannten physiologischen und nicht physiologischen, sonomorphologischen Kriterien gibt es anamnestisch-klinische Korrelate, die simultan zur Ultraschalluntersuchung von der Ärztin oder dem Arzt erhoben werden können. Diese können beim Stellen einer Verdachtsdiagnose hilfreich sein (Tab. 1).
Sonografische Zusatzuntersuchungen zur Einschätzung der Fertilität
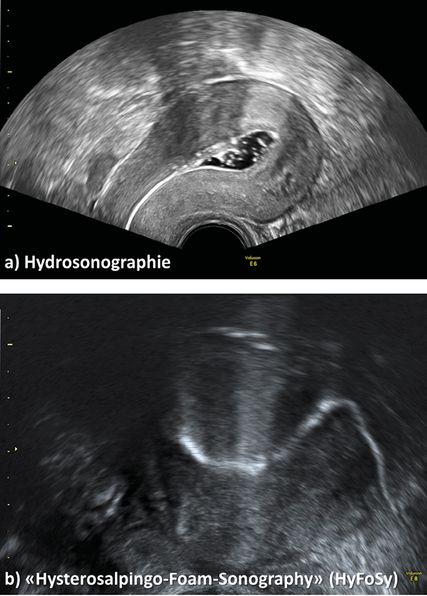
Ergibt sich der anamnestisch-sonografische Verdacht, dass ein submuköses Myom, ein Endometriumpolyp oder ein Asherman-Syndrom vorliegen könnte, so kann eine «Hydrosonografie» ein sinnvoller diagnostischer Folgeschritt sein. Hierbei wird ein dünner (Urin-)Katheter in den Zervikalkanal eingeführt und unter Ultraschallsicht sterile Kochsalzlösung insuffliert. Das Cavum erweitert sich hierbei und schleimhautverändernde Auffälligkeiten können gut beurteilt werden (Abb.4a). Vom Ablauf ähnlich ist die sogenannte «Hysterosalpingo-Schaum-Sonografie», bei welcher anstelle von Kochsalzlösung ein spezieller Schaum unter Ultraschallsicht insuffliert wird, dessen kolloidale Partikel sonografisch echoreich erscheinen. Mit dieser Untersuchung lassen sich bei bestimmter Fragestellung die Eileiter auf ihre Durchgängigkeit prüfen (Abb.4b). Zu guter Letzt gibt es noch den 3D-Ultraschall zu erwähnen, dieser ist besonders in der zweiten Zyklushälfte (Endometrium sekretorisch) zur Diagnose von Uterusanomalien oder -fehlbildungen wertvoll. Es konnte bei der Untersuchung dieser Auffälligkeiten gezeigt werden, dass der 3D-Ultraschall in Hinblick auf die diagnostische Aussagekraft vergleichbar mit der Magnetresonanztomografie (MRT) ist.15
Die Inhalte dieses Artikels waren Thema eines Vortrags beim Jahreskongress der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe, 23.–25. Juni 2022, St. Gallen.
Literatur:
1 Gnoth C: Natural fertility and age. Gynakol Endokrinol 2020; 18(2): 81-7 2 WHO fact sheet on infertility. Glob Reprod Health 2021; 6(1): e52-e52 3 NICHD - Eunice Kennedy Shriver National Institute of Child Health and Human Development. How common is infertility? Published 2018. https://www.nichd.nih.gov/health/topics/infertility/conditioninfo/common 4 Birch Petersen K et al.: Ovarian reserve assessment in users of oral contraception seeking fertility advice on their reproductive lifespan. Hum Reprod 2015; 30(10): 2364-75 5 La Marca A et al.: Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum Reprod Update 2010; 16(2): 113-30 6 Wallace WHB et al.: Human ovarian reserve from conception to the menopause. PLoS One 2010; 5(1): e8772 7 Reid SP et al.: Ovarian morphology is associated with insulin resistance in women with polycystic ovary syndrome: a cross sectional study. Fertil Res Pract 2017; 3(1): 1-7 8 Guerriero S et al.: Ultrasonographic soft markers for detection of rectosigmoid deep endometriosis. Ultrasound Obstet Gynecol 2020; 55(2): 269-73 9 Weiss NS et al.: Endometrial thickness in women undergoing IUI with ovarian stimulation. How thick is too thin? A systematic review and meta-analysis. Obstet Gynecol Surv 2017; 72(8): 484-5 10 Gingold JA et al.: Endometrial pattern, but not endometrial thickness, affects implantation rates in euploid embryo transfers. Fertil Steril 2015; 104(3): 620-28.e5 11 Kasius A et al.: Endometrial thickness and pregnancy rates after IVF: a systematic review and meta-analysis. Hum Reprod Update 2014; 20(4): 530-41 12 Quaas AM et al.: Endometrial thickness after ovarian stimulation with gonadotropin, clomiphene, or letrozole for unexplained infertility, and association with treatment outcomes. Fertil Steril 2021; 115(1): 213-20 13 Munro MG: Uterine polyps, adenomyosis, leiomyomas, and endometrial receptivity. Fertil Steril 2019; 111(4): 629-40 14 Amin TN et al.: Ultrasound and intrauterine adhesions: a novel structured approach to diagnosis and management. Ultrasound Obstet Gynecol 2015; 46(2): 131-9 15 Bermejo C et al.: Three-dimensional ultrasound in the diagnosis of Müllerian duct anomalies and concordance with magnetic resonance imaging. Ultrasound Obstet Gynecol 2010; 35(5): 593-601
Das könnte Sie auch interessieren:
Evidenz, Anwendungen und Realitätscheck
Die Präimplantationsdiagnostik (PGT) hat sich in den vergangenen zwei Jahrzehnten zu einem integralen Bestandteil der assistierten Reproduktionsmedizin entwickelt und bietet Paaren mit ...
Abnorme uterine Blutung in der Adoleszenz
Verstärkte Menstruationsblutungen gehören zu den häufigsten gynäkologischen Beschwerden bei jugendlichen Mädchen. Bei einem relevanten Anteil liegen bisher unerkannte Blutgerinnungs- ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...