Les tests de biomarqueurs sur la voie de l’avenir
Rédaction:
Dre méd. Judith Moser
Auteure:
Prof. Dre méd. Anne Maria Schultheis
Institut für Klinische Pathologie Universitätsklinikum Freiburg
Deutschland
La détection des biomarqueurs constitue un outil central dans le traitement du carcinome pulmonaire. Aujourd’hui, les tests sont également effectués à des stades précoces et permettent, en cas de maladie métastatique, une diversité croissante d’options thérapeutiques. Les défis de la pratique clinique quotidienne et les questions en suspens soulignent la nécessité d’une optimisation continue.
Le cancer du poumon non à petites cellules (CPNPC) est l’exemple parfait d’une maladie diagnostiquée et traitée sur la base des principes de la médecine de précision. Compte tenu des taux de récidive élevés, même aux premiers stades de la maladie, la médecine de précision a également fait son entrée dans ces domaines. Ainsi, les tests de biomarqueurs s’effectuent aussi bien pour le cancer du poumon opérable que pour les stadesIII et IV.
Cadre néoadjuvant et adjuvant
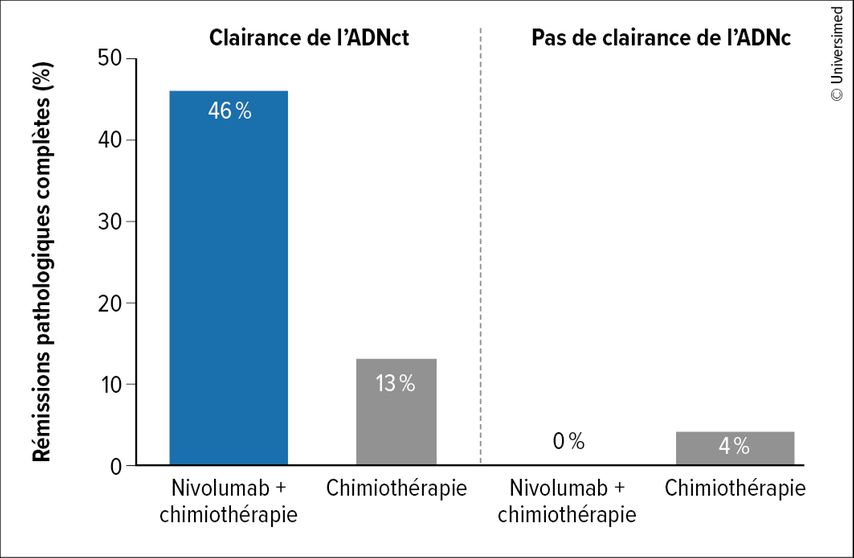
Sur la base de l’étude CheckMate 816, le nivolumab en traitement néoadjuvant a été approuvé en association avec la chimiothérapie dans le traitement du CPNPC résécable exprimant PD-L1 et associé à un risque élevé de récidive.1,2 L’étude a évalué différents biomarqueurs, dont la charge mutationnelle de la tumeur, l’expression de PD-L1 et l’ADN tumoral circulant (ADNc). L’étude a montré que seule l’expression de PD-L1 ≥1% était prédictive de la survie. Il existe une corrélation entre la clairance de l’ADNc et le taux de rémission complète pathologique (Fig. 1), c’est pourquoi des recherches sont actuellement en cours afin d’explorer davantage la valeur de l’analyse de l’ADNc. Dans le domaine des thérapies ciblées, il n’existe pas encore d’autorisations de mise sur le marché en situation néoadjuvante. L’osimertinib est évalué dans le cadre de l’étude NeoADAURA pour les tumeurs résécables EGFR-positives (NCT04351555), et d’autres études cliniques sont actuellement en cours.
Fig.1: Rémissions pathologiques complètes en fonction de la clairance de l’ADNc dans CheckMate 816 (modifiée selon Forde PM et al.)2
En situation adjuvante, l’immunothérapie par atézolizumab ou pembrolizumab, basée sur les études IMpower010 et PEARLS/KEYNOTE-091, a pu être établie comme standard.3,4 Cependant, les deux études manquaient de directives uniformes en ce qui concerne les tests de biomarqueurs (PD-L1, ALK, EGFR). Dans le cas du CPNPC avec mutation d’EGFR, l’étude ADAURA a démontré les avantages cliniques de l’osimertinib en traitement adjuvant.5 Compte tenu de ce qui précède, il est indispensable de déterminer le statut mutationnel d’EGFR dans le CPNPC précoce. Cela s’applique également aux tests des réarrangements d’ALK, car les données de l’étude ALINA montrent le bénéfice de l’alectinib en traitement adjuvant.6 Afin de combiner les avantages du traitement néoadjuvant et du traitement adjuvant, la stratégie de traitement périopératoire est actuellement testée cliniquement. Cependant, les tests de biomarqueurs ne sont pas encore bien établis dans ce cadre.
Aide de l’IA
L’évaluation précise de l’expression de PD-L1 constitue un défi particulier pour les pathologistes. Les scores et les valeurs seuil doivent être pris en compte et l’énorme hétérogénéité de ce paramètre doit être prise en considération. L’intelligence artificielle contribuera certainement à améliorer les processus dans un avenir proche. L’évaluation de la régression tumorale suite au traitement néoadjuvant n’est pas non plus une tâche facile, mais des critères établis, définis par l’International Association for the Study of Lung Cancer, peuvent aider.7 Il faut toutefois s’assurer que tous les pathologistes utilisent effectivement ces critères lors de l’évaluation des échantillons après un traitement néoadjuvant.
Dans l’ensemble, on peut dire que les tests de biomarqueurs se sont établis dans le domaine du cancer du poumon précoce. Le panel doit au moins inclure l’expression de PD-L1 ainsi que le statut d’ALK et d’EGFR. La question de savoir si un test complet est déjà recommandé au moment du diagnostic d’un cancer du poumon précoce fait l’objet de discussions.
Au stadeIII, extrêmement hétérogène, il n’existe que peu de preuves pour un traitement basé sur des biomarqueurs, raison pour laquelle les décisions doivent être prises de manière interdisciplinaire. L’étude LAURA sur l’utilisation de l’osimertinib après la chimioradiothérapie de tumeurs résécables avec mutation d’EGFR fournit un exemple de traitement basé sur des biomarqueurs réussi.8 L’analyse de l’ADNc pourrait devenir un outil précieux pour le suivi de la réponse à l’immunothérapie de consolidation au stadeIII.9
Les pierres d’achoppement au stadeIV
Pour l’importante population de patient·es au stadeIV, il existe un groupe de thérapies ciblées en constante augmentation. Les pathologistes sont ici confrontés à la difficulté de devoir examiner de petites biopsies tissulaires avec plusieurs analyses, sous des contraintes de temps. Les méthodes basées sur des panels, qui comprennent des stratégies de «fast track» dans le cadre desquelles les marqueurs les plus importants pour le traitement de première ligne sont évalués en l’espace de 1 à 3 jours, s’avèrent être une économie de temps et de tissus.10
Ce n’est que récemment qu’une attention particulière a été accordée, par exemple, aux insertions de l’exon 20 de l’EGFR et aux mutations d’HER2, car des médicaments ciblés sont désormais disponibles. Dans le domaine des inhibiteurs de points de contrôle, l’expression de PD-L1 et la charge mutationnelle de la tumeur ne sont pas des marqueurs parfaits en termes de prédiction, comme on le sait. Des combinaisons des mutations STK11, KEAP1 et KRAS ont été associées à une diminution de la réponse à l’immunothérapie.11
Le plus grand défi dans le contexte de la médecine de précision résulte du fait qu’une partie substantielle des patient·es atteint·es de CPNPC ne sont pas testés du tout ou, même en présence d’un résultat de test, ne reçoivent pas toujours un traitement ciblé correspondant.12 En Allemagne, un vaste réseau a été mis en place au sein duquel tous·tes les patient·es atteint·es de CPNPC peuvent être testé·es. Malheureusement, la nécessité du dépistage est mal connue, surtout aux stades précoces, ce qui se traduit par des taux de dépistage encore faibles.13
Conclusion
En résumé, il convient de souligner la place des tests de biomarqueurs comme outil indispensable dans le cancer du poumon. Nous devons concevoir des panels «intelligents» qui nous permettent d’obtenir des résultats avec peu de tissus et dans des délais serrés. Je pense que l’ADNc s’imposera comme un biomarqueur précieux, en particulier dans le contexte du suivi, et que les outils basés sur l’IA faciliteront la standardisation et l’évaluation de marqueurs tels que l’expression de PD-L1. Je considère que la tâche la plus importante est la formation continue de nos collègues sur la nécessité de tester les biomarqueurs chez les patient·es atteint·es de CPNPC, même à un stade précoce.
Littérature:
1 Fachinformation Opdivo® 2 Forde PM et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022; 386(21): 1973-85 3 Felip E et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021; 398(10308): 1344-57 4 O’Brien M et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022; 23(10): 1274-86 5 Wu YL et al.: Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med 2020; 383(18): 1711-23 6 Wu YL et al.: Alectinib in resected ALK-positive non-small-cell lung cancer. N Engl J Med 2024; 390(14): 1265-76 7 Travis WD et al.: IASLC multidisciplinary recommendations for pathologic assessment of lung cancer resection specimens after neoadjuvant therapy. J Thorac Oncol 2020; 15(5): 709-40 8 Lu S et al.: Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024; 391(7): 585-97 9 Jun S et al.: Analysis of circulating tumor DNA predicts outcomes of short-course consolidation immunotherapy in unresectable stage III NSCLC. J Thorac Oncol 2024; 19(10): 1427-37 10 Yang SR, Schultheis AM et al.: Precision medicine in non-small cell lung cancer: Current applications and future directions. Semin Cancer Biol 2022; 84: 184-198 11 Ricciuti B et al.: Diminished efficacy of programmed death-(ligand)1 inhibition in STK11- and KEAP1-mutant lung adenocarcinoma is affected by KRAS mutation status. J Thorac Oncol 2022; 17(3): 399-410 12 Sadik K et al.: Impact of clinical practice gaps on the implementation of personalized medicine in advanced non-small-cell lung cancer. JCO Precis Oncol 2022; 6: e2200246 13 Loges S et al.: Aktuelle Umfrage zur Testbereitschaft in frühen und späten Stadien des NSCLC. Journal Onkologie 5/2024. https://www.journalonko.de/artikel/lesen/umfrage-testbereitschaft-nsclc-deutschland . Abgerufen November 2024
Das könnte Sie auch interessieren:
Redéfinition de la résécabilité à l’ère de l’immunothérapie
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...