Immunologische Aspekte bei Spätgestosen
Autorin:
Priv.-Doz. Dr. Karoline Mayer-Pickel
Abteilung für Geburtshilfe Universitätsklinik für Geburtshilfe und Frauenheilkunde, Medizinische Universität Graz
E-Mail: karoline.pickel@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Für eine intakte Schwangerschaft müssen optimale Voraussetzungen sowohl auf der maternalen als auch auf der fetoplazentaren Seite vorhanden sein. Kommt es zu Abweichungen, sind die Bedingungen für eine intakte Schwangerschaft nicht mehr gegeben und Komplikationen der Früh- und Spätschwangerschaft sind die Folge.
I Während der Schwangerschaft kommt es zu einer ganz gezielten und aktiven Anpassung des maternalen Immunsystems; diese findet nicht nur an der fetomaternalen Grenzzone statt, sondern auch systemisch. Zusätzlich ist die Adaptierung des maternalen Immunsystems kein konstanter Prozess, sondern unterliegt einer Dynamik. Mit der Implantation des Embryos und der damit einhergehenden Plazentation besteht eine für die Zelldifferenzierung notwendige primäre Immunaktivierung und systemische Inflammation, die von einer anhaltenden Periode der Immuntoleranz und „Antiinflammation“ abgelöst wird. Diese Phase ist entscheidend für die fetale Entwicklung sowie Verhinderung der Abstoßung des Feten. Gegen Ende der Schwangerschaft kommt es erneut zu einer gesteigerten Inflammation, welche für die Einleitung der Geburt notwendig ist.1
Für eine intakte Schwangerschaft müssen optimale Voraussetzungen sowohl auf der maternalen als auch auf der fetoplazentaren Seite vorhanden sein; so müssen die Trophoblastinvasion sowie die Plazentation regelrecht bzw. adäquat sein und der Embryo bzw. Fetus muss vom maternalen Immunsystem akzeptiert werden.2 Kommt es zu Abweichungen, sind die Bedingungen für eine intakte Schwangerschaft nicht mehr gegeben und Komplikationen der Früh- und Spätschwangerschaft sind die Folge.
Ätiologische Faktoren
Die genauen Ursachen der Präeklampsie sind immer noch unklar; Fakt ist, dass es sich nicht um eine „einzelne“ Erkrankung handelt, sondern vielmehr um ein Syndrom, welches mehrere Organe betrifft und durch eine systemische Endotheldysfunktion charakterisiert ist.3 Zahlreiche und manchmal überlappende pathophysiologische Mechanismen führen zu einem Aktivierungsprozess, bestehend aus gesteigerter Endothelzellaktivierung, intravaskulärer Inflammation und syncytiotrophoblastärem Stress und in weiterer Folge klinischer Manifestation.4
Zu den bekannten ätiologischen Faktoren gehören Autoimmunerkrankungen sowie metabolische Erkrankungen.
Autoimmunerkrankungen
Die während der Schwangerschaft notwendigen Veränderungen des mütterlichen Immunsystems können sich sowohl positiv als auch negativ auf eine Autoimmunerkrankung der Schwangeren auswirken. Zusätzlich kann eine erhöhte Krankheitsaktivität in der Schwangerschaft zu vermehrten maternalen und fetalen/neonatalen Risiken führen.
-
Antiphospholipidsyndrom
Das Antiphospholipidsyndrom (APS) wird durch das Auftreten von venösen und/oder arteriellen Thrombosen bzw. geburtshilflichen Komplikationen der Früh- und Spätschwangerschaft sowie dem 2-maligen Nachweis von mindestens einem Antiphospholipid-Antikörper (aPl) definiert. Frauen mit einem APS haben ein erhöhtes Risiko, eine Präeklampsie vor der 34. Schwangerschaftswoche zu entwickeln. Diese kann teilweise einen besonders schweren Verlauf haben und sogar vor der „Lebensreife“ auftreten.5–8 Die Rate, eine Präeklampsie zu entwickeln, liegt laut Literatur zwischen 20 und 50%.9–15 Das APS und die Präeklampsie haben zum größten Teil ähnliche pathophysiologische Mechanismen; eine Assoziation zwischen diesen beiden Entitäten ist daher nicht überraschend. Chronische systemische inflammatorische Prozesse (u.a. vermehrte Freisetzung proinflammatorischer Zytokine), eine gesteigerte Komplementaktivierung mit einer konsekutiven Dysbalance angiogener Faktoren (sFlt-1, PlGF) sowie einer direkt hemmenden Wirkung der aPL auf Plazentation und Trophoblastinvasion spielen dabei eine entscheidende Rolle.16–19
-
Systemischer Lupus erythematodes
Der systemische Lupus erythematodes (SLE) kann in der Schwangerschaft zu Komplikationen wie Abort, intrauterinem Fruchttod, fetaler Wachstumsrestriktion oder Präeklampsie führen20, wobei gewisse prognostisch ungünstige Fakoren eine große Rolle spielen; so sind ein aktiver SLE (weniger als 6 Monate präkonzeptionell bzw. während der Schwangerschaft), eine aktive Lupusnephritis, Proteinurie, Hypertonie, Thrombozytopenie sowie das Vorhandensein von aPl besonders mit Komplikationen im Schwangerschaftsverlauf assoziiert.21,22 Das allgemeine Risiko für das Auftreten einer Präeklampsie bei SLE wird in der Literatur mit 13–35% angegeben. 20,23
Die pathophysiologischen Mechanismen sind ähnlich dem APS: Eine gesteigerte Komplementaktivierung sowie das Vorhandensein von „neutrophil extracellular traps“/NETs mit einer konsekutiven Dauerstimulation des Immunsystems sowie einer gesteigerten Autoimmunreaktion führen v.a. zu einer gesteigerten Produktion von proinflammatorischen Zytokinen sowie in weitere Folge zu einer angiogenen Dysbalance.24
Frauen mit SLE haben im Allgemeinen ein 5-fach erhöhtes Risiko für kardiovaskuläre Erkrankungen im höheren Lebensalter. Laut Literatur besteht eine Assoziation zwischen Plazentadysfunktion und einem erhöhten kardiovaskulären Risiko; so haben Frauen mit SLE und einer Präeklampsie in der Anamnese ein 2,2-fach erhöhtes Mortalitätsrisiko, in Kombination mit einer Frühgeburtlichkeit vor der 34. SSW erhöht sich dieses Risiko auf das 2,5-Fache.25
Metabolisches Syndrom
Insbesondere ein präkonzeptionell erhöhter BMI ist mit zum Teil schwerwiegenden Komplikationen der Schwangerschaft assoziiert. So erhöht sich das Risiko für eine Präeklampsie 6-fach, eine schwangerschaftsinduzierte Hypertonie (SIH) 3-fach und einen Gestationsdiabetes 5-fach.
Die Entstehung einer Präeklampsie im Rahmen des metabolischen Syndroms kann am ehesten durch 3 Effekte erklärt werden:26 1. der „mechanische“ Effekt durch die Akkumulation des viszeralen Fettgewebes mit einem daraus resultierenden Anstieg des intraabdominellen Drucks und einer Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS) mit sekundärer Hypertonie, 2. der „metabolische“ Effekt durch die periphere Insulinresistenz und Hyperinsulinismus, welcher zu einer vermehrten Sekretion von proinflammatorischen Substanzen führt. Diese systemischen inflammatorischen Prozesse nehmen Einfluss auf die Gefäßreaktivität, Thrombogenese, Angiogenese sowie auf die Insulinsensitivität.27–29 Schlussendlich kommt es kumulativ 3. zu einer Endotheldysfunktion mit u.a. einer vermehrten Freisetzung antiangiogener Faktoren.
Eine Gemeinsamkeit von Präeklampsie und metabolischem Syndrom ist das erhöhte Risiko für kardiovaskuläre Erkrankungen sowie Adipositas des Kindes und der Mutter. Insbesondere die maternale Adipositas dürfte beim Kind durch ein „fetal programming“ in utero die Entwicklung eines metabolischen Syndroms im Erwachsenenalter begünstigen.
Weitere Behandlung bzw. Betreuung
Während der Schwangerschaft
Aufgrund des erhöhten Risikos für eine Präeklampsie bei Frauen mit SLE und APS sollte so früh wie möglich (spätestens bei 16+0 Schwangerschaftswoche) mit einer Prophylaxe mit T-ASS 150mg 1x1 (bis zur vollendeten 37. Schwangerschaftswoche) begonnen werden. Frauen mit APS sollen zusätzlich niedermolekulares Heparin (NMH) bis zur Entbindung sowie bis 8 Wochen postpartum erhalten; dieses sollte bei Thrombosen in der Anamnese in therapeutischer Dosierung sein, ohne Thrombosen reicht eine prophylaktische Dosierung.30
Frauen mit SLE sollen die bereits begonnene Basistherapie mit Hydroxychloroquin in der Schwangerschaft fortführen; die Rate von SLE-Schüben in der Schwangerschaft kann dadurch gesenkt werden.30
Bei Frauen mit einem BMI >35kg/m2 sollte eine Prophylaxe mit T-ASS 150mg 1x1 bis zur vollendeten 37. Schwangerschaftswoche erfolgen.31,32
Nach der Schwangerschaft ist vor der (nächsten) Schwangerschaft
Frauen nach einer Präeklampsie haben lebenslang ein erhöhtes Risiko für kardiovaskuläre und metabolische Erkrankungen. Auch der Fetus erfährt durch das „gestörte“ intrauterine Milieu eine Prägung, die langfristig die gesundheitliche Entwicklung beeinflussen kann („fetale Programmierung“). Komplikationen wie Frühgeburtlichkeit und Wachstumsrestriktion stellen per se isolierte Risikofaktoren für z.B. arterielle Hypertonie und andere kardiovaskuläre Erkrankungen dar. Kinder von Müttern mit Präeklampsie haben im Jugendalter einen höheren Blutdruck und ein höheres Infarktrisiko im späteren Leben sowie ein höheres Risiko für kardiovaskuläre und metabolische Erkrankungen.
Da eine Präeklampsie nicht nur substanziell zur perinatalen Morbidität und Mortalität für Mutter und Kind beiträgt, sondern auch – wie bereits erwähnt – beträchtliche gesundheitliche Langzeitfolgen für beide bewirken kann, sollte daher bei Frauen, die ein erhöhtes Präeklampsierisiko haben, eine präkonzeptionelle sowie postpartale präventive Beratung erfolgen.
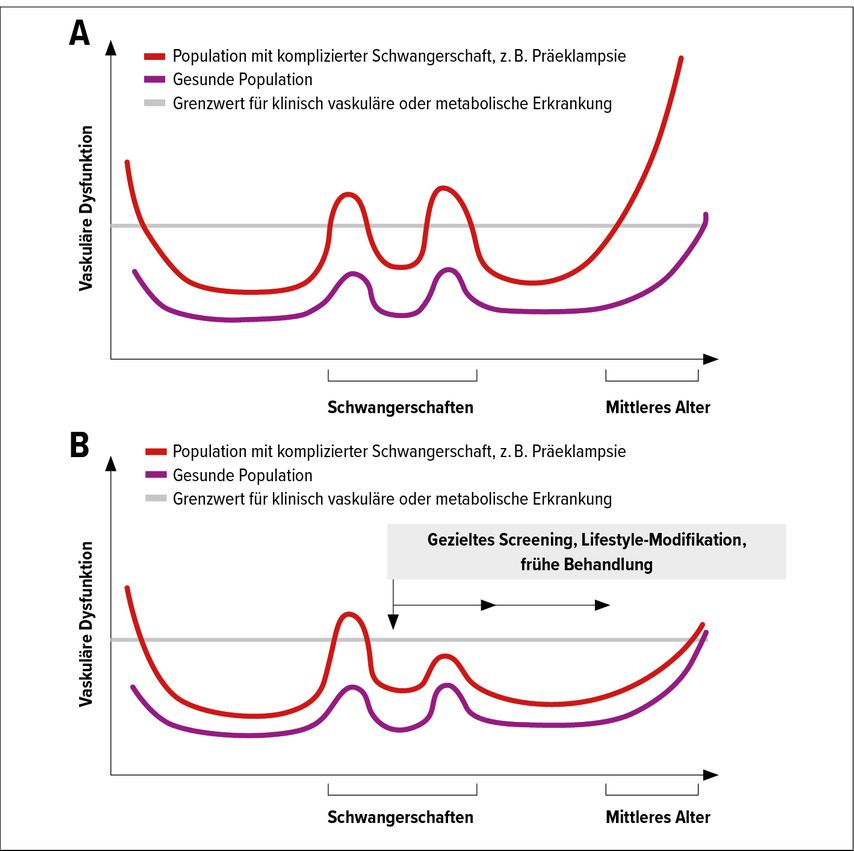
Eine Schwangerschaft, auch eine unauffällige, kann als eine Art „Stresstest“ vor allem für das Gefäßsystem betrachtet werden. Bei Komplikationen während der Schwangerschaft, insbesondere durch eine Präeklampsie ist diese „Belastung“ der Gefäße um ein Deutliches höher. Aufgrund dessen sollten daher präventive und therapeutische Maßnahmen im Schwangerschaftsverlauf gesetzt werden, um diese Situation etwas zu entschärfen bzw. zu verbessern.
Es konnte nämlich gezeigt werden, dass eine Gefäßdysfunktion durch z.B. Life-style-Modifikation, gezieltes (Präeklampsie, metabolisch) Screening sowie eine frühzeitige Therapie deutlich verbessert werden kann (Abb. 1).33
Abb. 1: „Pregnancy is a ‚stress test‘ that can reveal subclinical trajectories and identify new opportunities for chronic disease prevention.“ Nach Rich-Edwards JW et al.33
Zusammenfassung
Frauen mit APS, SLE und metabolischem Syndrom haben ein signifikant erhöhtes Risiko für eine Plazentadysfunktion. Daher sollten für ein verbessertes Schwangerschaftsoutcome eine optimierte präkonzeptionelle Beratung (u.a. Lifestyle-Modifikation) sowie eine optimierte interdisziplinäre Betreuung im Schwangerschaftsverlauf erfolgen.
Eine Assoziation zwischen Plazentadysfunktion und erhöhtem kardiovaskulärem Risiko im späteren Leben bei Mutter und Kind wurde bereits mehrfach beschrieben. Daher sollte eine Schwangerschaft als „Fenster“ für mögliche zukünftige kardiovaskuläre oder metabolische Erkrankungen bei Mutter und Kind betrachtet werden, um in weiterer Folge durch regelmäßiges Follow-up, Prävention bzw. frühzeitige Intervention die langfristige kardiometabolische Morbidität und Mortalität von Mutter und Kind positiv zu beeinflussen.
Literatur:
1 Mor G et al.: The unique immunological and microbial aspects of pregnancy. Nat Rev Immunol 2017; 17(8): 469-82 2 Arck PC and Hecher K: Fetomaternal immune cross-talk and its consequences for maternal and offspring’s health. Nat Med 2013; 19(5): 548-56 3 Young BC et al.: Pathogenesis of preeclampsia. Annu Rev Pathol 2010; 5: 173-92 4 Jung E et al.: The etiology of preeclampsia. Am J Obstet Gynecol 2022; 226(2s): S844-s66 5 Le Thi Thuong D et al.: The HELLP syndrome in the antiphospholipid syndrome: retrospective study of 16 cases in 15 women. Ann Rheum Dis 2005; 64(2): 273-8 6 Appenzeller S et al.: HELLP syndrome and its relationship with antiphospholipid syndrome and antiphospholipid antibodies. Semin Arthritis Rheum 2011; 41(3): 517-23 7 Branch DW et al.: The association of antiphospholipid antibodies with severe preeclampsia. Obstet Gynecol 1989; 73(4): 541-5 8 Mayer-Pickel K et al.: Preeclampsia before fetal viability in women with primary antiphospholipid syndrome- materno-fetal outcomes in a series of 7 cases. J Reprod Immunol 2020; 138: 103101 9 Branch DW et al.:. Obstetric complications associated with the lupus anticoagulant. N Engl J Med 1985; 313(21): 1322-6 10 Branch DW et al.: Outcome of treated pregnancies in women with antiphospholipid syndrome: an update of the Utah experience. Obstet Gynecol 1992; 80(4): 614-20 11 Caruso A et al.: Pregnancy outcome in relation to uterine artery flow velocity waveforms and clinical characteristics in women with antiphospholipid syndrome. Obstet Gynecol 1993; 82(6): 970-7 12 Lima F et al.: A study of sixty pregnancies in patients with the antiphospholipid syndrome. Clin Exp Rheumatol 1996; 14(2): 131-6 13 Lockshin MD et al.: Prediction of adverse pregnancy outcome by the presence of lupus anticoagulant, but not anticardiolipin antibody, in patients with antiphospholipid antibodies. Arthritis Rheum 2012; 64(7): 2311-8 14 Huong DL et al.: A study of 75 pregnancies in patients with antiphospholipid syndrome. J Rheumatol 2001; 28(9): 2025-30 15 Pauzner R et al.: Low molecular weight heparin and warfarin in the treatment of patients with antiphospholipid syndrome during pregnancy. Thromb Haemost 2001; 86(6): 1379-84 16 De Wolf F et al.: Decidual vasculopathy and extensive placental infarction in a patient with repeated thromboembolic accidents, recurrent fetal loss, and a lupus anticoagulant. Am J Obstet Gynecol 1982; 142(7): 829-34 17 Stone S et al.: The placental bed in pregnancies complicated by primary antiphospholipid syndrome. Placenta 2006; 27(4-5): 457-67 18 Mulla MJ et al.: Antiphospholipid antibodies induce a pro-inflammatory response in first trimester trophoblast via the TLR4/MyD88 pathway. Am J Reprod Immunol 2009; 62(2): 96-111 19 Ulrich V et al.: ApoE Receptor 2 mediation of trophoblast dysfunction and pregnancy complications induced by antiphospholipid antibodies in mice. Arthritis Rheumatol 2016; 68(3): 730-9 20 Peart E and Clowse ME: Systemic lupus erythematosus and pregnancy outcomes: an update and review of the literature. Curr Opin Rheumatol 2014; 26(2): 118-23 21 Clowse MEB et al.: The prevention, screening and treatment of congenital heart block from neonatal lupus: a survey of provider practices. Rheumatology (Oxford) 2018; 57(suppl_5): v9-v17 22 Lateef A and Petri M: Managing lupus patients during pregnancy. Best Pract Res Clin Rheumatol 2013; 27(3): 435-47 23 Mankee A et al.: Lupus anticoagulant, disease activity and low complement in the first trimester are predictive of pregnancy loss. Lupus Sci Med 2015; 2(1): e000095 24 Castellanos Gutierrez AS et al.: Placental damage in pregnancies with systemic lupus erythematosus: A narrative review. Front Immunol 2022; 13: 941586 25 Soh MC et al.: Maternal-placental syndrome and future risk of accelerated cardiovascular events in Parous Swedish women with systemic lupus erythematosus - a population-based retrospective cohort study with time-to-event analysis. Rheumatology (Oxford) 2016; 55(7): 1235-42 26 Mauricio MD et al.: Endothelial dysfunction in morbid obesity. Curr Pharm Des 2013; 19(32): 5718-29 27 Berg AH and Scherer PE: Adipose tissue, inflammation, and cardiovascular disease. Circ Res 2005; 96(9): 939-49 28 Henson MC and Castracane VD: Leptin in pregnancy. Biol Reprod 2000; 63(5): 1219-28 29 Laivuori H et al.: Leptin during and after preeclamptic or normal pregnancy: its relation to serum insulin and insulin sensitivity. Metabolism 2000; 49(2): 259-63 30 Andreoli L et al.: EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017; 76(3): 476-85 31 Tan MY et al.: Prediction and prevention of small-for-gestational-age neonates: evidence from SPREE and ASPRE. Ultrasound Obstet Gynecol 2018; 52(1): 52-9 32 Roberge S et al.: Prevention of perinatal death and adverse perinatal outcome using low-dose aspirin: a meta-analysis. Ultrasound Obstet Gynecol 2013; 41(5): 491-9 33 Rich-Edwards JW et al:. Breathing life into the lifecourse approach: pregnancy history and cardiovascular disease in women. Hypertension 2010; 56(3): 331-4
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Operative Therapie und Risikoreduktion bei BRCA-Mutations-Trägerinnen
Familiäre Krebserkrankungen, besonders durch pathogene Genveränderungen bedingt, sind vermehrt in den Fokus der Forschung gerückt. Dies zeigt sich vor allem bei Brustkrebs (BC). Das ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...