Gestationsdiabetes – ein Update
Autorinnen:
Dr. med. Ladina Vonzun
Dr. med. Dalia Balsyte
Klinik für Geburtshilfe
Universitätsspital Zürich
E-Mail: ladina.vonzun@usz.ch
Der Gestationsdiabetes ist eine der häufigsten Erkrankungen der Schwangerschaft und geht mit Kurz- und Langzeitfolgen für Mutter und Kind einher. Eine ausführliche Beratung bezüglich Diät und physischer Aktivität sowie Blutzuckereinstellung verbessert das Outcome beider. Im Folgenden werden daher das Screening, die optimale Betreuung und die Prävention während und nach der Schwangerschaft dargelegt.
Der Gestationsdiabetes (GDM) ist eine Glukosetoleranzstörung, welche erstmals in der Schwangerschaft diagnostiziert wird. Er betrifft zwischen 5% und 25% aller Schwangeren, die Häufigkeit nimmt weltweit tendenziell zu.1 Dies ist einerseits auf die Wahl der Screeningsmethode mit unterschiedlichen Schwellenwerten, andererseits auf die Veränderung des Lebensstils unserer Gesellschaft und Ethnie zurückzuführen. In der Schweiz ist die Prävalenz des GDM rund 11%.2 Die wichtigsten Risikofaktoren sind, analog denen bei Diabetes Typ 2 (DM 2), Übergewicht und insbesondere Adipositas ab einem BMI von 30kg/m2 (OR 1,97–5,55),3 die Ethnie (Südostasien, Lateinamerika, Afrika), aber auch höheres mütterliches Alter, körperliche Inaktivität, Syndrom der polyzystischen Ovarien, St.n. GDM und/oder Geburt eines makrosomen Kindes sowie eine familiäre Belastung in der Verwandtschaft ersten Grades.
Der pathophysiologische Hintergrund des GDM liegt in einer physiologischen Zunahme der Insulinresistenz im 2. und 3. Trimester. Unter normalen Umständen kommt es zu einer Steigerung der Insulinsekretion, um diesen relativen Insulinmangel zu kompensieren und eine Normoglykämie zu gewährleisten. Beim GDM ist diese Regulation gestört.
Risiken für Mutter und Kind
Frauen mit GDM haben ein erhöhtes Risiko, eine Präeklampsie zu entwickeln (9,8–18%), werden häufiger per Kaiserschnitt entbunden (17–25%) und haben häufiger hochgradige Geburtsverletzungen. Das Risiko für eine gestörte Glukosetoleranz ist in den ersten drei Jahren nach der Geburt um das 2,79-Fache erhöht.4 Zudem entwickeln bis zu 70% der Frauen mit GDM in den 20–30 darauffolgenden Jahren einen DM 2.1
Für den Feten bzw. das Kind von Frauen mit GDM steigt das Risiko für eine diabetische Fetopathie mit Makrosomie, verzögerter Lungenreifung, neonataler Hypoglykämie und Hyperbilirubinämie. Die HAPO-Studie (Hyperglycemia and Adverse Pregnancy Outcome) hat für diese Komplikationen einen direkten Zusammenhang mit den mütterlichen Glukosewerten zeigen können.5 GDM geht zudem mit einem erhöhten Risiko für intrauterinen Fruchttod (IUFT) einher, hier wird der direkte Zusammenhang mit den Glukosewerten jedoch noch debattiert.6 Auch Langzeitfolgen wie DM 2 und Adipositas kommen bei Kindern von Frauen mit GDM häufiger vor.7,8 Insbesondere unter der Kombination von mütterlicher Adipositas und GDM, als unabhängigen Faktoren, zeigt sich das höchste Risiko für Adipositas in der Kindheit.9
Screening
Ziel des Screenings ist die frühestmögliche Entdeckung des GDM bei asymptomatischen Patientinnen, damit eine Überwachung und ggf. Therapie gestartet werden können und die Komplikationsrate gesenkt werden kann. Nach der Publikation der HAPO-Studie haben die meisten Guidelines, darunter auch die der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe (SGGG), den oralen Glukosetoleranztest (oGTT) 75g mit den durch die International Association of the Diabetes and Pregnancy Study Groups (IADPSG) empfohlenen strengeren Schwellenwerten übernommen. Einige Länder bevorzugen weiterhin das Screening im Zweischrittverfahren,1,10 obwohl dieses Vorgehen als mehr Zeit konsumierend, unangenehmer für die Patientinnen und teurer gilt. In letzter Zeit häufen sich nun die Stimmen, welche den Nutzen des strengeren Screeningverfahrens bezweifeln. Eine kürzlich im NEJM publizierte Studie hat die ein- und zweizeitige Screeningsmethode verglichen und konnte zeigen, dass mittels des einzeitigen Verfahren fast doppelt so viele GDM-Diagnosen gestellt wurden (16,5% vs. 8,5%), ohne dass es jedoch signifikante Unterschiede in der Komplikationsrate gab.11Hauptproblem in dieser Diskussion ist, dass die HAPO-Studie gezeigt hat, dass die Komplikationsrate kontinuierlich mit dem Glukosespiegel der Mutter ansteigt. Die definierten Grenzwerte für einen GDM sind arbiträr und eine echte Diagnose GDM gib es somit eigentlich gar nicht. Viel besser wäre es, die Massnahmen zur Kontrolle des Glukosestoffwechsels fliessend dem Blutzuckerspiegel der Mutter anzupassen. Mit anderen Worten: Relevant ist nicht, ob jemand das Etikett GDM hat oder nicht, sondern wie dieser mit geringem Aufwand kontrolliert werden kann.
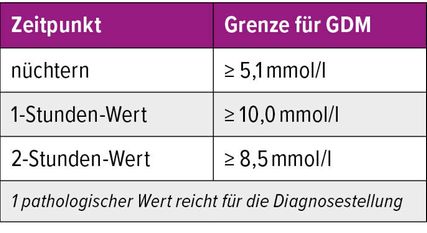
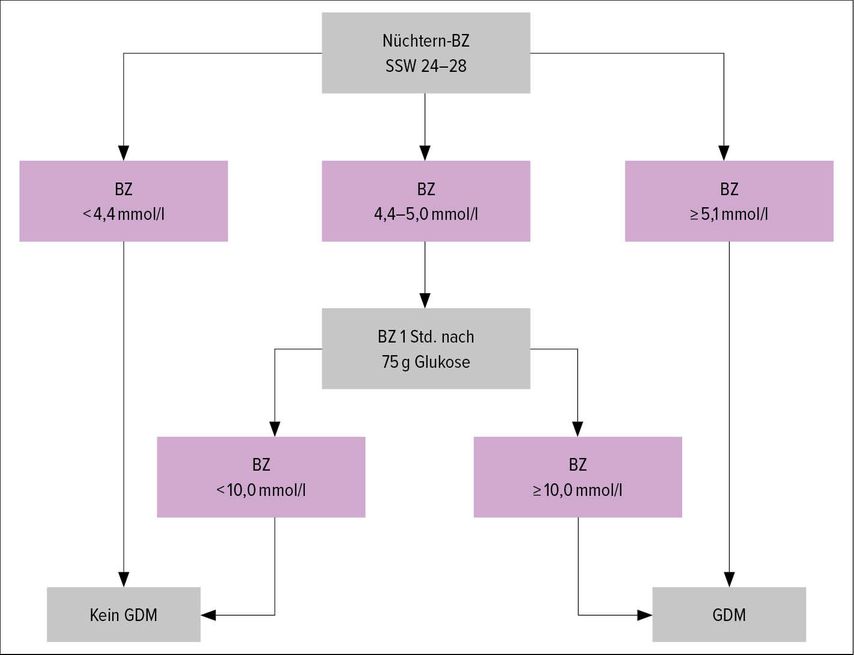
In der Schweiz wird das Screening mittels Durchführung eines oGTT mit 75g Glukose zwischen Schwangerschaftswoche (SSW) 24 und 28 empfohlen. Die Schwellenwerte sind in Tabelle 1 dargestellt. Ein einziger pathologischer Wert genügt für die Diagnosestellung.12 Liegen die Laborwerte schnell genug vor, kann ein sequenzielles Screening durchgeführt werden, d.h., es müssen sich nur diejenigen Frauen dem oralen Belastungstest unterziehen, bei denen der Nüchternblutzuckerwert zwischen 4,4 und 5,0mmol/l liegt (Sensibilität 95%). Wird beim sequenziellen Screening zudem auf den 2-h-Wert verzichtet, reduziert sich die Sensibilität auf 87%.
Diese abgekürzte Methode ist von der SGGG anerkannt und hat sich am USZ als sehr patientinnenfreundlich erwiesen und gut bewährt (Abb.1).2,13 In Anbetracht der obigen Diskussion ist der Verlust an Sensibilität durchaus vertretbar. Mittlerweile gibt es auch Studien, die das GDM-Screening bereits ab der 20. SSW empfehlen, da die Beschleunigung des fetalen Wachstums bereits ab diesem Zeitpunkt beobachtbar ist.14
Bestehen die oben beschriebenen Risikofaktoren oder auch eine Glukosurie, empfiehlt es sich, bereits im ersten Trimester ein Screening durchzuführen, um einen möglichen vorbestehenden DM zu entdecken. Nüchternblutzuckerwerte ≥7mmol/l, HbA1c >6,5% oder Gelegenheitszucker ≥11,1mmol/l bestätigen einen bereits bestehenden DM. Ohne Risikofaktoren wird das Testen des GDM in der Frühschwangerschaft aufgrund fehlender Datenlage zur Verbesserung des Outcomes momentan nicht empfohlen.15 Ein Screening mittels HbA1c-Bestimmung ist nicht empfohlen, da dieses in der Schwangerschaft insgesamt niedriger und vom Hämoglobinwert abhängig ist, zudem gibt es keinen klaren Schwellenwert für den GDM.16
Nach bariatrischen Operationen darf wegen des Risikos eines Dumping-Syndroms kein oGTT durchgeführt werden. In diesen Fällen erfolgt die Diagnostik anhand des Nüchternblutzuckerwertes und eines Blutzuckertagesprofils, welches für 1–2 Wochen geführt werden soll.10
Ein verpasster oGTT kann jederzeit nachgeholt werden, allerdings ist der Therapieeinfluss geringer, je später eine allfällige Diagnose gestellt wird. Findet die erste Schwangerschaftsuntersuchung sehr spät statt (z.B. nach der 36. SSW), kann eine BZ-Bestimmung nüchtern (≥7,0mmol/L) und/oder postprandial (≥11,1mmol/L) genügen. Auch eine späte Diagnose kann für das peri- und postpartale Management von Nutzen sein. Bei sonografischen Auffälligkeiten (Makrosomie, Polyhydramnion) kann ein oGTT jederzeit wiederholt werden.
Therapie und Schwangerschaftskontrollen bei GDM
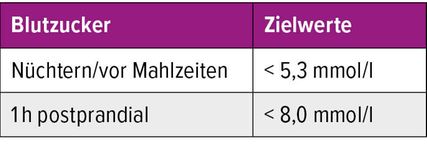
Ziel der GDM-Therapie ist es, die oben genannten Komplikationen für Mutter und Kind zu vermeiden. Die wichtigsten Pfeiler dabei sind die gute Aufklärung und die Motivation zur Einhaltung der Empfehlung. In erster Linie sind die Instruktion zur Blutzuckerselbstkontrolle sowie die Ernährungsberatung und Anleitung zu körperlicher Aktivität essenziell, da bereits diese Massnahmen erwiesenermassen zu einem besseren Outcome von Mutter und Kind führen.17 Hierbei empfiehlt sich Folgendes: Verzicht auf rasch resorbierbare Kohlenhydrate zugunsten einer ballaststoffreichen Ernährung, Verteilung der Mahlzeiten auf 3 kleinere Mahlzeiten mit 2–4 Zwischenmahlzeiten, eine Proteinzufuhr von 60–80g/Tag sowie tägliche moderate körperliche Aktivität (mind. 150min/Woche).18 Sind trotz der konventionellen Massnahmen mehr als 10% der Blutzuckerwerte über den Zielwerten (Tab.2), so ist in zweiter Linie eine Insulintherapie indiziert. Wegen der hohen Plazentagängigkeit und des fehlenden Vorteils gegenüber dem Insulin ist die orale Diabetestherapie mit Biguaniden (ex Metformin®) bisher nur im „off-label use“ und in speziellen Fällen indiziert.
Für die Überwachung des fetalen Wachstumsverlaufs und der Fruchtwassermenge werden sonografische Kontrollen mindestens alle 2–4 Wochen empfohlen.19 Je nach Einstellung und Therapie des GDM sowie bereits bestehenden Komplikationen (Makrosomie, Polyhydramnion) muss dieses Vorgehen individuell angepasst werden.
Optimaler Zeitpunkt der Geburt
Eine der Schlüsselfragen in der Betreuung von Frauen mit GDM ist, ob und wann eine Einleitung Sinn macht. Das Ziel der Einleitung ist es, geburtshilfliche Komplikationen im Zusammenhang mit einer Makrosomie sowie den späten IUFT zu verhindern.6,20 Dem gegenüber steht das Risiko für eine erhöhte neonatale Morbidität bei Einleitungen vor der 39.SSW.21
Leider gibt es kaum gross angelegte randomisierte, kontrollierte Studien, die uns diese Frage klar beantworten, daher beruht das Management auf Empfehlungen der verschiedenen Guidelines.1,10,19 So wird bei insulinpflichtigem GDM die Einleitung ab 40+0 SSW empfohlen. Zwischen 38+0 und 40+0 soll das Vorgehen, je nach Befunden (Ultraschall, Insulinbedarf und maternalen Komorbiditäten), individuell betrachtet und besprochen werden.10,22 Beim nicht insulinpflichtigen GDM ohne Begleitkomplikationen darf mit einem aktiven Vorgehen bis 40+6 SSW abgewartet werden.19
Screening nach der Geburt
Bei allen Frauen mit GDM soll bei der routinemässigen postpartalen Kontrolle 4–12 Wochen nach Geburt ein Diabetesscreening mittels Nüchternblutzucker (≥7,0mmol/L) oder oGTT erfolgen. Auch hier ist es wichtig, die Frauen nochmals über das erhöhte Risiko für einen GDM in einer Folgeschwangerschaft und einen DM 2 in den folgenden Jahren aufzuklären. Ein bewegungsreicher Lifestyle und eine gesunde Ernährung können diese Risiken noch positiv beeinflussen.
Literatur:
1 ACOG Practice Bulletin No. 190: Gestational diabetes mellitus. Obstet Gynecol 2018; 131(2): e49-e64 2 Ryser Ruetschi J et al.: Fasting glycaemia to simplify screening for gestational diabetes. BJOG 2016; 123(13): 2219-22 3 Kun A et al.: The prevalence and predictors of gestational diabetes mellitus in Hungary. Horm Metab Res 2011; 43(11): 788-93 4 Benhalima K et al.: Prediction of glucose intolerance in early postpartum in women with gestational diabetes mellitus based on the 2013 WHO criteria. J Clin Med 2019; 8(3) 5 Group HSCR: Hyperglycemia and adverse pregnancy outcome (HAPO) study: associations with neonatal anthropometrics. Diabetes 2009; 58(2): 453-9 6 Rosenstein MG et al.: The risk of stillbirth and infant death stratified by gestational age in women with gestational diabetes. Am J Obstet Gynecol 2012; 206(4): 309 e1-7 7 Scholtens DM et al.: Hyperglycemia and adverse pregnancy outcome follow-up study (HAPO FUS): maternal glycemia and childhood glucose metabolism. Diabetes Care 2019; 42(3): 381-92 8 Lowe WL et al.: Hyperglycemia and adverse pregnancy outcome follow-up study (HAPO FUS): maternal gestational diabetes mellitus and childhood glucose metabolism. Diabetes Care 2019; 42(3): 372-80 9 Josefson JL et al.: The joint associations of maternal BMI and glycemia with childhood adiposity. J Clin Endocrinol Metab 2020; 105(7) 10 S3-Leitlinie Gestationdiabetes mellitus (GDM), Diangostik, Therapie und Nachsorge, DDG, DGGG-AGG 2018 11 Hillier TA et al.: A pragmatic, randomized clinical trial of gestational diabetes screening. N Engl J Med 2021; 384(10): 895-904 12 Boulvain M et al.: SGGG – Expertenbrief No 37. Screening des Gestationdiabetes 13 Zimmermann R: Handbuch Geburtshilfe 2018; Eigenverlag 14 Li M et al.: Glycaemic status during pregnancy and longitudinal measures of fetal growth in a multi-racial US population: a prospective cohort study. Lancet Diabetes Endocrinol 2020; 8(4): 292-30015 Schäfer-Graf U: Aktuell geltende Leitlinie Gestationsdiabetes. Der Diabetologe 2019; 15(8): 729-37 16 Mane L et al.: Association of first-trimester HbA1c levels with adverse pregnancy outcomes in different ethnic groups. Diabetes Res Clin Pract 2019; 150: 202-10 17 Aroda VR et al.: The effect of lifestyle intervention and metformin on preventing or delaying diabetes among women with and without gestational diabetes: the Diabetes Prevention Program outcomes study 10-year follow-up. J Clin Endocrinol Metab 2015; 100(4): 1646-53 18 Kautzky-Willer A et al.: Gestationsdiabetes (GDM) (Update 2019). Wien Klin Wochenschr 2019; 131(Suppl 1): 91-102 19 NICE Guideline: Diabetes in pregnancy: management from preconception to the postnatal period. 25 February 2015 20 Havas S: The ACCORD trial and control of blood glucose level in type 2 diabetes mellitus: time to challenge conventional wisdom. Arch Intern Med 2009; 169(2): 150-4 21 Melamed N et al.: Induction of labor before 40 weeks is associated with lower rate of cesarean delivery in women with gestational diabetes mellitus. Am J Obstet Gynecol 2016; 214(3): 364 e1-8 22 Boulvain M et al.: Fetal macrosomia: induction of labour or expectant management? - Authors‘ reply. Lancet 2015; 386(10004): 1629-30
Das könnte Sie auch interessieren:
Parvovirus B19 in der Schwangerschaft
Parvovirus B19 ist ein oft unterschätzter Erreger mit potenziell gravierenden Folgen für Mutter und Kind. Während viele Infektionen symptomlos verlaufen, kann das Virus in der ...
Die Perspektive der Ärzt:innen in Ausbildung
In einer Zeit zunehmender Herausforderungen im Gesundheitswesen verändern sich auch das Selbstverständnis und die Arbeitsrealität junger Ärzt:innen in Ausbildung – insbesondere in der ...
Amenorrhö in der Adoleszenz
Ein Meilenstein in der weiblichen Entwicklung ist das Eintreten der ersten Periodenblutung, der Menarche. Bleibt diese in der Adoleszenz aus, sollten weitere Abklärungen zur ...