Dauer der endokrinen Therapie beim frühen Mammakarzinom
Autor*innen:
Dr. med. Ines Klein
Frauenklinik
Kantonsspital St.Gallen
E-Mail: ines.klein@kssg.ch
Priv.-Doz. Dr. med. Inga Bekes
Prof. Dr. med. Jens Huober
Brustzentrum
Kantonsspital St.Gallen
E-Mail: inga.bekes@kssg.ch
E-Mail: jens.huober@kssg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit ca. 70% aller Mammakarzinome ist das hormonrezeptorpositive, HER2-negative der mit Abstand häufigste Subtyp. Die adjuvante endokrine Therapie ist bereits seit vielen Jahren im Therapiestandard dieser Karzinome verankert. Für einige Patientinnen bleibt das Risiko für ein Rezidiv nach einer fünfjährigen Therapie jedoch erhöht, diese könnten von einer verlängerten Therapiedauer profitieren.
Eine fünfjährige adjuvante Therapie des hormonrezeptorpositiven Mammakarzinoms mit Tamoxifen führte im Vergleich zu Placebo zu einer signifikanten Reduktion des 15-Jahres-Rezidivrisikos um 40% und der 15-Jahres-Mortalität um ca 30%. Trotz dieser effektiven fünfjährigen Therapie bleibt das Rezidivrisiko für eine relevante Anzahl an Patientinnen über die fünf Jahre hinaus erhöht, mit Nachweis von Rezidiven bis zu 20 Jahren nach Primärdiagnose. Aus diesem Grund gibt es eine gute Rationale, eine endokrine Therapie über die fünf Jahre zu verlängern, wobei entscheidend ist, diejenigen Patientinnen zu identifizieren, die von dieser längeren, erweiterten adjuvanten endokrinen Therapie (EAT) profitieren.
Rückfallrisiko nach 5 Jahren endokriner Therapie
Die EBCTCG («Early Breast Cancer Trials Collaborative Group») konnte in einer Übersichtsarbeit aus dem Jahr 2017 mit über 91 Studien mit gesamthaft 46000 eingeschlossenen Patientinnen zeigen, dass über 50% der Krankheitsrezidive bei Patientinnen mit hormonrezeptorpositiven Mammakarzinomen erst nach Abschluss der fünfjährigen endokrinen Therapie auftreten.1 Rezidive konnten bis nach 20 Jahren nach Primärdiagnose beobachtet werden und das Rezidivrisiko nach 20 Jahren variierte zwischen 14% und 47%. Als Faktoren, die mit einem erhöhten Rückfallrisiko einhergehen, konnten hierbei ein positiver Nodalstatus, eine fortgeschrittene Tumorgrösse sowie eine schlechte Differenzierung benannt werden. Zwei Drittel der eingeschlossenen Patientinnen hatten allerdings nur eine alleinige Tamoxifen-Therapie während fünf Jahren erhalten. Auch war in 50% der Fälle der HER2-Rezeptorstatus unbekannt und die Erstdiagnose der Brustkrebserkrankung war bei 40% der erfassten Patientinnen vor 2000 erfolgt und nur bei 13% der Patientinnen nach dem Jahr 2005, sodass viele Patientinnen in dieser Metaanalyse eine gemäss heutigen Kriterien suboptimale Therapie hatten. Insgesamt muss man davon ausgehen, dass in dieser Metaanalyse das Rückfallrisiko überschätzt wurde. Dennoch bestätigen die Resultate der Analyse die Notwendigkeit, die Dauer und die Wahl des Wirkstoffes der adjuvanten Therapie gemäss individuellem Risikoprofil der Patientin zu diskutieren und anzupassen.
Dauer der endokrinen Therapie – aktuelle Datenlage
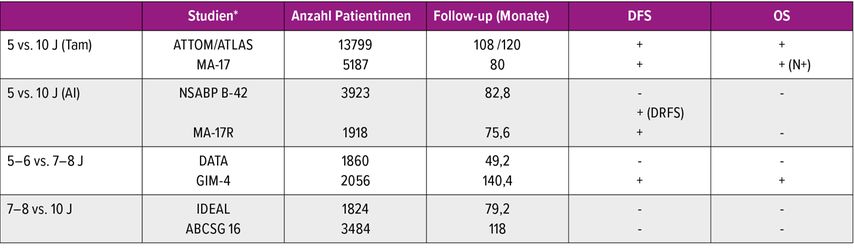
Die adjuvante endokrine Therapie mit Tamoxifen über fünf Jahre reduziert im Vergleich zu Placebo das Rezidivrisiko um 40% und die Mortalität um 30%.2 Ebenso konnte bereits eine im Jahr 1998 publizierte schwedische Studie zeigen, dass fünf Jahre Tamoxifen effektiver sind als zwei Jahre, mit einer statistisch signifikanten Verlängerung des ereignisfreien Überlebens sowie des Gesamtüberlebens.3 Aus diesem Grund war die fünfjährige Therapie mit Tamoxifen lange Zeit der Therapiestandard. Als nächster Schritt wurden die Aromataseinhibitoren (AI) in die Therapie der frühen Mammakarzinome integriert. Studien, die eine fünfjährige endokrine Therapie mit Tamoxifen mit einer fünfjährigen AI-basierten Therapie (entweder fünf Jahre AI oder Sequenz aus AI und Tamoxifen über insgesamt fünf Jahre) verglichen hatten, zeigten eine weitere Reduktion des Rezidivrisikos und der Mortalität um 15–20%, was im Allgemeinen allerdings mit einem eher geringen absoluten Nutzen von 2–4%4 verbunden war. Mit dem Wissen über das persistierend erhöhte Rezidivrisiko über eine Therapiedauer von fünf Jahren hinaus wurden zunehmend Studien publiziert, die eine erweiterte endokrine Therapie im Hinblick auf das krankheitsfreie Überleben sowie das Gesamtüberleben untersuchten (Tab. 1).
Tab. 1: Überblick über die Studien, die eine erweiterte endokrine Therapie im Hinblick auf das krankheitsfreie Überleben sowie das Gesamtüberleben untersucht haben. *Nur in aTTom und ATLAS waren prä-und postmenopausale Patientinnen eingeschlossen, alle anderen Studien schlossen nur postmenopausale Patientinnen ein. + signifikanter Unterschied, - kein signifikanter Unterschied
10 Jahre versus 5 Jahre endokrine Therapie
Randomisierung nach 5 Jahren Tamoxifen
Die ATLAS5- sowie die aTTom6-Studie aus den Jahren 2012 bzw. 2013 untersuchten jeweils nach einer Tamoxifeneinnahme über fünf Jahre (und Rezidivfreiheit) den Effekt einer Verlängerung der Einnahme von Tamoxifen für weitere fünf Jahre vs. Placebo. In diesen grossen Studien mit jeweils mehr als 6000 Studienteilnehmerinnen konnten sowohl post- als auch prämenopausale Patientinnen eingeschlossen werden. Beide Studien konnten dabei eine statistisch signifikante Verlängerung des krankheitsfreien Überlebens (DFS) um absolut ca. 4% sowie des Gesamtüberlebens (OS) um 2–3% zeigen. Das gleiche Studiendesign verwendete die MA-17-Studie,7 wobei hier nach einer fünfjährigen Tamoxifeneinnahme die Einnahme eines AI vs. Placebo bei 5187 postmenopausalen Patientinnen untersucht wurde. Auch hier konnte eine signifikante Verlängerung des DFS (HR: 0,58 [CI: 0,48–0,91], absolute Reduktion: 4,9%) gezeigt werden. Bezüglich des Gesamtüberlebens profitierten nur Patientinnen mit einem positiven Nodalstatus signifikant (HR: 0,61 [CI: 0,38–0,98].
Randomisierung nach 5 Jahren AI-basierter Therapie
In der Folge wurden Studien veröffentlicht, die eine EAT (AI vs. Placebo über weitere fünf Jahre) nach fünf Jahren endokriner Therapie untersuchten, wenn innerhalb der ersten fünf Jahre ein AI durchgängig oder in Sequenz mit Tamoxifen eingenommen wurde.
In der NSABP-B42 Studie wurden 3923 postmenopausale Patientinnen eingeschlossen. Dabei zeigte sich keine signifikante Verlängerung des DFS (HR: 0,85[CI: 0,73–0,99]; 7y: 81,3% vs. 84,7%) oder des OS (HR: 1,15[CI: 0,92–1,44]). Allerdings konnte eine Verlängerung des fernmetastasenfreien Überlebens um absolut 1,9% beobachtet werden.8
In der MA-17R-Studie wurden 1918 postmenopausale Patientinnen nach fünf Jahren AI zu weiteren fünf Jahren AI oder Placebo randomisiert. Lediglich das DFS wurde mit der zehnjährigen Therapie signifikant verlängert (HR: 0,66 [CI: 0,48–0,91] absolute Reduktion 4%; 5y: 91% vs. 95%), ohne signifikanten Einfluss auf das Gesamtüberleben.9
7–8 Jahre versus 5 Jahre endokrine Therapie
Randomisierung nach 2–3 Jahren Tamoxifen
Weitere Studien untersuchten eine EAT über sieben bis acht Jahre. Die DATA- sowie die GIM-4-Studie randomisierten AI vs. Placebo über zwei bis drei versus fünf bis sechs Jahre nach einer initialen Tamoxifentherapie über zwei bis drei Jahre. Die DATA-Studie10 untersuchte 1860 postmenopausale Patientinnen, dabei ergab sich nach einer Nachbeobachtungszeit von 49 Monaten kein signifikanter Unterschied im DFS (HR: 0,79[CI: 0,62–1,02]; 5y: 88,9% vs. 90,7%) und OS (HR: 0,91[CI: 0,65–1,29]). Lediglich in einer ungeplanten Post-hoc-Analyse zeigte sich ein verlängertes DFS für nodalpositive Patientinnen (absolute Reduktion 8,2%) sowie nodalpositive Patientinnen mit einem Tumorstadium ≥T2 (absolute Reduktion 13,5%).10
Im Unterschied dazu zeigte die GIM-4-Studie bei 2054 postmenopausalen Patientinnen nach einer langen medianen Nachbeobachtungszeit von 140 Monaten signifikante Ergebnisse hinsichtlich des DFS (HR: 0,78 [CI: 0,65–0,93]; 12y: 62% vs. 67%) und des Gesamtüberlebens (HR: 0,77[CI: 0,60–0,98]; 12y: 84% vs. 88%).11
10 Jahre versus 7–8 Jahre endokrine Therapie
Randomisierung nach 5 Jahren endokriner Therapie (Tam oder Tam-AI oder AI)
Die letzte Gruppe von Studien, die IDEAL12- wie auch die ABCSG-1613-Studie, untersuchte schliesslich den Unterschied zwischen einer verlängerten endokrinen Therapie über sieben bzw. acht Jahre versus zehn Jahre bei 1824 bzw. 3484 postmenopausalen Patientinnen. Die endokrine Therapie in den ersten fünf Jahren konnte in beiden Studien eine Tamoxifen-Monotherapie, eine AI-Monotherapie oder eine sequenzielle Gabe beider Substanzen umfassen. Die Patientinnen wurden nach fünf Jahren zu einer Erweiterung der Therapie mittels AI über zwei bis drei vs. fünf weitere Jahre randomisiert. In beiden Studien zeigte sich kein statistisch signifikanter Nutzen in der Gesamtpopulation wie auch in den Subgruppen (IDEAL: DFS HR: 0,92 [CI: 0,74–1,16], OS HR: 1,04 [CI: 0,78–1,38], ABCSG 16: DFS HR: 0,99 [CI: 0,85–1,15; OS HR: 1,02 [CI: 0,83–1,25]).
Nebenwirkungen
Während die adjuvante endokrine Therapie zumeist gut vertragen wird, gibt es dennoch Nebenwirkungen, die im Einzelfall beachtet werden müssen und in die Entscheidung über die Anwendungsdauer mit einfliessen sollten. Muskel- und Gelenkschmerzen, kognitive Einschränkungen sowie Verlust von Libido und sexueller Gesundheit können für die individuelle Patientin im Alltag eine grosse Belastung darstellen und somit die Therapieadhärenz gefährden. Die Knochengesundheit ist ebenfalls stets in die Therapie des Mammakarzinoms miteinzubeziehen, da die endokrine Therapie zu einem Verlust der Knochendichte und -struktur führen kann und eine individualisierte, knochengerichtete Therapie entscheidend ist für die Prävention therapieassoziierter Frakturen.
Zhao F et al. haben sich 2020 in einer grossen Metaanalyse der Frage nach Nebenwirkungen der EAT verglichen mit einer Einnahmedauer von fünf Jahren gewidmet. Es zeigte sich eine signifikante Zunahme von Knochenbrüchen, kardiovaskulären Ereignissen, Arthralgien und Hitzewallungen Grad 3 im Patientinnenkollektiv mit einer EAT. Gleichzeitig konnte jedoch eine signifikante Reduktion der Lokalrezidive, der Fernrezidive sowie der kontralateralen Brustkrebsfälle gezeigt werden, was im Unterschied zu den Nebenwirkungen abgewogen werden muss.14
Individualisierung der EAT
Studienübergreifend konnte gezeigt werden, dass Patientinnen mit einem niedrigen absoluten Risiko für ein Krankheitsrezidiv allgemein auch nur einen geringen absoluten Nutzen von einer EAT haben. Eine Abwägung des individuellen Nutzens – unter anderem anhand einer Abschätzung des Langzeit-Rezidivrisikos sowie der Therapieeffizienz – ist daher essenziell, um Patientinnen mit einem zu erwartenden Benefit herauszufiltern, ohne bei solchen ohne Nutzen unnötige Spätfolgen, Toxizitäten und Einschränkungen herbeizuführen. Kriterien, die für einen Nutzen durch eine EAT sprechen, sind ein initial fortgeschrittenes Tumorstadium wie z.B. ein positiver Nodalstatus oder ein grosser Primärtumor. Aber auch Patientinnen mit einer aggressiveren Tumorbiologie wie z.B. schlechter Differenzierung oder erhöhter Proliferation hatten in der Metaanalyse der EBCTCG auch nach fünf Jahren noch ein erhöhtes Rezidivrisiko.15
Für die Einteilung einzelner Patientinnen in eine Risikokategorie (niedriges/mittleres/hohes Risiko) kann im Einzelfall zur Entscheidungsunterstützung der CTS5 Calculator oder ein genomischer Test berücksichtigt werden. So ermöglicht der webbasierte CTS5 Calculator eine einfache und praxisfreundliche Berechnung des Risikos von Patientinnen für das Auftreten von Fernmetastasen nach einem rezidivfreien Intervall von fünf Jahren unter adjuvanter endokriner Therapie. Für die Berechnung benötigt werden das Alter der Patientin sowie tumorspezifische Daten wie die Tumorgrösse, das Grading und die Anzahl an befallenen Lymphknoten. Anhand dieser Merkmale werden Patientinnen in eine Niedrigrisiko-Gruppe (Risiko über 5–10 Jahre <5%), eine Gruppe mit mittlerem Risiko (5–10%) sowie eine Hochrisiko-Gruppe (>10%) eingeteilt.16 Eine Einschränkung ist, dass die Berechnung nur für postmenopausale Patientinnen mit HER2-negativem Rezeptorstatus validiert ist.
Als weitere Option zur Abschätzung des individuellen Risikos steht mit dem Breast Cancer Index (BCI) ein genomischer Test zur Verfügung. Der BCI wird anhand von formalinfixiertem paraffineingebettetem Tumorgewebe ermittelt und beinhaltet eine Kombination aus zwei Genexpressionssignaturen – dem Molecular Grade Index, der Zellzyklus-assoziierte Gene untersucht, und der HI-Ratio (HOXB13/IL17BR-Ratio), welche das Ansprechen auf eine endokrine Therapie beurteilt. Eine Einteilung der Patientinnen in Gruppen («BCI low/high») kann für die Entscheidungsfindung hinsichtlich EAT ebenfalls herangezogen werden. Sowohl in der Trans-aTTom-Studie17 als auch in der IDEAL-18 und der MA-17-Studie19 konnte für H/I-high-Patientinnen eine signifikante Risikoreduktion durch eine EAT nachgewiesen werden (absolute Risikoreduktion um ca. 10%), im Gegensatz dazu ergab sich bei den BCI-Low-Risk-Patientinnen kein signifikanter Vorteil durch die verlängerte endokrine Therapie. Diese Daten haben dazu geführt, dass gemäss den ASCO- oder auch den AGO-Guidelines im Einzelfall dieser Test für eine Therapieentscheidung bei Patientinnen mit negativem Lymphknotenstatus oder mit weniger als vier befallenen Lymphknoten berücksichtigt werden kann (Bewertungsgrad AGO: BCI +/-).
Ein Update derDATA-Studie konnte auch zeigen, dass vor allem Patientinnen mit einem endokrin sensitiven Tumor, in dieser Untersuchung definiert als Positivität beider Hormonrezeptoren, von einer EAT profitiert haben.20
Fazit
Für viele Patientinnen ist die endokrine Therapie über fünf Jahre weiterhin der Therapiestandard und ausreichend. Das Rezidivrisiko bleibt jedoch beim frühen, hormonrezeptorpositiven Mammakarzinom über fünf Jahre hinaus erhöht. Die Abschätzung des Rezidivrisikos sowie der Therapieeffizienz ist wichtig für die Selektion der Patientinnen, die von einer EAT profitieren.
Da die meisten Patientinnen schon in den ersten fünf Jahren eine AI-basierte Therapie erhalten haben, ist die optimale Therapiedauer höchstwahrscheinlich sieben bis acht Jahre für Patientinnen mit einem mittleren bis hohen Rezidivrisiko. Eine endokrine Therapiedauer über zehn Jahre kann für Patientinnen mit einem sehr hohen Risiko (z.B. primär ausgedehnter Nodalbefall) erwogen werden. Individuelle Aspekte wie die Therapieverträglichkeit und Komorbiditäten müssen in die Entscheidung mit einbezogen werden, um eine Therapieadhärenz zu sichern und die Lebensqualität der Patientinnen zu erhalten. Das klinische Web-Tool CTS5 sowie der genomische BCI-Test können hierbei zur individuellen Entscheidungsfindung beitragen.
Literatur:
1 EBCTCG: 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years. N Engl J Med 2017; 377: 1836-46 2 EBCTCG: Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011; 378(9793):771-84 3 Swedish Breast Cancer Cooperative Group: Randomized trial of two versus five years of adjuvant tamoxifen for postmenopausal early stage breast cancer. JNCI 1998; 88(21):1543-9 4 EBCTCG: Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015; 386(10001):1341-1352 5 Davies C et al.: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2012; 381(9869): 805-16 6 Gray R et al.: aTTom: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,953 women with early breast cancer. J Clin Oncol 2013; 31; (18_suppl.5) 7 Goss PE et al.: Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17; JNCI 2005; 7(17): 1262-71 8 Mamounas EP et al.: Use of letrozole after aromatase inhibitor-based therapy in postmenopausal breast cancer (NRG Oncology/NSABP B-42): a randomised, double-blind, placebo-controlled, phase 3 trial; Lancet Oncol 2019; 20(1): 88-99 9 Goss PE et al.: Extending aromatase-inhibitor adjuvant therapy to 10 years. N Engl J Med 2016;375(3): 209-19 10 Tjan-Heijnen VCG et al.: Extended adjuvant aromatase inhibition after sequential endocrine therapy (DATA): a randomised, phase 3 trial. Lancet Oncol 2017; 18(11): 1502-11 11 Del Mastro L et al.: Extended therapy with letrozole as adjuvant treatment of postmenopausal patients with early-stage breast cancer: a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22(10): 1458-67 12 Blok EJ et al.: Optimal duration of extended adjuvant endocrine therapy for early breast cancer; results of the IDEAL trial. JNCI 2018; 110(1) 13 Gnant M et al.: Duration of adjuvant aromatase-inhibitor therapy in postmenopausal breast cancer. N Engl J Med 2021; 29; 385(5): 395-405 14 Zhao F et al.: Toxicity of extended adjuvant endocrine with aromatase inhibitors in patients with postmenopausal breast cancer: a systemtic review and meta-analysis. Crit Rev Oncol Hematol 2020; 156: 103114 15 Burstein HJ et al.: Adjuvant endocrine therapy for women with hormone receptor–positive breast cancer: ASCO clinical practice guideline focused update. J Clin Oncol 2018; 37(5): 423-38 16 https://cts5-calculator.com 17 Bartlett JMS et al.: Breast Cancer Index and prediction of benefit from extended endocrine therapy in breast cancer patients treated in the Adjuvant Tamoxifen-To Offer More? (aTTom) trial. Ann Oncol 2019; 30(11): 1776-83 18 Noordhoek I et al.: Breast Cancer Index predict extended endocrine benefit to individualize selection of patients with HR+ early stage breast cancer for 10 years of endocrine therapy. Clin Cancer Res 2021; 27(1):311-319 19 Sgroi DC et al.: Prediction of late disease recurrence and extended adjuvant letrozole benefit by the HOXB13/IL17BR biomarker. J Natl Cancer Inst 2013; 105: 1036-42 20 Tjan-Heijnen VCG et al.: Extended adjuvant aromatase inhibition after sequential endocrine therapy: final results of the phase III DATA trial. Ann Onc 2022; 33(suppl_7): 55-S84
Das könnte Sie auch interessieren:
Welche Risiken sind zu erwarten?
Die präventive Mastektomie wird vor allem bei genetischer Vorbelastung, z.B. bei BRCA1/2-Mutationen, erwogen. Der Eingriff kann das Brustkrebs-Erkrankungsrisiko deutlich reduzieren, aber ...
Operative Therapie und Risikoreduktion bei BRCA-Mutations-Trägerinnen
Familiäre Krebserkrankungen, besonders durch pathogene Genveränderungen bedingt, sind vermehrt in den Fokus der Forschung gerückt. Dies zeigt sich vor allem bei Brustkrebs (BC). Das ...
AI in der Reproduktionsmedizin
Kein Thema bewegt derzeit die Menschen mehr als künstliche Intelligenz (AI – „artificial intelligence“). Wiewohl in der Behandlung des unerfüllten Kinderwunsches in den letzten ...