Aktuelle medikamentöse Therapiemöglichkeiten
Autoren:
Dr. med. Dominic Althaus1
Prof. Dr. med. Petr Hrúz1
Prof. Dr. med. Jan Hendrik Niess1,2
1 Clarunis – Universitäres Bauchzentrum Basel
2 Departement für Biomedizin, Gastroenterologie
Universität Basel
E-Mail: janhendrik.niess@unibas.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dank intensiver Forschung stehen Patientinnen und Patienten mit chronisch-entzündlichen Darmerkrankungen immer effektivere Therapiemöglichkeiten zur Verfügung. Die Wahl einer entsprechenden, individualisierten Therapie durch die behandelnden Gastroenterologen hängt dabei von der Krankheitsausdehnung, extragastrointestinalen Manifestationen, den Komorbiditäten sowie den Bedürfnissen der Patienten ab. Der folgende Artikel zeigt die aktuellen Therapieoptionen auf.
Keypoints
-
Neben der konventionellen Therapie werden bei CED zunehmend Biologika zur Induktions- und Erhaltungstherapie eingesetzt.
-
Die Auswahl der individualisierten CED-Therapie basiert auf der Krankheitsausdehnung, extraintestinalen Manifestationen und Komorbiditäten.
-
Circa 2/3 der Patienten sprechen initial klinisch auf eine Biologikatherapie an.
-
Bei circa der Hälfte der Patienten wird die Therapie im Verlauf aufgrund eines Wirkungsverlustes oder wegen Nebenwirkungen abgesetzt oder umgestellt.
Die Inzidenz und die Prävalenz von chronisch-entzündlichen Darmerkrankungen (CED) mit den beiden Hauptentitäten Morbus Crohn (MC) und Colitis ulcerosa (CU) nehmen weltweit zu. Populationsbasierte Daten beschreiben eine Prävalenz von 0,4% (1 von 250 Personen) mit gleicher Häufigkeit von MC und CU in der Schweiz.1 Aufgrund der Zunahme der CED und der häufigen Assoziation mit chronischen Komorbiditäten steigen trotz neuer Therapien auch die direkten und indirekten Kosten für das Gesundheitssystem.2–3
Die Pathogenese der CED ist komplex und nicht abschliessend verstanden. Eine genetische Prädisposition ist beim MC vorhanden und wird auch bei der CU postuliert.4 Als zusätzliche auslösende Krankheitsfaktoren werden nebst dem Nikotinabusus, welcher den schwerwiegendsten Risikofaktor bei MC darstellt, Umweltfaktoren wie Infekte im Kindesalter, Luftverschmutzung, Diäten, der Gebrauch von NSAR sowie eine primäre oder sekundäre Veränderung der Zusammensetzung des Mikrobioms genannt.5
Der Krankheitsphänotyp mit entsprechender Klinik sowie der Krankheitsverlauf sind bei jedem Patienten individuell und vom Ausmass und der Lokalisation der entzündlichen Aktivität im Gastrointestinaltrakt respektive von extragastrointestinalen Manifestationen abhängig. Die Diagnose eines MC oder einer CU kann nur in Zusammenschau der klinischen, biochemischen (Entzündungswerte, Calprotectin), endoskopischen, histologischen und ggf. radiologischen Befunde gestellt werden.6,7 Die genaue Erfassung der Entzündungsausdehnung im Dickdarm respektive Dünndarm oder oberen GI-Trakt (MC) ist für die Wahl der Therapie unerlässlich und erfolgt nach der Montreal-Klassifikation.8
Aufgrund der Komplexität der Erkrankungen existiert zurzeit nach wie vor keine kurative Therapie. Dank intensiver Forschung auf dem Gebiet stehen den Patienten mit CED immer effektivere medikamentöse Therapien mit unterschiedlichen Wirkungsmechanismen zur Verfügung. Nebst den konventionellen Medikamenten, wie Steroiden, 5-ASA-Präparaten oder auch Azathioprin, werden zunehmend Biologika für die Gastroenterologie entwickelt oder finden ihre Verwendung nicht nur in der Rheumatologie und Dermatologie, sondern auch zur Behandlung einer CED. Ziele jeder systemischen und/oder topischen medikamentösen Therapie sind primär eine rasche Besserung der Beschwerden (klinische Remissionsinduktion), eine Remissionserhaltung (=Verhinderung von Schüben) sowie das Verhindern von Komplikationen (Abszesse, Fisteln, Strikturen) und die Minimierung chirurgischer Eingriffe. Weitere Therapieziele sind eine biochemische (Entzündungsparameter und Calprotectinwert) sowie eine endoskopische und histologische Remission.
Konventionelle Therapien
Aminosalicylate
Aminosalicylate (topisch: Suppositorien, Klysmen; und/oder systemisch: Granulat, Tablette) werden aufgrund der guten Remissionserhaltung nach wie vor als Erstlinientherapie bei leichter bis mittelschwerer CU mit vorwiegendem Befall des Rektosigmoides empfohlen.9 Der genaue Wirkungsmechanismus des entzündungshemmenden Effektes im Dickdarm ist unbekannt. Diskutiert werden u.a. antioxidative Mechanismen oder auch ein Einfluss auf den Prostaglandingehalt der Kolonschleimhaut. Die 5-ASA-Therapien werden im Allgemeinen sehr gut vertragen und Nebenwirkungen (v.a. Hepatotoxizität und interstitielle Nephritis) sind sehr selten und unabhängig von der Dosis.10 Ein möglicher protektiver Effekt bzgl. kolorektalen Karzinoms bei CU-Patienten wird diskutiert und es wird daher oftmals eine Basistherapie mit 5-ASA-Präparaten etabliert.11–13 Die Mesalazintherapie hat beim MC keinen Stellenwert.14
Kortikosteroide
Systemische intravenöse oder perorale Steroide werden hauptsächlich im akuten Schub einer CED eingesetzt. Eine Erhaltungstherapie mit Kortikosteroiden soll aufgrund der potenziellen langfristigen Arzneimittelnebenwirkungen, wie Osteopenie, Steroiddiabetes oder Nebenniereninsuffizienz, vermieden werden. Von einem steroiddependenten Verlauf spricht man, wenn aufgrund der Klinik eine Dosisreduktion <10mg Prednison/d innerhalb von 3 Monaten nach Steroidbeginn nicht möglich ist. Bei einer steroidrefraktären CED findet sich innerhalb von 1 bzw. 2 Wochen kein klinisches Ansprechen auf eine intravenöse oder perorale Prednisondosis.15
Immunmodulatoren
Azathioprin oder 6-Mercaptopurin stellen eine kostengünstige und effiziente orale Erhaltungstherapie bei steroiddependenter und steroidrefraktärer CED (CU und MC) dar. Der antiinflammatorische Effekt basiert mutmasslich auf einer Hemmung der Nukleinsäuresynthese als Antimetabolit (6-Mercaptopurin) oder in der Proliferationshemmung von B- und T-Zellen. Bei verzögertem Wirkungseintritt kann die genannte Therapie nicht als Akuttherapie angewendet werden. Die Zieldosis liegt in der Regel bei 1,5–2,5mg/kg KG. In bis zu 60% wird aufgrund von erheblichen Nebenwirkungen in Form von Übelkeit und Erbrechen oder grippeähnlichen Symptomen eine höhere Dosis des Medikamentes von den Patienten nicht toleriert oder die Therapie muss sistiert werden. Azathioprin-induzierte Pankreatitiden sind selten, ein Abbruch der Therapie ist dann jedoch unumgänglich.16 Arzneimittelnebenwirkungen treten häufiger bei älteren Patienten auf, weshalb die genannte Therapie auch in Anbetracht des zusätzlich erhöhten Risikos für ein Lymphom bei dieser Patientengruppe mit grosser Vorsicht eingesetzt werden sollte.
Ciclosporin (Calcineurininhibitor) und Tacrolimus (Calcineurin-Calmodulinhemmer) sind weitere Therapieoptionen und werden nur noch selten als Rescue-Therapie bei schweren Krankheitsschüben der CU verabreicht.
Methotrexat, ein strukturelles Analogon zur Folsäure mit immunsuppressiver und antineoplastischen Eigenschaften, wird nur noch äusserst selten zur Behandlung des MC eingesetzt.
Biologika und weitere medikamentöse Therapien
Biologika sind Medikamente, welche biotechnologisch generiert werden, humane oder tierische Organismusbestandteile enthalten und in Form von Proteinen (zum Beispiel monoklonale Antikörper) hergestellt werden. Die Herstellung dieser Therapeutika ist aufwendig und kostenintensiv. Kostengünstigere Biosimilars kommen zunehmend auf den Markt, also Nachahmerprodukte des Originalmedikaments, welche sich nur gering vom Originalpräparat unterscheiden.
Tumornekrosefaktor-Inhibitoren
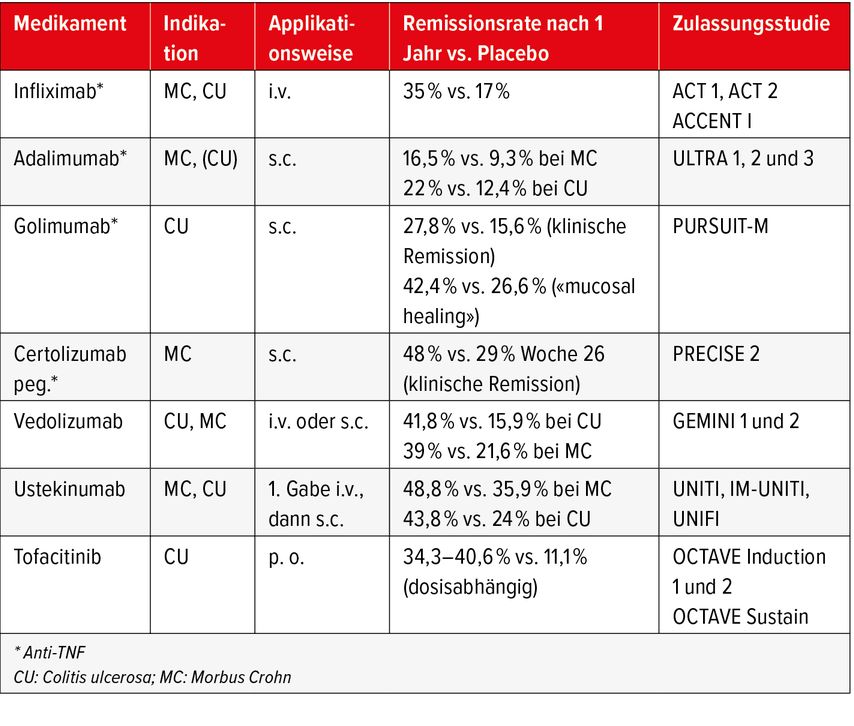
TNF-Inhibitoren, welche in der Gastroenterologie eingesetzt werden, sind monoklonale Antikörper, die den Tumornekrosefaktor α, ein wichtiges proinflammatorisches Zytokin in der Entzündungskaskade der CED, binden und neutralisieren. Die Gabe erfolgt je nach Präparat und Patientenwunsch intravenös oder mittels Subkutanapplikation. TNF-Inhibitoren finden sowohl bei der CU als auch beim MC als Remissionsinduktion respektive als Erhaltungstherapie ihre Verwendung, ebenso zeigt sich eine gute Wirkung bzgl. einzelner extragastrointestinaler Manifestationen sowie bei Fistelleiden. Eine schwere Herzinsuffizienz, ein Malignom in den vergangenen 5 Jahren sowie schwere, degenerative neurologische Erkrankungen wie die Multiple Sklerose sind Kontraindikationen für diese Medikamentenklasse. Eine jährliche dermatologische Kontrolle bei leicht erhöhtem Risiko für Hauttumoren wird ebenfalls empfohlen.17,18
α4β7-Integrin-Blocker
α4β7-Integrin-Antagonisten wie Vedolizumab blockieren selektiv das zelluläre Adhäsionsmolekül α4β7-Integrin auf den Lymphozyten und verhindern so deren Bindung zu MAdCAM-1 (Zelladhäsionsmolekül) und somit die Immigration der Lymphozyten in die Darmwand. MAdCAM-1 wird ausschliesslich auf Darmgewebe hochreguliert, weshalb sich die antiinflammatorische Wirkung von Vedolizumab praktisch vollständig auf den GI-Trakt beschränkt, es selten zu Nebenwirkungen kommt und die Verträglichkeit gut ist. Vedolizumab kann sowohl bei CU als auch bei MC eingesetzt und entweder intravenös oder subkutan verabreicht werden. Nachteile des Medikaments bestehen in der langsam einsetzenden Wirkung (bis zu 3 Monaten) und darin, dass es sich aufgrund der darmselektiven Wirkung nicht für die Behandlung von extragastrointestinalen CED-Manifestationen eignet.19–21
Interleukin-12/23-Inhibitoren
IL-12/23-Inhibitoren sind Antikörper, welche an die gemeinsame Untereinheit p40 der humanen Zytokine IL-12 und IL-23 binden, welche bei MC und CU in erhöhter Konzentration im Darm und in den Lymphknoten des GI-Trakts vorkommen. Durch die Hemmung dieser Interleukine wird eine Aktivierung der T-Helferzellen (Th1 und Th17) unterbunden, welche eine wichtige Rolle in der Entzündungskaskade bei CED spielen. Der bis dato einzige zugelassene Antikörper Ustekinumab wurde initial zur Behandlung der Psoriasis und der rheumatoiden Arthritis eingesetzt. Seit wenigen Jahren kann dieser nun zur MC- wie auch CU-Therapie verabreicht werden. Der Wirkungseintritt erfolgt nach circa 8 Wochen und der Antikörper wird gut vertragen, eine Assoziation mit Malignomen wurde bislang nicht nachgewiesen.22,23
JAK-Inhibitoren
Januskinaseinhibitoren blockieren Zytokinrezeptoren, welche über eine sogenannte «common gamma chain» verfügen, welche bei der Aktivierung von Lymphozyten eine wichtige Rolle spielt. Tofacitinib ist der bislang einzige in der Gastroenterologie zugelassene JAK1/JAK3-Inhibitor ausschliesslich zur Behandlung der CU. Tofacitinib wurde bislang wie Ustekinumab v.a. zur Behandlung der Psoriasis und der rheumatoiden Arthritis eingesetzt. Ein schneller Wirkungseintritt innert weniger Wochen sowie ein gutes Ansprechen auf diese Therapie bei CU-Patienten mit vorangehendem Versagen auf eine Anti-TNF-Therapie sind einige Vorteile dieses Medikamentes. Das teils schwerwiegende Nebenwirkungsprofil mit gehäuften Infektionen (v.a. Herpes-zoster-Infektion), einem erhöhten Risiko für thromboembolische Ereignisse ab dem 50. Lebensjahr oder bei zusätzlichen Risikofaktoren, wie hormoneller Antikonzeption, bereits stattgehabten thromboembolischen Ereignissen oder Herzinsuffizienz, sowie einem leicht erhöhten Karzinomrisiko (v.a. für Lungentumoren und Lymphome, nicht für melanozytäre Hauttumoren) muss vor Beginn einer entsprechenden Therapie jedoch in die Überlegungen miteinbezogen werden.24,25 Bei Patienten über 65 Jahre soll daher grundsätzlich eine Therapie mit Tofacitinib nur bei fehlenden therapeutischen Alternativen begonnen werden.
Neue Ansätze
Weitere Medikamente mit selektiver Blockade von IL-23, JAK1 oder des Sphingosin-1-Phosphatrezeptors zur Behandlung der CED werden in naher Zukunft erwartet. Einige Phase-3-Studien sind bereits weit fortgeschritten und wurden teilweise auch schon auf Kongressen präsentiert, sodass eine Vielzahl an Möglichkeiten zur Behandlung einer CED zur Verfügung stehen wird.
Auswahl der Therapie
Die Auswahl der immunsupprimierenden Therapie für den individuellen Patienten hängt von der Ausdehnung der Entzündung, dem Befall extragastrointestinaler Organe, dem Alter, den Komorbiditäten sowie den Therapievorstellungen der Patienten ab. Für beide Erkrankungen gilt, dass bei ausgedehntem Entzündungsbefall und/oder steroiddependenten/-refraktären Verläufen respektive ungenügendem oder fehlendem Ansprechen auf eine immunmodulierende Therapie mit Azathioprin oder 6-Mercaptopurin eine Biologikatherapie indiziert ist. Die Wirksamkeit sowie die Anwendungsmöglichkeiten der verschiedenen Medikamente sind in Tabelle 1 zusammengefasst. Prognostische Biomarker zur Auswahl einer möglichst effizienten individualisierten Therapie werden zurzeit in Studien intensiv erforscht. Head-to-Head-Studien mit direktem Vergleich der Wirksamkeit zweier verschiedener Biologika existieren bis auf wenige Ausnahmen nicht.26
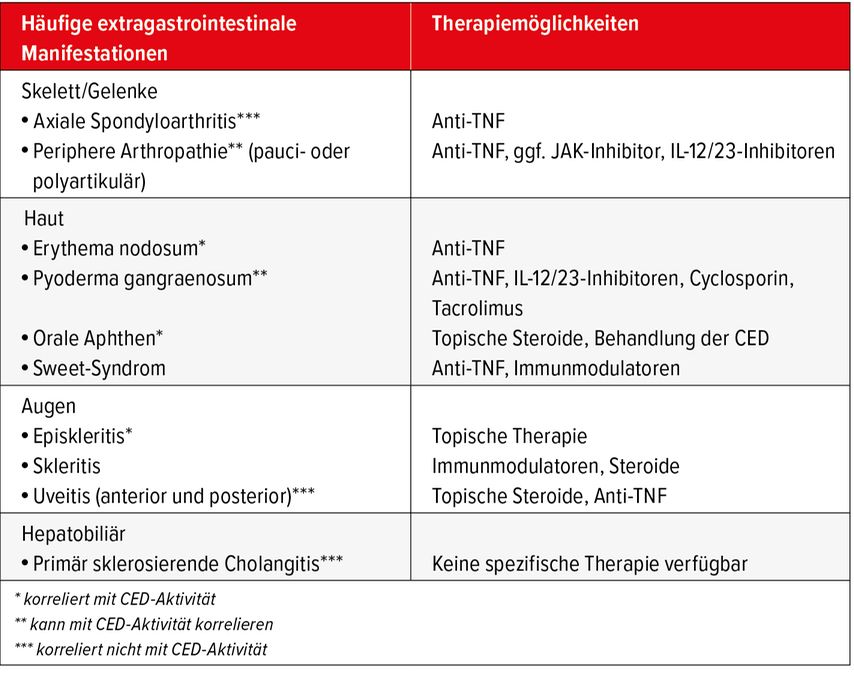
Bei extragastrointestinalem Befall (Tab. 2) oder fistulierendem Verlauf bei MC ist in der Regel initial bereits eine Biologikatherapie indiziert. Zur Behandlung von Fisteln werden grundsätzlich Anti-TNF-Antikörper verwendet.
Tab. 2: Extragastrointestinale Manifestationen bei chronisch-entzündlichen Darmerkrankungen und Therapiemöglichkeiten38, 39
Circa 2/3 der Patienten sprechen klinisch auf eine Biologikatherapie an. Bis zu 50% der Patienten mit initialem Ansprechen auf die Anti-TNF-Therapie brechen die Therapie jedoch aufgrund eines Wirkungsverlustes oder wegen Nebenwirkungen im Verlauf ab. Patienten, die initial nicht auf eine Erstlinien-Biologikatherapie ansprechen oder einen Wirkungsverlust (z.T. Antikörperbildung gegen das Medikament) erfahren, sprechen ebenfalls deutlich schlechter auf eine Zweitlinientherapie an.27,28 Biologikatherapien werden nicht oder nur in ausgewählten Spezialfällen kombiniert. Eine Kombination von Infliximab mit Immunmodulatoren hat hingegen eine höhere Remissionsrate sowohl bei CU- als auch MC-Patienten mit moderater bis schwerer Krankheitsaktivität gezeigt.29,30 Auch wenn die Notwendigkeit operativer Eingriffe unter Biologikatherapie rückläufig ist,31 brauchen nach wie vor einige Patienten aufgrund von Komplikationen oder therapierefraktären Krankheitsverläufen eine operative Therapie.
Infekte unter Biologikatherapie
Da es unter der Biologikatherapie zu einer Reaktivierung von latenten Infektionen kommen kann, muss vor Therapiebeginn eine chronische Hepatitis-B/C- respektive HIV-Infektion oder eine latente Tuberkulose aktiv ausgeschlossen oder entsprechend behandelt werden. Eine Überprüfung des Impfstatus mit ggf. Durchführung von Auffrischimpfungen gemäss den länderspezifischen Impfempfehlungen ist ebenfalls indiziert. Mit Ausnahme von Lebendimpfstoffen können vor oder während der Biologikatherapie sämtliche Impfungen verabreicht werden, das Ansprechen auf eine Impfung kann unter Biologikatherapie vermindert sein.
Das Risiko für leichte Infekte ist unter Biologikatherapie erhöht. Genaue Angaben zur Prävalenz und Inzidenz fehlen. Das Auftreten schwerer Infekte oder opportuner Infekte ist sehr selten,32,33 muss jedoch früh erkannt werden, da diese mit einer erhöhten Morbidität und Mortalität einhergehen können.
Schlussfolgerung
Die Auswahl der entsprechenden MC- respektive CU-Therapie ist abhängig vom Krankheitsbefund und vom Patienten und basiert daher auf individuellen Faktoren. Die Wirksamkeit der verschiedenen, uns aktuell zur Verfügung stehenden Biologika ist vergleichbar. Das Infektionsrisiko unter Biologikatherapie ist erhöht, schwere Infektionen oder opportune Infekte sind jedoch selten.
Literatur:
1 Bähler C et al.: Trends in prevalence, mortality, health care utilization and health care costs of Swiss IBD patients: a claims data based study of the years 2010, 2012 and 2014. BMC Gastroenterol 2017; 17: 13 2 Van Linschoten RCA et al.: Systematic review: societal cost of illness of inflammatory bowel disease is increasing due to biologics and varies between continents. Aliment Pharmacol Ther 2021; 54: 234-48 3 Bähler C et al.: Chronic comorbidities associated with inflammatory bowel disease: prevalence and impact on healthcare costs in Switzerland. Eur J Gastroenterol Hepatol 2017; 29: 916-25 4 Cleynen I et al.: Inherited determinants of Crohn’s disease and ulcerative colitis phenotypes: a genetic association study. Lancet 2016; 387: 156-67 5 Ananthakrishan AN et al.: Environmental triggers in IBD: a review of progress and evidence. Nat Rev Gastroenterol Hepatol 2018; 15: 39-49 6 Conrad K et al.: Diagnosis and classification of ulcerative colitis. Autoimmun Rev 2014; 13: 463-6 7 Laass MW et al.: Diagnosis and classification of Crohn’s disease. Autoimmun Rev 2014; 13: 467-71 8 Silverberg MS et al.: Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19(Suppl A): 5A-36A 9 Singh S et al.: American Gastroenterological Association Technical Review on the Management of Mild to Moderate Ulcerative Colitis. Gastroenterology 2019; 156: 769-808.e29 10 Sehgal P et al.: Systematic review: safety of mesalazine in ulcerative colitis. Aliment Pharmacol Ther 2018; 47: 1597-609 11 Stolfi C et al.: Colorectal cancer chemoprevention by mesalazine and its derivatives. Biomed Biotechnol 2012; 2012: 980458 12 Stolfi C et al.: Molecular basis of the potential of mesalazine to prevent colorectal cancer. World J Gastroenterology 2008; 14: 4434-9 13 Lopez A, Peyrin-Biroulet L: 5-Aminosalicylic acid and chemoprevention: does it work? Dig Dis 2013; 31: 248-53 14 Torres J et al.: ECCO guidelines on therapeutics in Crohn’s disease: medical treatment. J Crohns Colitis 2020; 14: 4-22 15 Gajendran M et al.: A comprehensive review and update on ulcerative colitis. Dis Mon 2019; 65: 100851 16 Stournaras E et al.: Thiopurine monotherapy is effective in ulcerative colitis but significantly less so in Crohn’s disease: long-term outcomes for 11928 patients in the UK inflammatory bowel disease bioresource. Gut 2021; 70: 677-86 17 Rutgeerts P et al.: Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462-76 18 Ben-Horin S, Chowers Y: Review article: loss of response to anti-TNF treatments in Crohn’s disease. Aliment Pharmacol Ther 2011; 33: 987-95 19 Sandborn WJ et al.: Efficacy and safety of vedolizumab subcutaneous formulation in a randomized trial of patients with ulcerative colitis. Gastroenterology 2020; 158: 562-572.e12 20 Feagan BG et al.: Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369: 699-710 21 Sandborn WJ et al.: Vedolizumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2013; 369: 711-21 22 Feagan BG et al.: Ustekinumab as induction and maintenance therapy for Crohn’s disease. N Engl J Med 2016; 375: 1946-60 23 Sands BE et al.: Ustekinumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2019; 381: 1201-14 24 Sandborn WJ et al.: Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 376: 1723-36 25 Safety study Pfizer-Studie A3921133 26 Sands BE et al.: Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019; 381: 1215-26 27 Singh S et al.: Primary non-response to tumor necrosis factor antagonists is associated with inferior response to second-line biologics in patients with inflammatory bowel diseases: a systematic review and meta-analysis. J Crohns Colitis 2018; 12: 635-43 28 Ben-Horin S et al.: Optimizing anti-TNF treatments in inflammatory bowel disease. Autoimmun Rev 2014; 13: 24-30 29 Colombel JF et al.: Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362: 1383-95 30 Panaccione R et al.: Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology 2014; 146: 392-400 31 Lowe SC et al.: Declining rates of surgery for inflammatory bowel disease in the era of biologic therapy. World J Gastrointest Surg 2021; 25: 211-9 32 Viget N et al.: Opportunistic infections in patients with inflammatory bowel disease: prevention and diagnosis. Gut 2008; 57: 549-58 33 Wheat CL et al.: Inflammatory bowel disease (IBD) pharmacotherapy and the risk of serious infection: a systematic review and network meta-analysis. BMC Gastroenterology 2017; 17: 52 34 Hanauer SB et al.: Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541-9 35 Sandborn WJ et al.: Subcutaneous golimumab maintains clinical response in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146: 96-109.e1 36 Schreiber S et al.: Maintenance therapy with certolizumab pegol for Crohn’s disease. N Engl J Med 2007; 357: 239-50 37 Sandborn WJ et al.: Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012; 142: 257-65.e1-3 38 Garber A, Regueiro M: Extraintestinal manifestations of inflammatory bowel disease: epidemiology, etiopathogenesis, and management. Curr Gastroenterol Rep 2019; 21: 31 39 Rogler G et al.: Extraintestinal manifestations of inflammatory bowel disease: current concepts, treatment, and implications for disease management. Gastroenterology 2021; 161: 1118-32
Das könnte Sie auch interessieren:
ECCO-Update 2025
Der Kongress der European Crohn’s and Colitis Organisation (ECCO) fand 2025 vom 19. bis 22. Februar in Berlin unter dem Motto «Nachhaltigkeit bei chronisch-entzündlichen Darmerkrankungen ...
Vorsorgekoloskopie und Polypektomienachsorge
In ihrem Vortrag zum Darmkrebs-Screening in Österreich an der SGG-Jahrestagung 2024 ermöglichte Univ.-Prof. Dr. med. Monika Ferlitsch, Wien, einen Blick über den Tellerrand. Sie zeigte ...
Update im therapeutischen Management der Helicobacter-pylori-Infektion
Die H.-pylori-Infektion ist entscheidender Ausgangspunkt für die Entwicklung eines Magenkarzinoms. Diese Entwicklung kann durch eine frühzeitige Eradikation von H.pylori verhindert ...