ECCO-Update 2025
Bericht:
Mag. Andrea Fallent
Redaktorin
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Kongress der European Crohn’s and Colitis Organisation (ECCO) fand 2025 vom 19. bis 22. Februar in Berlin unter dem Motto «Nachhaltigkeit bei chronisch-entzündlichen Darmerkrankungen (CED) und darüber hinaus» statt. Rund 8100 registrierte Teilnehmer informierten sich über neue Behandlungsoptionen und optimale Patientenbetreuung.
Spannende Erkenntnisse wurden u.a. aus der komplexen Grundlagenforschung zur Krankheitsentstehung, zu potenziellen Biomarkern für die Vorhersage einer Erkrankung und des Therapieerfolgs sowie zur Mikrobiommodulation präsentiert. Neue medikamentöse Therapien, aber auch diätetische und chirurgische Ansätze erweitern die Optionen, um chronisch-entzündliche Darmerkrankungen (CED) zukünftig effektiver behandeln zu können. Hier folgt eine Auswahl der zahlreichen vorgestellten Studiendaten.
Serumantikörper zur Vorhersage einer CED-Manifestation
Die Identifizierung von Immunsignaturen bei präklinischen chronisch-entzündlichen Darmerkrankungen (CED) könnte ein spezifisches Fenster für frühe therapeutische Interventionen mit krankheitsmodifizierendem Potenzial öffnen. Im Eröffnungsvortrag stellte Dr. Arno Bourgonje, Icahn School of Medicine in New York, die Ergebnisse der PREDICTS-Studie vor.1 Es handelt sich um eine Kohortenstudie auf Basis einer prospektiven medizinischen Datenbank, bei der Soldatinnen und Soldaten der US-Armee über Jahre hinweg medizinisch begleitet werden, inklusive der Abgabe wiederholter Serumproben.
Das Forscherteam entwickelte ein Modell, mit dem die Vorhersage einer CED-Manifestation anhand von spezifischen Serumantikörpern bis zu 10 Jahre vor der eigentlichen Diagnose möglich ist. Die Serumproben wurden zum Zeitpunkt der Diagnose und circa 10, 4 und 2 Jahre vor der Diagnose von Morbus Crohn (MC; n=200) bzw. Colitis ulcerosa (CU; n=200) erhoben und mit gesunden Kontrollen (n=100) verglichen. Das Serumantikörper-Repertoire enthielt rund 357000 mikrobielle, virale, Lebensmittel- und immunassoziierte Peptidantigene. Bei den Probanden mit Prä-MC zeigten sich zunehmend hohe Antikörper(AK)-Spiegel gegen Herpesviren, einschliesslich Epstein-Barr-Virus (EBV), Zytomegalievirus und Varicella-zoster-Virus, sowie gegen eine breite Palette bakterieller Flagelline. Prä-CU-Probanden wiesen zunehmende AK-Konzentrationen gegen Herpesviren und Autoantigene sowie eine reduzierte Reaktivität gegen eingekapselte Bakterien auf (z.B. Streptococcus pneumoniae und Haemophilus influenzae). Die Antikörper-Reaktionen zeigten spezifische prädiagnostische, zeitlich variable Verlaufsmuster und waren mit hoher Genauigkeit prädiktiv für die Entwicklung von MC und CU. Zusätzlich konnten mit dieser Methode komplizierte von nichtkomplizierten MC-Verläufen bis zu 10 Jahre vor der Diagnose unterschieden werden. Damit könnte zukünftig ein Screening für CED-Risikopopulationen möglich werden.1
Anti-Integrin-αvβ6-Autoantikörper als Autoimmunsignatur
Anti-Integrin-αvβ6-Autoantikörper(Anti-αvβ6-AK) sind bei bis zu 90% der Patienten mit CU nachweisbar und gehen der Krankheitsentwicklung voraus. Jedoch gibt es bislang nur wenige Daten zu Anti-αvβ6-AK bei MC. Wissenschaftler am Mount Sinai Hospital in New York untersuchten Anti-αvβ6-IgG in peripheren Blutproben von sieben verschiedenen Kohorten mit präklinischen und manifesten CED sowie Nicht-CED-Kontrollen (HC). Sie analysierten die Zusammenhänge mit der Lokalisation von MC, der Krankheitsaktivität, dem fäkalen Calprotectin und p-ANCA.2
Die Ergebnisse: Die Anti-αvβ6-AK-Spiegel wie auch die Seropositivität bei erwachsenen MC-Patienten waren signifikant höher (16%) im Vergleich zu HC (2%), jedoch niedriger als bei Probanden mit CU (64%). In der pädiatrischen Kohorte fanden sich ähnliche Daten: Die MC-Seropositivität (22%) war höher als bei HC (0%), aber niedriger als bei CU (79%). Die Auswertung in Abhängigkeit von der MC-Lokalisation ergab: Bei Patienten mit L2 (Kolon) waren höhere Spiegel nachweisbar als bei L1 (Ileum), während die Konzentrationen bei Patienten mit L3 (Ileum und Kolon) dazwischenlagen. Anti-αvβ6-AK reflektieren somit das Vorliegen einer Störung der epithelialen Barriere bei MC mit Kolonbefall und stellen eine Autoimmunsignatur dar, die schon Jahre vor Manifestation der Erkrankung nachweisbar ist.2
Subkutane Induktion mit Guselkumab (GRAVITY-Studie)
Guselkumab (GUS) ist ein selektiver Inhibitor der Interleukin(IL)-23p19-Untereinheit. In den Phase-III-Studien (GALAXI)wurde die Wirksamkeit von GUS bei der Behandlung von MC-Patienten mittels intravenöser Induktion und subkutaner Erhaltungstherapie bestätigt. Die Phase-III-Studie GRAVITI untersuchte Wirksamkeit und Sicherheit der subkutanen Gabe von Guselkumab sowohl in der Induktions- als auch in der Erhaltungsphase bei Patienten mit mittelschwerem bis schwerem aktivem Morbus Crohn.3,4 Eingeschlossen wurden Patienten mit MC, die in der Vergangenheit unzureichend auf orale Kortikosteroide, Azathioprin, 6-Mercaptopurin, Methotrexat oder Biologika-Therapien (BIO-IR) angesprochen oder diese nicht vertragen hatten. Sie wurden randomisiert nach den endoskopischen Aktivitätsmarkern CDAI, SES-CD und dem BIO-IR-Status (Biologika-erfahren oder -naiv). In beiden aktiven Studienarmen wurde zur Induktion GUS 400mg s.c. dreimal im Abstand von vier Wochen appliziert (Wochen 0, 4 und 8). In Woche 12 begann die Erhaltungstherapie mit GUS 200mg s.c. alle vier Wochen oder GUS 100mg alle acht Wochen, den gleichen Dosierungen in der Erhaltungstherapie wie in den GALAXI-Studien. Die Patienten der Placebogruppe wurden nach 16 Wochen auf GUS umgestellt.
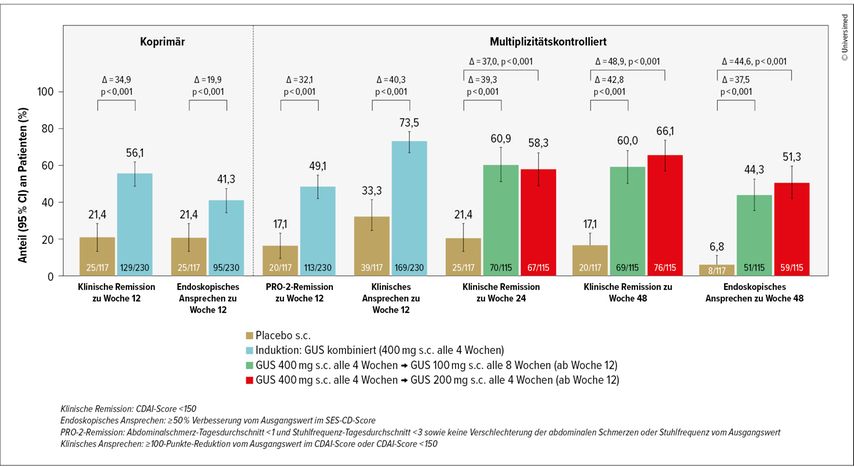
Zu den koprimären Endpunkten zählten klinische Remission und endoskopisches Ansprechen in Woche 12, die PRO(«patient’s reported outcome»)-2-Remission in Woche 12, das klinische Ansprechen in Woche 12, die klinische Remission in Woche 24 und Woche 48 und das endoskopische Ansprechen in Woche 48 (Abb.1). Die Sicherheit wurde bis Woche 48 bewertet. Alle Endpunkte wurden erreicht, die subkutane GUS-400-mg-Induktion zeigte Überlegenheit gegenüber Placebo zu Woche 12. Beide Erhaltungsdosis-Schemata waren gegenüber Placebo auch in den Wochen 24 und 48 überlegen. Diese Daten zeigen, dass sowohl die i.v. als auch die s.c. Induktion wirksam ist.
Abb. 1: GRAVITY: Zusammenfassung der koprimären und multiplizitätskontrollierten Endpunkte bis Woche 48 (modifiziert nach Hart A et al. 2025)3
Die Ergebnisse zur Sicherheit entsprachen dem bekannten Sicherheitsprofil von GUS in den zugelassenen Indikationen. Damit ist Guselkumab der erste IL-23-Inhibitor, der auch subkutan appliziert werden kann.
Ende März 2025 hat die Europäische Arzneimittel-Agentur (EMA) die Zulassungserweiterung für Guselkumab zur Behandlung von Erwachsenen mit mässig bis schwer aktivem MC empfohlen, nachdem Ende Februar die Zulassungsempfehlung für die Therapie bei CU erfolgt war. Zur Indikation CU wurden am ECCO die Ergebnisse der s.c. Induktion mit GUS bis zur Woche 12 aus der ASTRO-Studie präsentiert, die eine mit der i.v. Induktion (QUASAR-Studie) vergleichbare Wirksamkeit zeigen.5
SOR102: orale Antikörper mit lokaler Wirkung im Darm
SOR102 ist eine neuartige oral verabreichte, bispezifische Antikörperkonstruktion. Sie besteht aus zwei Einzeldomänen-Antikörpern («single domain antibodies»; SDA), die gegen TNFα und IL-23p19 gerichtet und durch einen Trypsin-labilen Linker verbunden sind. Der Linker ermöglicht die Trennung der Monomere im Dünndarm und damit die Hemmung der Aktivität von TNFα und IL-23 im intestinalen Gewebe.6
In die Phase-Ib-Studie wurden CU-Patienten mit Mayo-Endoskopie-Score (ES) ≥2, Rektalblutungs-Score (RBS) ≥1 und Stuhlfrequenz-Score (SFS) ≥1 eingeschlossen.6 Primäre Endpunkte waren Sicherheit und Verträglichkeit von SOR102, weiter wurden die Konzentrationen von SOR102 und Monomeren in Serum, Urin und Fäzes sowie von Anti-Drug-Antikörpern analysiert. Explorative Wirksamkeitsendpunkte waren Mayo-Score (MS), modifizierter Mayo-Score (mMS) bzw. klinisches Ansprechen, symptomatische Remission (SR) und die durchschnittliche Veränderung im Vergleich zur Baseline in Bezug auf MS, mMS, CU-100-Score, SFS, RBS, fäkales Calprotectin (FC), C-reaktives Protein (CRP) und Robarts-Histopathologie-Index (RHI). Sicherheit und Wirksamkeit wurden bei allen Patienten, die mehr als eine Dosis SOR102 oder Placebo erhalten hatten, evaluiert.
In der Studie gab es zwei Verum-Gruppen mit kleinen Fallzahlen, die 810mg SOR102 einmal am Tag (QD) oder 810mg zweimal täglich (BID) über sechs Wochen erhielten und mit der Placebogruppe verglichen wurden. 22 Patienten wurden randomisiert, 17 Patienten schlossen die Studie ab, das Durchschnittsalter lag bei 50 Jahren. Die meisten Patienten waren therapienaiv im fortgeschrittenen Stadium.
Im SOR102-BID-Arm wurden höhere MS- und mMS-Raten für klinisches Ansprechen und SR erreicht als bei der Behandlung mit SOR102 QD oder Placebo. Zusätzlich nahmen im Vergleich zur Baseline MS, mMS, CU-100, kombinierter SFS+RBS und RHI deutlicher im BID-Arm als im QD- und Placeboarm ab. Es gab keine signifikanten Unterschiede bei FC und CRP zwischen den Behandlungsgruppen. Unerwünschte Ereignisse wurden bei 56% (BID), 28% (QD) und 60% (Placebo) der Patienten berichtet. Die meisten dieser Ereignisse hatten einen Schweregrad von leicht bis mittelschwer. Insgesamt gesehen wurde SOR102 als sicher und gut verträglich eingestuft. Eine weitere klinische Entwicklung wird daher als gerechtfertigt angesehen.6
Infliximab bei perianalen Fisteln
Bei Patienten mit MC und perianalen Fisteln (PFCD) wurden höhere Serumkonzentrationen von Infliximab (IFX) mit besseren Ergebnissen in Verbindung gebracht. In der klinischen Praxis wird daher bei der Mehrheit der PFCD-Patienten eine Dosissteigerung vorgenommen. Die Pharmakokinetik der IFX-Behandlung bei PFCD ist jedoch bisher nicht speziell beschrieben worden. Eine Studie untersuchte, ob Patienten mit PFCD im Vergleich zu MC-Patienten ohne perianale Fisteln eine veränderte IFX-Pharmakokinetik aufweisen.7
In die Studie wurden Patienten mit MC und solche mit PFCD aufgenommen, die mit einer i.v. IFX-Standarddosis (5mg/kg in Woche 0, 2 und 6, danach alle 8 Wochen) begannen. Ab der zweiten Infusion (Woche 2) bis zu Woche 26 wurden Proben entnommen, um den IFX-Talspiegel (TL) zu messen. Lag der IFX-TL unter 1,0μg/ml (Radioimmunassay), wurden die Antikörper gegen das Medikament (IQR) analysiert. Der Ziel-TL während der Induktion waren 20μg/ml in Woche 2, 15μg/ml in Woche 6 und in Woche 14 10μg/ml für PFCD- und 5μg/ml für MC-Patienten.
Insgesamt wurden 149 Patienten eingeschlossen (63 PFCD, 86 MC) und 761 Serumproben analysiert. Patienten-Parameter wie Alter, Krankheitsdauer und Behandlungsmerkmale waren zwischen den Gruppen weitgehend vergleichbar, nur die Zahl der luminalen Krankheitsaktivitäten und der Verwendung von begleitenden Immunmodulatoren lag bei den MC-Patienten höher. Während der Induktion wurden die IFX-Zielwerte bei einem signifikant geringeren Anteil der PFCD-Patienten im Vergleich zu den MC-Patienten erreicht (43% vs. 57%). In Woche 14 waren die medianen Serum-IFX-Konzentrationen bei PFCD-Patienten (2,8μg/ml; IQR 1,0–5,4) im Vergleich zu MC-Patienten (4,8μg/ml; IQR 2,0–6,6) signifikant niedriger. In Woche 14 wurden die Ziel-IFX-TL bei PFCD-Patienten nur bei 9% (5 von 57) und bei 46% (36 von 78) der MC-Patienten erreicht. Bei 16% (10/63) der PFCD-Patienten und 12% (10/86) der MC-Patienten wurden Antikörper gegen das Medikament nachgewiesen, die bei 35% (7/20) dieser Patienten während der Nachbeobachtungszeit vorübergehend waren.7
Schlussfolgerung der Autoren: Während der Induktion führt die Standard-Infliximab-Dosierung zu einem niedrigeren Talspiegel bei PFCD im Vergleich zu MC. Die zuvor vorgeschlagene Zielkonzentration von IFX in Woche 14 wird nur bei einem Bruchteil der PFCD-Patienten erreicht. Dies kann zu einer verlängerten Krankheitslast beitragen und macht möglicherweise alternative Dosierungsprotokolle bei PFCD erforderlich.7
Da Anti-Drug-Antikörper laut diesen Ergebnissen nicht für die höhere Wirkstoff-Clearance bei den PFCD-Patienten verantwortlich waren, wurden andere Ursachen wie eine höhere Entzündungslast diskutiert. Ebenso könnte eine subkutane IFX-Therapie bessere Effekte zeigen, was bisher noch nicht untersucht wurde.
Mirikizumab bei Morbus Crohn
Mirikizumab (Miri) ist ein Interleukin-23p19-Inhibitor, der in der Schweiz seit November 2023 zur Therapie der CU zugelassen ist. In der EU erhielt Miri im Februar 2025 auch die Zulassung zur Behandlung von Patienten mit MC, die auf eine konventionelle Therapie oder eine Biologika-Behandlung unzureichend angesprochen haben, nicht mehr darauf ansprechen oder eine Unverträglichkeit zeigen.
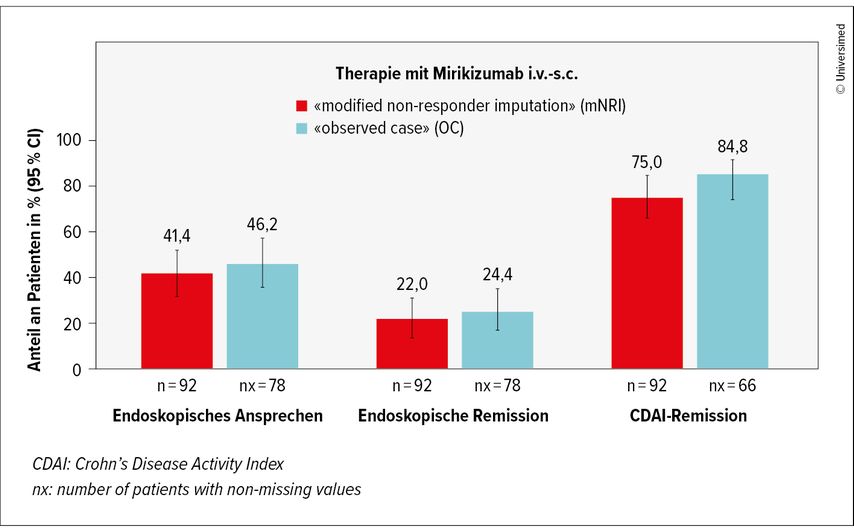
Im Anschluss an die Zulassungsstudie VIVID-1 wurden die Wirksamkeit und die Sicherheit von Miri bei jenen Patienten untersucht, die in der VIVID-1-Studie mit Ustekinumab (Ust) behandelt und in die offene Verlängerungsstudie VIVID-2 aufgenommen wurden.8 Die Dosiszuweisung in VIVID-2 war abhängig vom Erreichen des endoskopischen Ansprechens in VIVID-1. Endoskopische Responder auf Ust wurden auf Miri s.c. 300mg alle 4 Wochen umgestellt; endoskopische Non-Responder erhielten als Induktionstherapie Miri i.v. 900mg in Woche 0, 4 und 8, gefolgt von Miri s.c. 300mg alle 4 Wochen (Miri i.v.-s.c.). Zu den Ergebnissen, die im Rahmen von VIVID-2 bis Woche 52 analysiert wurden, gehörten endoskopisches Ansprechen, endoskopische Remission (SES-CD) und klinische Remission (CDAI <150). Die Sicherheit wurde von der ersten Miri-Dosis in VIVID-2 bis zum Stichtag (2.8.2024) bewertet. Abbrüche oder fehlende Daten wurden mittels «modified non-responder imputation» (mNRI) und «Observed case»(OC)-Analyse adaptiert.
Die Ergebnisse (Abb.2): Von den 92 endoskopischen Non-Respondern auf Ust im Arm Miri i.v.-s.c. erreichten 41,4% (mNRI) bzw. 46,2 % (OC) ein endoskopisches Ansprechen, 22,0% bzw. 24,4% eine endoskopische Remission und 75,0% bzw. 84,8% eine CDAI-Remission.8 Unter den 122 endoskopischen Respondern auf Ust blieb die Wirksamkeit bei allen klinischen und endoskopischen Endpunkten nach dem Wechsel zu Miri s.c. erhalten. Bei jenen Respondern, die sich nicht in Remission befanden, erreichten nach der Umstellung auf Miri s.c. 57,2% bzw. 60,0% eine CDAI-Remission und 26,5% bzw. 28,3% eine endoskopische Remission in Woche 52.
Bei 64,7% der Miri-i.v.-s.c.-Patienten und 62,5% der Miri-s.c.-Patienten wurden unerwünschte Ereignisse gemeldet, die während der Behandlung auftraten. Schwerwiegende unerwünschte Ereignisse wurden bei 6,9% bzw. 7,0% gemeldet, und 1% bzw. 2,3% der Patienten brachen die Behandlung aufgrund von unerwünschten Ereignissen ab.8
Schlussfolgerung: Die Ergebnisse von VIVID-2 zeigten die klinische und endoskopische Wirksamkeit von Miri bis zu einem Jahr bei Patienten mit mässig bis schwer aktivem MC, die zuvor mit Ust behandelt wurden. Mehr als 40% der Patienten, die in der VIVID-1-Studie auf Ust endoskopisch nicht ansprachen, erreichten bei Woche 52 der Miri-Behandlung ein endoskopisches Ansprechen. Die Sicherheitsdaten entsprachen dem bekannten Sicherheitsprofil von Miri.8
Anti-TL1A-Antikörper Duvakitug
Duvakitug ist ein monoklonaler Antikörper, der die Bindung von TL1A an DR3 hemmt, einen der Hauptfaktoren für Entzündungen und Fibrose. Duvakitug hat in CU-Tiermodellen eine Verringerung dieser Symptomatik gezeigt. Wirksamkeit und Sicherheit des Wirkstoffs bei Erwachsenen mit mässig bis schwer aktiver CU oder MC wurden in der Phase-IIb-«Basket»-Studie RELIEVE UCCD untersucht.9,10 Insgesamt lief die Studie über 14 Wochen. Die Patienten erhielten zu Beginn eine s.c. Induktionsdosis von 2250mg Duvakitug oder Placebo (PBO), gefolgt von entweder Duvakitug 450mg, 900mg oder PBO alle 2 Wochen.
In der Gruppe mit MC waren 138 Patienten eingeschlossen (46 pro Arm), bei CU 137 (47/46/44). Sicherheit und Verträglichkeit wurden anhand der Meldung von unerwünschten Ereignissen und der Laborüberwachung bewertet.9
Primärer Endpunkt bei MC war das endoskopische Ansprechen (≥50% Verringerung des SES-CD-Scores gegenüber Baseline) in Woche 14. Beide Duvakitug-Dosierungen erreichten den primären Endpunkt (26%/450mg, 48%/900mg versus 13% PBO). Die Häufigkeit von Nebenwirkungen war bei Duvakitug 900mg (43%) und PBO (48%) ähnlich und niedriger als bei Duvakitug 450mg (67%).9
Beide Duvakitug-Dosierungen erreichten auch bei CU den primären Endpunkt der klinischen Remission in Woche 14 (36%/450mg, 48%/900mg vs. 20% PBO). Die Häufigkeit von unerwünschten Wirkungen war unter Duvakitug (49%/450mg, 43%/900mg) im Vergleich zu PBO (52%) geringer, ebenso die Häufigkeit von unerwünschten Wirkungen, die zum Abbruch der Behandlung führten (0%/450mg, 2%/900mg versus 5%/PBO).10
Der Behandlungseffekt von Duvakitug wurde sowohl bei vorbehandelten als auch bei therapienaiven Patienten beobachtet. Diese Ergebnisse unterstützen die weitere Entwicklung von Duvakitug als Behandlungsoption für Patienten mit mässig bis schwer aktivem MC bzw. CU.9,10
Quelle:
20. Kongress der European Crohn’s and Colitis Organisation (ECCO), 19. bis 22. Februar 2025, Berlin
Literatur:
1 Bourgonje AR et al.: Systemic antibody responses predict the onset of inflammatory bowel disease up to 10 years before diagnosis. ECCO 2025; Präsentation OP01 2 Livanos A et al.: Anti-integrin αvβ6 autoantibodies are detected in preclinical, incident and established colonic Crohn’s disease. ECCO 2025; Präsentation OP28 3 Hart A et al.: Efficacy and safety of subcutaneous guselkumab induction therapy in patients with moderately to severely active Crohn’s disease: results through week 48 from the phase 3 GRAVITI study. ECCO 2025; Präsentation OP33 4 Hart A et al.: Efficacy and safety of guselkumab subcutaneous induction and maintenance in participants with moderately to severely active Crohn’s disease: results from the phase 3 GRAVITI study 3. Gastroenterology 2025; doi: 10.1053/j.gastro.2025.02.033 5 Peyrin-Biroulet L et al.: Efficacy and safety of subcutaneous guselkumab induction therapy in patients with ulcerative colitis: results through week 12 from the phase 3 ASTRO study. ECCO 2025; Präsentation OP10 6 Jairath V et al.: Phase 1b study of SOR102, a novel, orally delivered bispecific anti-TNF/anti-IL-23 domain antibody in patients with mild to severe ulcerative colitis. ECCO 2025; Präsentation OP31 7 Mulders L et al.: Infliximab induction fails to reach targets in perianal fistulizing Crohn’s disease: first results from the ATLANTIC study. ECCO 2025; Präsentation DOP017 8 D’Haens GD et al.: Effectiveness and safety of mirikizumab after switching from ustekinumab in patients with moderate to severe Crohn’s disease: results from a long-term extension study. ECCO 2025; Präsentation DOP046 9 Jairath V et al.: Duvakitug (TEV-48574), an anti-TL1a monoclonal antibody, demonstrates efficacy and favourable safety as an induction treatment in adults with moderately to severely active Crohn’s disease: results from a phase 2b, randomised, double-blind, placebo-controlled dose-ranging, basket trial (RELIEVE UCCD). ECCO 2025; Präsentation OP40 10 Reinisch W et al.: Duvakitug (TEV-48574), an anti-TL1a monoclonal antibody, demonstrates efficacy and favourable safety as an induction treatment in adults with moderately to severely active ulcerative colitis: results from a phase 2b, randomised, double-blind, placebo-controlled, dose-ranging, basket trial (RELIEVE UCCD). ECCO 2025; Präsentation OP41
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...