Traitement de la maladie de Crohn: optimiser le traitement biologique
Compte-rendu:
Dre Corina Ringsell
Rédactrice
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La Pre Dre med. Iris Dotan, du Rabin Medical Center, Petah-Tikva, et de l’Université de Tel Aviv (Israël), a présenté, dans le cadre du 9e cours post-universitaire de l’IBDnet, les possibilités d’optimiser le traitement biologique de la maladie de Crohn (MC).
Keypoints
-
En cas de non-réponse primaire et de perte de réponse, la mesure des taux sériques peut aider à améliorer le traitement anti-TNFα.
-
Après l’induction et au moins une fois pendant le traitement d’entretien, il convient de procéder à un monitorage proactif des taux sériques de la substance active.
-
Une monothérapie anti-TNFα optimisée est une alternative possible à l’association d’un traitement anti-TNFα à un traitement immunomodulateur.
-
Il existe des preuves d’une corrélation entre le taux minimal des médicaments biologiques et la réponse clinique et endoscopique.
-
L’optimisation du traitement passe donc aussi par la mesure des taux minimaux. C’est le cas de l’infliximab, de l’adalimumab et de l’ustékinumab, moins du vedolizumab.
-
La combinaison de médicaments biologiques pourrait être une voie d’optimisation à l’avenir.
Si l’on veut optimiser et personnaliser le traitement des maladies inflammatoires chroniques de l’intestin (MICI), il faut traiter plus intelligemment, c’est-à-dire prédire qui sera mieux soigné avec quel médicament, a expliqué la Dre I. Dotan. Il faut commencer la thérapie plus tôt, viser l’amélioration biochimique et endoscopique et traiter plus efficacement. Cela signifie que l’on s’intéresse à ce que les patient·es reçoivent réellement, a-t-elle déclaré.
Pourquoi optimiser le traitement?
La Dre I. Dotan a souligné que l’optimisation s’applique à chaque partie du cycle du médicament; du choix du médicament à l’induction et au maintien, en passant par la manière de prévenir et d’évaluer la perte de réponse que connaissent de nombreux·ses patient·es. Les anticorps anti-TNFα existent p.ex. depuis environ 25ans, mais ce n’est qu’au bout d’une dizaine d’années que l’on s’est rendu compte que leur utilisation présentait des lacunes. Celles-ci incluent la perte de réponse ainsi que le fait qu’une partie des patient·es ne réagit pas aux médicaments. En outre, certains patient·es répondent au traitement, mais n’obtiennent pas de rémission. Il faut se demander ce que l’on peut faire de mieux, a déclaré I. Dotan. On essaie également de minimiser les effets secondaires et d’être rentable.
Pour obtenir des améliorations cliniquement significatives, une exposition plus importante aux produits biologiques est nécessaire pour atteindre des taux plus élevés de principe actif, a-t-elle expliqué.1 C’est là que la pharmacocinétique et la pharmacodynamie des anticorps monoclonaux entrent en jeu, ainsi que les facteurs qui influencent la pharmacocinétique. Pour les anticorps anti-TNFα, il s’agit notamment de l’apparition d’anticorps contre le médicament, d’un faible taux d’albumine et d’un IMC élevé.2,3 Il est donc important de déterminer les taux de principe actif à un stade précoce afin de s’assurer que les patient·es bénéficient effectivement du médicament, ajoute I. Dotan. Les doses d’induction plus élevées ne sont pas nécessairement supérieures aux doses standard, comme l’a montré l’étude SERENE CD avec l’adalimumab chez les patient·es atteint·es de la MC.4
Que faire en cas d’anticorps anti-médicament?
Des anticorps anti-médicaments (ADA) peuvent se former lorsque les patient·es sont traité·es de manière irrégulière, p.ex. lorsqu’ils/elles ont arrêté de prendre le médicament en raison d’une maladie ou pendant un voyage. Des ADA peuvent également apparaître en cas de taux sériques infra-thérapeutiques ou chez les patient·es qui éliminent rapidement les substances entre les différentes prises de médicaments. Le risque est également plus élevé en cas d’antécédents d’ADA contre un traitement anti-TNFα, ainsi que chez les patient·es ayant une prédisposition génétique (porteurs de l’allèle HLA-DQA1*05).5–7
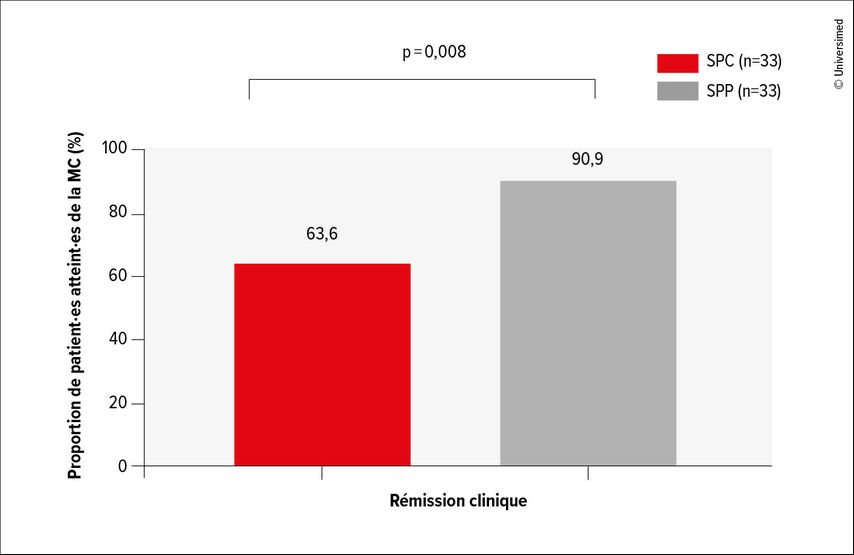
L’étude SONIC sur l’infliximab dans la MC a montré que l’association avec l’azathioprine inhibait la formation d’ADA.8 En revanche, dans le cas de l’adalimumab, l’association avec l’azathioprine n’est pas supérieure à la monothérapie.9 I. Dotan a souligné que toute perte de réponse n’était pas due à l’immunogénicité et à l’ADA.10 Il convient donc de tenir compte de tous les facteurs susceptibles d’influencer la réponse, comme l’obésité, le tabagisme et le taux d’albumine. Il est également important de déterminer les taux minimaux des médicaments afin d’adapter les intervalles de perfusion et le dosage correspondants.11 Un tel dosage contrôlé avec précision prolonge la durée d’action de l’infliximab, entraîne des taux de rémission clinique plus élevés et réduit l’immunogénicité (Fig. 1).12–14
Fig. 1: Taux de rémission clinique à 12 mois chez des patient·es atteint·es de la maladie de Crohn (MC) traités soit selon un schéma posologique conventionnel (SPC), soit selon un schéma précis (SPP) (mod. d’après Strik AS et al. 2021)14
Corrélation entre les taux sériques et les taux de réponse
L’étude SEAVUE était une comparaison directe de l’adalimumab et de l’ustékinumab chez des patient·es atteint·es d’une MC modérée ou sévère qui n’avaient pas encore été traités par des médicaments biologiques. Entre autres, la corrélation des taux minimaux respectifs avec la rémission clinique et la réponse endoscopique a également été évaluée. Il s’est avéré que la réponse endoscopique était plus élevée chez les patient·es dont les taux minimaux des deux agents figuraient dans le quartile supérieur.15 Il est donc également judicieux de considérer les niveaux d’agent de l’ustékinumab, ce qui n’est normalement pas fait dans la pratique clinique, a déclaré I. Dotan. Optimiser la thérapie implique donc aussi de mesurer les taux minimaux. Cela vaut pour l’infliximab, l’adalimumab et l’ustékinumab, mais moins pour le vedolizumab,16 a-t-elle souligné. Les taux minimaux nécessaires devraient être définis et vérifiés afin d’utiliser correctement les substances actives disponibles et de ne pas simplement passer au traitement suivant.
Pour certains patient·es, un traitement double combinant différents mécanismes d’action pourrait également s’avérer bénéfique. C’est ce qu’a démontré l’étude ouverte EXPLORER.17 Elle a examiné la triple combinaison de vedolizumab, d’adalimumab et de méthotrexate chez des patient·es atteint·es de la MC récemment diagnostiquée et n’ayant pas encore reçu de traitement biologique. Le critère d’évaluation primaire était la rémission endoscopique à la semaine 26, le critère secondaire la rémission clinique aux semaines 10 et 26. À la semaine 26, le traitement combiné a entraîné une rémission endoscopique chez 34% des patient·es et une rémission clinique sans nouveau signal de sécurité chez 54% d’entre eux. Ce traitement triple a entraîné des taux plus élevés de rémission endoscopique par rapport au vedolizumab ou à l’adalimumab en monothérapie, avec une probabilité de 86% et 71% respectivement.17 La thérapie combinée est donc une autre voie pour optimiser le traitement de la MC, bien que d’autres études avec différentes combinaisons de principes actifs soient nécessaires, a conclu I. Dotan.
Source:
IBDnet 9th Postgraduate Course, du 5 au 7 décembre 2024, à Ermatingen
Littérature:
1 Yarur AJ et al.: Higher infliximab trough levels are associated with perianal fistula healing in patients with Crohn’s disease. Aliment Pharmacol Ther 2017; 45: 933-40 2 Brandse JF et al.: Pharmacokinetic features and presence of antidrug antibodies associate with response to infliximab induction therapy in patients with moderate to severe ulcerative colitis. Clin Gastroenterol Hepatol 2016; 14: 251-8.e1-2 3 Ordás I et al.: Anti-TNF monoclonal antibodies in inflammatory bowel disease: pharmacokinetics-based dosing paradigms. Clin Pharmacol Ther 2012; 91: 635-46 4 D’Haens GR et al.: Higher vs standard adalimumab induction dosing regimens and two maintenance strategies: randomized SERENE CD trial results. Gastroenterology 2022; 162: 1876-90 5 Vermeire S et al.: Effectiveness of concomitant immunosuppressive therapy in suppressing the formation of antibodies to infliximab in Crohn’s disease. Gut 2007; 56: 1226-31 6 Kennedy NA et al.: Predictors of anti-TNF treatment failure in anti-TNF-naive patients with active luminal Crohn’s disease: a prospective, multicentre, cohort study. Lancet Gastroenterol Hepatol 2019; 4: 341-53 7 Sazonovs A et al.: HLA-DQA1*05 carriage associated with development of anti-drug antibodies to infliximab and adalimumab in patients with Crohn’s disease. Gastroenterology 2020; 158: 189-99 8 Colombel JF et al.: Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362: 1383-95 9 Matsumoto T et al.: Adalimumab monotherapy and a combination with azathioprine for Crohn’s disease: a prospective, randomized trial. J Crohns Colitis 2016; 10: 1259-66 10 Alsoud D et al.: Letter: immunogenicity is not the root cause for loss of response to anti-TNF agents in patients with IBD in TDM era. Aliment Pharmacol Ther 2022; 55: 885-6 11 Dotan I et al.: Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study. Inflamm Bowel Dis 2014; 20: 2247-59 12 Dubinsky MC et al.: Dashboard-driven accelerated infliximab induction dosing increases infliximab durability and reduces immunogenicity. Inflamm Bowel Dis 2022; 28: 1375-85 13 Vermeire S et al.: Forecasted infliximab concentrations during induction predict time to remission and sustained disease control of inflammatory bowel disease. Clin Res Hepatol Gastroenterol 2024; 48: 102374 14 Strik AS et al.: Efficacy of dashboard driven dosing of infliximab in inflammatory bowel disease patients; a randomized controlled trial. Scand J Gastroenterol 2021; 56: 145-54 15 Sands BE et al.: Ustekinumab versus adalimumab for induction and maintenance therapy in biologic-naive patients with moderately to severely active Crohn’s disease: a multicentre, randomised, double-blind, parallel-group, phase 3b trial. Lancet 2022; 399: 2200-11 16 Takenaka K et al.: Transmural remission characterized by high biologic concentrations demonstrates better prognosis in Crohn’s disease. J Crohns Colitis 2023; 17: 855-62 17 Colombel JF et al.: Vedolizumab, adalimumab, and methotrexate combination therapy in Crohn’s disease (EXPLORER). Clin Gastroenterol Hepatol 2024; 22: 1487-96.e12
Das könnte Sie auch interessieren:
Les cellules CAR-T: progrès dans les tumeurs solides et les maladies auto-immunes
L’European CAR T-cell Meeting, organisé conjointement par l’European Hematology Association (EHA) et l’European Society for Blood and Marrow Transplantation (EBMT), aeu lieu cette année ...
Développements novateurs dans le traitement du NSCLC
De nouvelles données d’études du Congrès Européen sur le Cancer du Poumon (ELCC) pourraient modifier durablement le paysage thérapeutique du carcinome pulmonaire non à petites cellules ( ...
Focus sur l’hémophilie, les transfusions et les thromboses
La 69e réunion annuelle de la Société pour la recherche sur la thrombose et l’hémostase (GTH), qui s’est tenue mi-février 2025, avait pour thème «Advances, Research, Technology and ...