Les cellules CAR-T: progrès dans les tumeurs solides et les maladies auto-immunes
Compte-rendu:
Therese Schwender
L’European CAR T-cell Meeting, organisé conjointement par l’European Hematology Association (EHA) et l’European Society for Blood and Marrow Transplantation (EBMT), aeu lieu cette année pour la septième fois. Le programme de l’événement hybride comprenait notamment des présentations sur l’utilisation des cellules CAR-T dans les tumeurs solides et les maladies auto-immunes.
Le Dr méd. John Maher (Londres, Royaume-Uni) a expliqué dans sa présentation le développement de LEU011, un produit à base de cellules CAR-T ciblant NKG2DL («natural killer group 2D ligands»), pour le traitement de tumeurs solides. Les NKG2DL sont exprimés par de nombreuses tumeurs et constituent donc une cible prometteuse pour le traitement par cellules CAR-T.1 Comme l’a rapporté J. Maher, LEU011 a donné de bons résultats dans des études précliniques sur des modèles de différentes tumeurs solides, notamment le cancer colorectal, du pancréas, de l’ovaire et du sein, ainsi que les mésothéliomes.
«Par exemple, à l’aide d’une xénogreffe intrapéritonéale de cancer de l’ovaire, nous avons pu montrer que les cellules tumorales étaient déjà localisées 24 heures après l’administration par voie intraveineuse des cellules CAR-T», a déclaré J. Maher, ajoutant qu’une xénogreffe par voie sous-cutanée de cancer du pancréas avait également permis de confirmer que les cellules CAR-T pénétraient effectivement dans les tumeurs. «Entre-temps, nous avons pu lancer l’étude clinique de phaseI/II AERIAL portant sur LEU011», a-t-il rapporté. L’étude vise à déterminer la dose maximum tolérée de LEU011 chez les adultes atteints de tumeurs solides récidivantes ou réfractaires.
ROR2 dans le carcinome rénal àcellules claires
Le ROR2 («receptor tyrosine kinase-like orphan receptor 2») constitue une autre cible intéressante pour un traitement par cellules CAR-T.
«Nous avons constaté que le ROR2 est souvent présent dans les lignées cellulaires ainsi que les échantillons de tumeurs primitives de carcinome rénal à cellules claires et de myélome multiple», a expliqué le Prof. Dr méd. Michael Hudecek (Wurtzbourg, Allemagne).
Afin d’étudier l’efficacité des cellules CAR-T spécifiques au ROR2, deux produits à base de CAR avec des affinités de liaison dix fois différentes pour le même épitope de ROR2 ont été développés.2 In vitro, les deux produits ont montré une forte réactivité antitumorale spécifique à l’antigène, en particulier en ce qui concerne la lyse des cellules tumorales, la sécrétion des cytokines IL-2 et INFγ ainsi que la prolifération des cellules T.
«In vivo, on a observé une efficacité antitumorale de longue durée ainsi que des avantages significatifs en termes de survie et de persistance des cellules T à long terme. On a aussi constaté une tendance à une plus grande efficacité antitumorale des cellules T exprimant le CAR avec une plus grande affinité pour le ROR2, tant in vitro qu’in vivo», a expliqué M. Hudecek.
Les données préliminaires de toxicité indiquent également que les cellules CAR-T spécifiques au ROR2 présentent un profil de sécurité avantageux.2 Une étude de phaseI multicentrique est actuellement en préparation pour évaluer la sécurité et l’efficacité du traitement par cellules CAR-T spécifiques au ROR2 chez les patient·es atteint·es de myélome multiple et de carcinome rénal à cellules claires. «Nous pensons que l’étude démarrera au premier trimestre 2026», a conclu M. Hudecek.
Traitement par cellules CAR-T en cas de glioblastome récidivant
Dans le cas du glioblastome, il existe un besoin important de nouvelles options thérapeutiques en raison de son pronostic toujours défavorable et des options thérapeutiques limitées.
Le Prof. Dr méd. Denis Migliorini (Genève, Suisse) a expliqué que «les défis posés par ces tumeurs incluent l’hétérogénéité des antigènes tumoraux exprimés et l’environnement tumoral immunosuppressif». L’année dernière, plusieurs publications sur l’utilisation des cellules CAR-T dans le glioblastome ont suscité une grande attention. Parmi elles, une étude de phaseI portant sur les cellules CAR-T administrées par voie intrathécale et ciblant à la fois le récepteur du facteur de croissance épidermique (EGFR) et la sous-unité α2 du récepteur de l’interleukine 13 (IL13Rα2) (Fig. 1).3
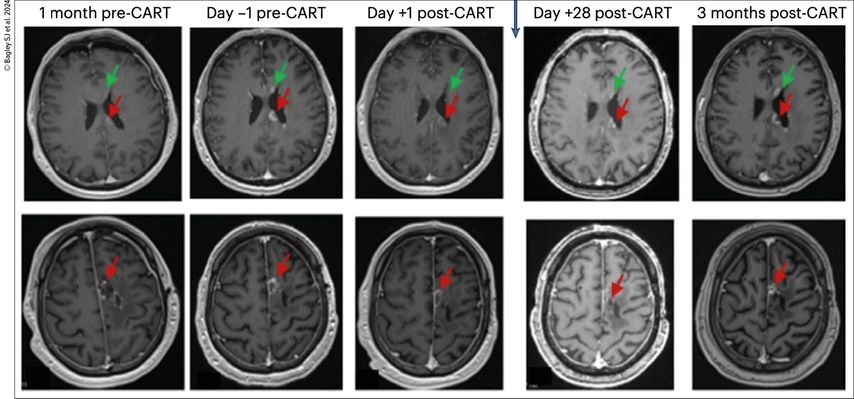
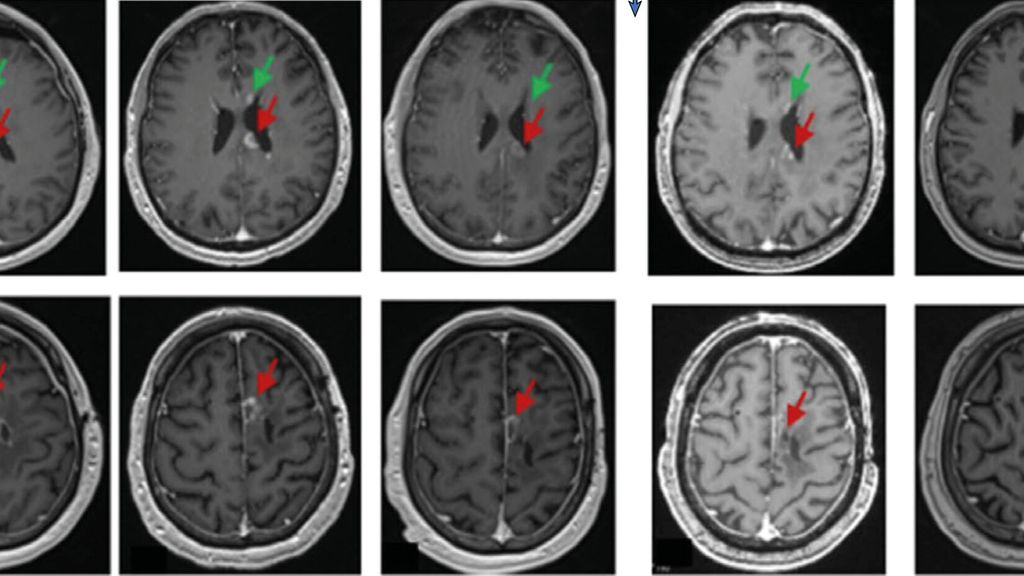
Fig. 1: Exemple des IRM d’un patient atteint de glioblastome réalisées sur une période allant d’un mois avant l’administration des cellules CAR-T ciblant EGFR et IL13Rα2 (dose de niveau 2) à trois mois après l’administration. Les images axiales pondérées en T1 et rehaussées par le gadolinium ont montré une augmentation des foyers de maladie renforcés à J-1, y compris dans le corps calleux (champ supérieur, flèche rouge), le long de la surface épendymaire du ventricule latéral gauche (champ supérieur, flèche verte) et autour de celle de la cavité de résection frontale gauche (champ inférieur, flèche rouge). Les images réalisées à J+1, avant l’administration de corticoïdes, montrent une diminution pour tous les sites. Les lésions étaient stables à J+28 et sont restées inchangées à l’IRM à 3 mois (source: Bagley SJ et al. 2024)3
«Comme l’ont révélé les données des six premier·ères participant·es à cette étude, le traitement a montré une activité antitumorale immédiate et puissante», a déclaré l’intervenant. Cependant, la durée de réponse était courte et une neurotoxicité significative a été observée, bien que réversible dans tous les cas. D. Migliorini et son équipe ont recherché de manière ciblée d’autres antigènes susceptibles d’être des cibles pour un traitement par cellules CAR-T. Leur choix s’est porté sur le récepteur PTPRZ1 («protein tyrosine phosphatase receptor type Z1»).4 En outre, ils ont opté pour une production des cellules CAR-T par introduction d’ARNm, contrairement à la procédure habituelle par transduction virale.
«Dans le contexte clinique d’un glioblastome, cela me semble intéressant, car l’introduction d’ARNm n’entraîne qu’une expression transitoire du CAR et constitue peut-être une approche sûre», a-t-il expliqué. De plus, le processus de production des cellules CAR-T prendrait ainsi moins de temps, ce qui constitue également un avantage.
Dans une étude préclinique, les cellules CAR-T ciblant PTPRZ1 ont montré une cytotoxicité spécifique contre les cellules de glioblastome exprimant le PTPRZ1.4 «Il était également remarquable que ces cellules CAR-T étaient capables de détruire les cellules tumorales voisines n’exprimant pas le PTPRZ1 par un effet «bystander», tandis que les tissus sains étaient épargnés», a déclaré D. Migliorini.
Un autre groupe de recherche a étudié l’effet d’un traitement par cellules CAR-T ciblant ROBO1 («roundabout guidance receptor 1») dans un modèle préclinique de souris.5 Une dose unique de ces cellules CAR-T a permis de doubler la durée médiane de survie dans les glioblastomes récidivants. La même étude a examiné l’efficacité des cellules CAR-T ciblant ROBO1 dans d’autres tumeurs cérébrales.
Dans des modèles de médulloblastome récidivant chez des enfants et des adultes présentant des métastases cérébrales de cancer du poumon, les cellules CAR-T ciblant ROBO1 ont entraîné une éradication de la tumeur chez 50 à 100% des souris. Enfin, une étude de preuve de principe (POP) a récemment examiné l’utilisation de cellules TCR («T-cell receptor engineered») ciblant PTPRZ1 et provenant d’un patient atteint de glioblastome vacciné.6 «Une étude clinique est en préparation à ce sujet», a expliqué D. Migliorini.
Traitement par cellules CAR-T dans les maladies auto-immunes
Outre l’utilisation des cellules CAR-T dans les tumeurs solides, un autre thème central de l’événement était l’utilisation de cette forme de traitement dans les maladies auto-immunes. Dre méd. Johanna Richter a ainsi présenté un compte-rendu sur l’utilisation d’un traitement par cellules CAR-T ciblant CD19 chez cinq personnes atteintes de sclérose en plaques.
«Notre objectif était d’étudier l’efficacité et la sécurité de ce traitement dans la sclérose en plaques», a-t-elle déclaré. Un patient était atteint de sclérose en plaques (SEP) primaire progressive, une patiente d’une SEP secondaire progressive et les trois autres d’une SEP récurrente-rémittente (les résultats des deux personnes présentant une SEP progressive ont déjà été publiés).7 L’âge moyen était de 35 ans et la durée moyenne de la maladie de 8 ans. Les cinq personnes examinées étaient fortement prétraitées, notamment par des anticorps ciblant CD20. Après une lymphodéplétion standard, tous·tes les participant·es ont reçu 1,1x108 cellules CAR-T entièrement humaines de deuxième génération ciblant CD19 (KYV-101).
«Tous·tes les patient·es ont montré une expansion des cellules CAR-T dans le sang périphérique, mais la persistance était relativement courte», a expliqué J. Richter. Une expansion des cellules CAR-T dans le liquide céphalorachidien (LCR) a en outre pu être mise en évidence chez l’ensemble des patient·es. «Comparé au sang périphérique, le LCR a montré un enrichissement relatif des cellules CAR-T», a-t-elle ajouté.
L’IRM a révélé une seule lésion de la moelle épinière non réhaussée par le gadolinium chez trois des participant·es à différents moments après la perfusion de cellules CAR-T.
«Ces lésions n’étaient toutefois pas accompagnées de symptômes cliniques et leur étiologie n’est pas claire à l’heure actuelle», a-t-elle ajouté. Le score EDSS («expanded disability status scale») moyen est resté stable sur une période moyenne de 8,7 mois chez quatre des cinq personnes atteintes de SEP.
«La production intrathécale d’anticorps a rapidement diminué chez quatre des cinq participant·es jusqu’au jour 14 après la perfusion de cellules CAR-T. Dans un cas, les anticorps ont complètement disparu de manière transitoire. Chez trois participant·es, la production d’anticorps a ensuite progressivement repris, ce qui plaide en faveur d’un effet dépendant de l’expansion», a déclaré J. Richter.
Profil de sécurité satisfaisant
Le profil de sécurité du traitement par cellules CAR-T s’est révélé globalement satisfaisant. Aucun cas de syndrome de neurotoxicité associée aux cellules immunitaires effectrices (ICANS) n’a été observé. Quatre participant·es à l’étude ont présenté un syndrome de libération de cytokines (CRS) de grade1, qui a pu être bien contrôlé. En outre, diverses toxicités hématologiques (anémie [grade3], neutropénie [grade2 à 4], thrombopénie [grade1]), également faciles à traiter, sont apparues, ainsi qu’une élévation des transaminases (de grade3 chez trois patient·es).
Administration d’une deuxième perfusion de cellules CAR-T
Le participant à l’étude présentant la plus faible expansion des cellules CAR-T (SEP primaire progressive) a reçu une deuxième perfusion de KYV-101 265 jours plus tard. Toutefois, aucune expansion des cellules CAR-T dans le sang périphérique n’a été observée par la suite.
J. Richter a conclu: «les analyses disponibles à ce jour révèlent que KYV-101 présente un profil de sécurité satisfaisant chez les personnes atteintes de SEP fortement réfractaire. La cinétique observée des cellules CAR-T indique un effet transitoire dépendant de l’expansion. De plus, il s’agit de la première description d’une deuxième perfusion de cellules CAR-T ciblant CD19 dans la SEP. Il est maintenant important que d’autres études soient menées sur cette forme de traitement dans la SEP.»
Source:
7e European CAR T-cell Meeting, 6–8 février 2025, Strasbourg, France, et en ligne
Littérature:
1 Spear P et al.: NKG2D ligands as therapeutic targets. Cancer Immun 2013; 13: 8 2 Weber JC: Development and preclinical assessment of ROR2-specific CAR-T cells for the treatment of clear cell renal cell carcinoma and multiple myeloma. Doctoral thesis for a doctoral degree at the Graduate School of Life Sciences, Julius-Maximilians-Universität Würzburg, Section Infection and Immunity. 2022. Disponible sur urn:nbn:de:bvb:20-opus-310399 3 Bagley SJ et al.: Intrathecal bivalent CAR T cells targeting EGFR and IL13Rα2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med 2024; 30(5): 1320-9 4 Martinez Bedoya D et al.: PTPRZ1-targeting RNA CAR T cells exert antigen-specific and bystander antitumor activity in glioblastoma. Cancer Immunol Res 2024; 12(12): 1718-35 5 Chokshi CR et al.: Targeting axonal guidance dependencies in glioblastoma with ROBO1 CAR T cells. Nat Med 2024; 30(10): 2936-46 6 Chih YC et al.: Vaccine-induced T cell receptor T cell therapy targeting a glioblastoma stemness antigen. Nat Commun 2025; 16(1): 1262 7 Fischbacher F et al.: CD19-targeted chimeric antigen receptor T cell therapy in two patients with multiple sclerosis. Med 2024; 5(6): 550-558.e2
Das könnte Sie auch interessieren:
Développements novateurs dans le traitement du NSCLC
De nouvelles données d’études du Congrès Européen sur le Cancer du Poumon (ELCC) pourraient modifier durablement le paysage thérapeutique du carcinome pulmonaire non à petites cellules ( ...
Focus sur l’hémophilie, les transfusions et les thromboses
La 69e réunion annuelle de la Société pour la recherche sur la thrombose et l’hémostase (GTH), qui s’est tenue mi-février 2025, avait pour thème «Advances, Research, Technology and ...
Traitement de la maladie de Crohn: optimiser le traitement biologique
La Pre Dre med. Iris Dotan, du Rabin Medical Center, Petah-Tikva, et de l’Université de Tel Aviv (Israël), a présenté, dans le cadre du 9e cours post-universitaire de l’IBDnet, les ...