Sequenztherapie bei extrapulmonalen neuroendokrinen Karzinomen
Autor:innen:
Ap. Prof. Priv.-Doz. DDr. Barbara Kiesewetter
Dr. Philipp Melhorn
Ao. Univ.-Prof. Dr. Markus Raderer
Klinische Abteilung für Onkologie
Univ.-Klinik für Innere Medizin I
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Neuroendokrine Karzinome (NEC) sind besonders aggressive Malignome, die häufig im metastasierten Stadium diagnostiziert werden und mit einem schlechten Überleben assoziiert sind. NEC der Lunge, vor allem das kleinzellige Lungenkarzinom (SCLC), bilden mit ca. 90% und einer Inzidenz von über 8/100000/Jahr die größte Gruppe der NEC, während NEC des Verdauungssystems (0,4/100000/Jahr) und anderer Lokalisationen (beispielsweise urogenitales System oder „carcinoma of unknown primary“) eher selten auftreten.1
Keypoints
-
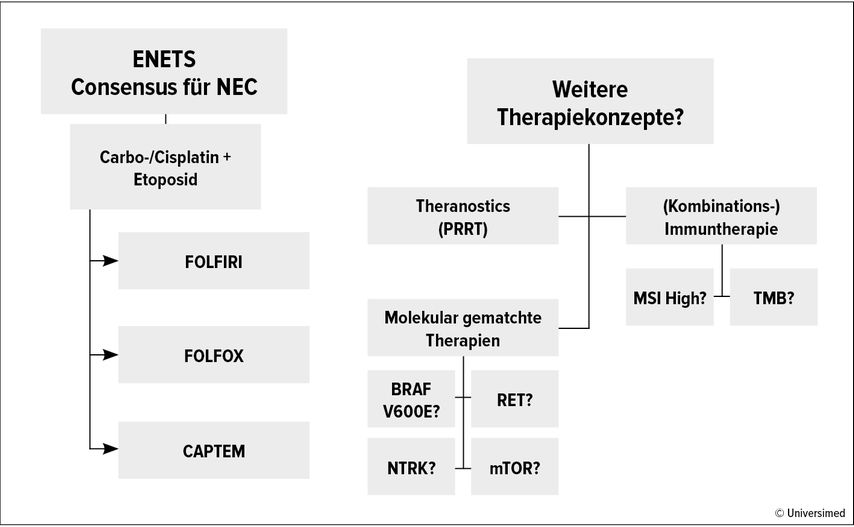
Platinbasierte Therapie weiterhin Standard-Erstlinie bei NEC.
-
Optionen bei Progress sind FOLFIRI, FOLFOX und u.a.
-
Faktoren dafür sind Therapieansprechen, Toxizität und die Zentrumserfahrung.
-
Immuntherapie hat weiterhin keine generelle Empfehlung.
-
Immuntherapie für Einzelfälle möglich, NGS/„Precision Medicine“ (BRAF bei Colon?) ebenfalls.
-
„Unmet clinical need“: klinische Studien, die diese Kriterien berücksichtigen!
Die Prognose ist generell schlecht mit einem medianen Gesamtüberleben von unter einem Jahr. Somit besteht oft ein sehr hoher Therapiedruck. Während die platinbasierte Chemotherapie weiterhin den Standard in der Erstlinie darstellt, gibt es nur wenige klare Empfehlungen für das onkologische Management im Rezidiv. Dieser Artikel gibt einen Überblick über mögliche Therapiesequenzen bei extrapulmonalen NEC (epNEC) im metastasierten Setting.
Extrapulmonale NEC vs. Lungen-NEC
Historisch gesehen und in Anbetracht der biologischen Verwandtschaft hat man sich bei der Therapie von epNEC am SCLC orientiert, so wird beispielsweise Platin/Etoposid in Analogie zur Therapie bei SCLC angewendet. Es wird aber zunehmend klar, dass es sich bei epNEC um eigenständige Entitäten zu handeln scheint, die sich klinisch (z.B. schwächere Assoziation mit Tabakrauchen und weniger Hirnmetastasen) und biologisch (z.B. niedrigere Häufigkeit von Mutationen in TP53 und RB1) doch deutlich von SCLC unterscheiden.2 Im Folgenden wird nur auf epNEC eingegangen.
Erstlinientherapie
Die platinbasierte Chemotherapie in Kombination mit Etoposid ist weiterhin Standard in der Erstlinie bei epNEC. In retrospektiven Arbeiten zeigte sich für Platin/Etoposid eine Ansprechrate von 30–50%, ein medianes progressionsfreies Überleben (PFS) von 4–6 Monaten und ein medianes Gesamtüberleben (OS) von 11–12 Monaten.3 Praktisch die gleichen Ergebnisse für dieses Regime (Cisplatin/Etoposid) wurden auch in zwei rezenten asiatischen randomisierten Studien berichtet – der Kontrollarm mit Cisplatin/Irinotecan hatte eine vergleichbare Effektivität ohne zusätzlichen Benefit.4,5
Die Evidenz für eine Empfehlung Cisplatin vs. Carboplatin als Kombinationspartner ist rar und mögliche Confounder wie Komorbiditäten erschweren die Interpretation verfügbarer Studien. Die aktuellen ENETS-Leitlinien empfehlen Carboplatin aufgrund besserer Tolerierbarkeit.3
„Room for improvement“ in der Erstlinie
Checkpoint-Inhibitoren haben beim SCLC in der Erstlinie einen signifikanten Überlebensvorteil gezeigt. Ob sich dieser Erfolg auch auf extrapulmonale NEC übertragen lässt, wurde in der NICE-NEC-Studie untersucht. In dieser Phase-II-Studie wurde bei 38 Patient:innen ein Therapiekonzept aus Induktionsphase mit Carboplatin/Etoposid plus Nivolumab für sechs Zyklen sowie Erhaltungsphase mit Nivolumab alle vier Wochen getestet.6
Die Ergebnisse sind im Wesentlichen vergleichbar mit historischen Daten ohne Immuntherapie und die Aussagekraft dieser Studie ist limitiert durch den Einschluss der prognostisch besseren neuroendokrinen Tumoren Grad 3 (NET G3), wodurch sich ein sehr heterogenes Kollektiv ergibt.
Weitere Studien befinden sich diesbezüglich in der Rekrutierungsphase. Generell lässt sich jedoch festhalten, dass bei epNEC eine Mikrosatelliteninstabilität (MSI) eher selten und die Tumormutationslast (TMB) eher niedrig ist, sodass womöglich nur eine Subgruppe von dieser Add-on-Therapie profitieren könnte.
Des Weiteren könnte die FOLFIRINEC-Studie (NCT04325425, geplantes n=218) das aktuelle Therapieparadigma verändern, falls sich in dieser Phase-II-Studie die Dreifachkombination mFOLFIRINOX (5-FU, Oxaliplatin, Irinotecan) gegenüber Platin/Etoposid überlegen zeigt. Die Phase-II-Studie ECOG-ACRIN EA2142 hat Capecitabin/Temozolomid (CAPTEM) vs. Platin/Etoposid in der Erstlinie bei einem gemischten NEC/NET-G3-Kollektiv (n=67) untersucht und wurde wegen Futility frühzeitig gestoppt.7
Abb. 1: Aktuelle ENETS-Leitlinienempfehlungen für GEP-NEC (siehe Sorbye H et al.3) und weitere Therapiekonzepte
Zweitlinientherapie und danach
In der Zweitlinie gibt es bei epNEC keinen eindeutigen Favoriten bei insgesamt sehr eingeschränkter Prognose (medianes PFS meist <4 Monate, OS <8 Monate).8 Kombinations-Chemotherapien wie FOLFIRI, FOLFOX und CAPTEM werden oft bei gastroenteropankreatischen (GEP) NEC eingesetzt.3 Die beste Evidenz existiert aktuell für FOLFIRI: In einer Phase-II-Studie (PRODIGE 41-BEVANEC) mit 133 NEC-Patient:innen wurde FOLFIRI mit FOLFIRI+Bevacizumab verglichen, wobei sich kein Unterschied im Outcome zeigte (Ansprechrate 18–26%, medianes PFS von 3,5–3,7 Monaten und medianes OS von 7–8,9 Monaten).9
Eine andere Phase-II-Studie (NET-02) – ebenfalls dieses Jahr publiziert – untersuchte liposomales Irinotecan (nal-IRI) mit 5-FU/Folinsäure vs. Docetaxel. Mit einem medianen PFS <3 Monaten und OS von 6 Monaten wird leider auch diese Studie die Praxis nicht beeinflussen10 und Docetaxel und auch Topotecan werden in der aktuellen ENETS-Leitlinie auch nicht als Therapieoptionen unterstützt.3
Sehr wohl kann aber eine Platin/Etoposid-Reinduktion (bei initialem Ansprechen) analog zum SCLC eine Option sein – das zeigte auch die bedeutsame NORDIC-NEC-Studie von 2013, in der 15% eine Tumorresponse und 27% eine Tumorstabilisierung nach einem Progress auf Platin/Etoposid zeigten.11
Theranostics
Bis zu 40% der NEC sind in der Somatostatin-Rezeptor-Bildgebung positiv, sodass hier auch eine Peptidrezeptor-Radionuklid-Therapie (PRRT) erwogen werden könnte. Wie in einem Review von (nur) retrospektiven Arbeiten gezeigt, schien die PRRT auch zu relativ hohen Ansprechraten (ca. 40%) zu führen.12
Es wurde aber auch festgestellt, dass PFS und OS bei den höherproliferativen NEC (Ki-67 >55%) deutlich kürzer sind als bei den weniger schnell proliferierenden (medianes PFS von 4 vs. 11 Monate und medianes OS von 9 vs. 22 Monate). Daher sollte diese Therapie nur bei ausgewählten Patient:innen mit günstiger Prognose in Betracht gezogen werden.
Außerdem ergeben sich logistische Fragestellungen, da die üblichen vier Therapiezyklen im Abstand von acht Wochen angesichts einer teils schnellen Tumorprogression doch sehr zurückhaltend wirken.
Immuntherapie
Die Mono-Immuntherapie ist kein Gamechanger bei platinrefraktären epNEC, soweit man dies von den bisherigen Studien zu Pembrolizumab, Spartalizumab und Avelumab sagen kann.3 Kombinations-Immuntherapien zeigen hingegen Ansprechraten von ca. 10 bis über 20% – so beispielsweise die DART-Studie (Ipilimumab+Nivolumab),13 die DUNE-Studie (Tremelimumab+Durvalumab)14 und die NIPINEC-Studie (Nivolumab±Ipilimumab).15 Das mediane PFS lag bei diesen Studien wiederum bei enttäuschenden zwei Monaten. Immuntherapie sollte somit derzeit nur im Rahmen von klinischen Studien verabreicht werden.
Molekular-gematchte Therapien
Es gibt wenige Mutationen, die potenziell als therapeutisches Ziel bei epNEC genutzt werden könnten. Über 20% der kolorektalen NEC sind BRAFV600E-mutiert und anekdotische Evidenz aus Fallberichten hat einen Benefit für BRAF+/-MEK-Inhibitor-Kombinationstherapien gezeigt. Selten kommen Mutationen in KRASG12C und RET sowie NTRK-Fusionen vor.3 Rezente Real-World-Daten zum molekularen Profiling von neuroendokrinen Neoplasien (darunter 38 NEC) konnten zeigen, dass durchaus fast in jedem zweiten Fall „putative actionable alterations“ gefunden wurden, aber doch nur 10% der NEC-Patient:innen eine molekular-gematchte Therapie erhielten.16 Eingedenk der Medikamentenverfügbarkeit und Therapieverträglichkeit wird verdeutlicht, wie eingeschränkt praktikabel diese Form der personalisierten Medizin in der aktuellen klinischen Realität ist. Auch wenn Everolimus eine sinnvolle Therapieoption bei neuroendokrinen Tumoren sein kann (insbesondere bei Mutationen im mTOR-Signalweg), zeigte diese Substanz in der NECTOR-Studie bei NEC kaum eine Wirkung.17
Zusammenfassend kann man somit festhalten, dass die Therapieoptionen bei epNEC nach wie vor eingeschränkt sind und allesamt meist keinen durchschlagenden anhaltenden Erfolg erzielen können. Abseits vom Erstlinienstandard Platin/Etoposid ist die optimale Sequenztherapie aktuell unklar. Am meisten Evidenz gibt es für die Irinotecan-basierte Chemotherapie in der Zweitlinie, insbesondere bei GEP-NEC. Immuntherapie und zielgerichtete Therapien spielen aktuell nur eine untergeordnete Rolle. Zur weiteren Literatur empfehlen wir auch das aktuelle Konsensus-Statement der European Neuroendocrine Tumor Society (ENETS).3
Literatur:
1 Dasari A et al.: Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas: a SEER database analysis of 162,983 cases. Cancer 2018; 124(4): 807-15 2 Venizelos A et al.: The molecular characteristics of high-grade gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer 2021; 29(1): 1-14 3 Sorbye H et al.: European Neuroendocrine Tumor Society (ENETS) 2023 guidance paper for digestive neuroendocrine carcinoma. J Neuroendocrinol 2023; 35(3): e13249 4 Morizane C et al.: Effectiveness of etoposide and cisplatin vs irinotecan and cisplatin therapy for patients with advanced neuroendocrine carcinoma of the digestive system: the TOPIC-NEC phase 3 randomized clinical trial. JAMA Oncol 2022; 8(10): 1447-55 5 Zhang P et al.: Etoposide and cisplatin vs. irinotecan and cisplatin as the first-line therapy for patients with advanced, poorly differentiated gastroenteropancreatic neuroendocrine carcinoma: a randomized phase 2 study. Cancer 2020; 126(Suppl. 9): 2086-92 6 Riesco Martinez MC et al.: 496MO Final overall survival results from the NICE-NEC trial (GETNE-T1913): a phase II study of nivolumab and platinum-doublet chemotherapy (CT) in untreated advanced G3 neuroendocrine neoplasms (NENs) of gastroenteropancreatic (GEP) or unknown (UK) origin. Ann Oncol 2022; 33: S769 7 Eads JR et al.: Randomized phase II study of platinum and etoposide (EP) vs. temozolomide and capecitabine (CAPTEM) in patients (pts) with advanced G3 non-small cell gastroenteropancreatic neuroendocrine neoplasms (GEPNENs): ECOG-ACRIN EA2142. J Clin Oncol 2022; 40(Suppl. 16): 4020 8 McGarrah PW et al.: Efficacy of second-line chemotherapy in extrapulmonary neuroendocrine carcinoma. Pancreas 2020; 49(4): 529-33 9 Walter T et al.: Bevacizumab plus FOLFIRI after failure of platinum-etoposide first-line chemotherapy in patients with advanced neuroendocrine carcinoma (PRODIGE 41-BEVANEC): a randomised, multicentre, non-comparative, open-label, phase 2 trial. Lancet Oncol 2023; 24(3): 297-306 10 McNamara MG et al.: NET-02: a randomised, non-comparative, phase II trial of nal-IRI/5-FU or docetaxel as second-line therapy in patients with progressive poorly differentiated extra-pulmonary neuroendocrine carcinoma. eClinicalMedicine 2023; 60 11 Sorbye H et al.: Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study. Ann Oncol 2013; 24(1): 152-60 12 Sorbye H et al.: PRRT in high-grade gastroenteropancreatic neuroendocrine neoplasms (WHO G3). Endocr Relat Cancer 2020; 27(3): R67-r77 13 Patel SP et al.: A phase II basket trial of dual anti-CTLA-4 and anti-PD-1 blockade in rare tumors (DART) SWOG S1609: high-grade neuroendocrine neoplasm cohort. Cancer 2021; 127(17): 3194-201 14 Capdevila J et al.: Durvalumab plus tremelimumab for the treatment of advanced neuroendocrine neoplasms of gastroenteropancreatic and lung origin. Nat Commun 2023; 14(1): 2973 15 Girard N et al.: LBA41 Nivolumab (nivo) ± ipilimumab (ipi) in pre-treated patients with advanced, refractory pulmonary or gastroenteropancreatic poorly differentiated neuroendocrine tumors (NECs) (GCO-001 NIPINEC). Ann Oncol 2021; 32: S1318 16 Boilève A et al.: Molecular profiling and target actionability for precision medicine in neuroendocrine neoplasms: real-world data. Eur J Cancer 2023; 186: 122-32 17 Okuyama H et al.: A phase II trial of everolimus in patients with advanced pancreatic neuroendocrine carcinoma refractory or intolerant to platinum-containing chemotherapy (NECTOR Trial). Neuroendocrinology 2020; 110(11-12): 988-93
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...