Traitement de la diverticulite sigmoïdienne
Auteur·es:
Pr Dr méd. Robert Rosenberg, FACS, Executive MBA
Francesca Cordera
Klinik Chirurgie & Viszeralchirurgie
Kantonsspital Baselland
Liestal
E-mail: robert.rosenberg@ksbl.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La diverticulite est l’une des pathologies les plus fréquentes en cas de douleurs abdominales aiguës. L’incidence augmente fortement avec l’âge et un nombre croissant de patient·es jeunes sont atteint·es de diverticulite. L’évolution de la maladie varie considérablement en termes de symptômes en fonction du degré de sévérité. Pendant longtemps, la résection chirurgicale du foyer inflammatoire, même à un stade précoce, a été considérée comme le traitement de référence. Il existe aujourd’hui des directives claires et basées sur des preuves concernant le traitement et l’indication de l’opération. Le traitement de première intention est une thérapie conservatrice dans la forme non compliquée. L’indication de l’opération est posée avec de plus en plus de réticence. Un diagnostic et une classification par stade précis sont indispensables pour déterminer le traitement optimal.
Keypoints
-
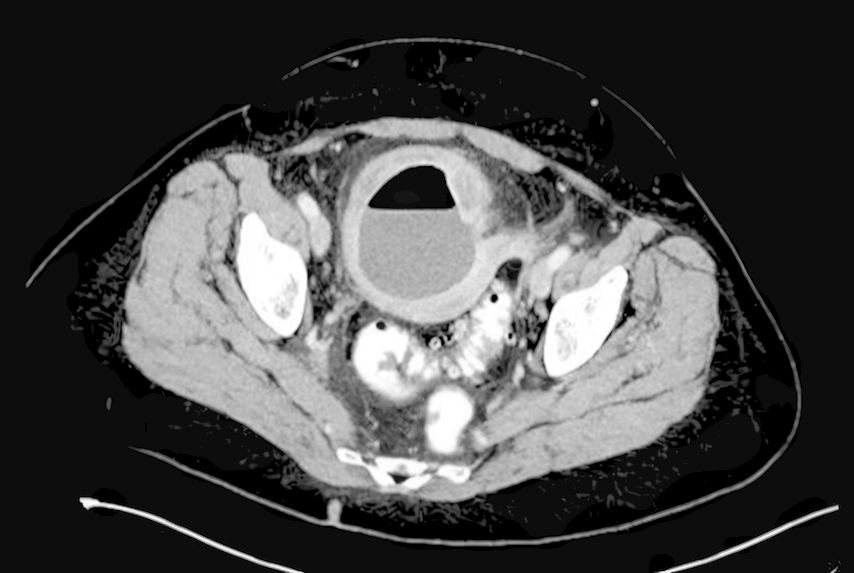
Le diagnostic de diverticulite doit être confirmé par échographie ou TDM et classé selon la CDD.
-
La diverticulite aiguë non compliquée (stade I) sans facteur de risque peut être traitée en ambulatoire et sans antibiothérapie. L’opération n’est pas indiquée en cas de résolution totale des symptômes.
-
Le traitement de la diverticulite aiguë compliquée (stade 2) se fait en milieu hospitalier par des antibiotiques. En cas de macro-abcès (>3cm), un drainage percutané est indiqué. Une résection sigmoïdienne peut être proposée dans l’intervalle sans poussée inflammatoire. En cas de perforation libre et de péritonite, il faut opérer en urgence, de préférence par laparoscopie avec anastomose primaire et iléostomie de protection, ou l’opération de Hartmann (résection avec discontinuité).
-
En cas de diverticulite chronique récidivante (stade 3), l’indication de l’opération doit être posée individuellement après avoir évalué le rapport bénéfice-risque et la diminution de la qualité de vie. Des études révèlent que les patient·es opéré·es ont une meilleure qualité de vie que ceux·elles qui ont suivi une thérapie conservatrice pendant de nombreuses années.
Avec une prévalence à vie de 50 à 60% et une nette augmentation dans la population âgée de plus de 70 ans, la diverticulose fait partie des maladies du côlon bénignes les plus fréquentes. Les données relatives à la répartition par sexe sont hétérogènes, mais il semble que les hommes jeunes, c’est-à-dire âgés jusqu’à 60 ans environ, soient plus souvent touchés que les femmes.1 Les patient·es jeunes sont de plus en plus souvent atteint·es. Bien que la diverticulose soit très répandue, seul·es 4,3% environ des patient·es développent une diverticulite au cours de leur vie, dont 15% une forme compliquée. Alors que le risque de récidive augmente à chaque nouvelle poussée inflammatoire, le risque de perforation libre est, contrairement à ce que l’on pensait auparavant, maximal lors de la première survenue et se manifeste par la suite indépendamment de la progression de la maladie.
L’obésité, une alimentation pauvre en fibres, la consommation d’alcool et le tabagisme comptent parmi les facteurs de risque de la diverticulite qu’il est possible d’influencer, tandis qu’une alimentation saine et l’activité physique ont un effet protecteur. Parmi les facteurs qu’il n’est pas possible d’influencer, on trouve les prédispositions génétiques telles que le syndrome de Marfan ou d’Ehlers-Danlos, les troubles du métabolisme de la matrice du tissu conjonctif, les neuropathies entériques, l’âge et d’autres comorbidités.
Classification par stade:diagnostic et traitement
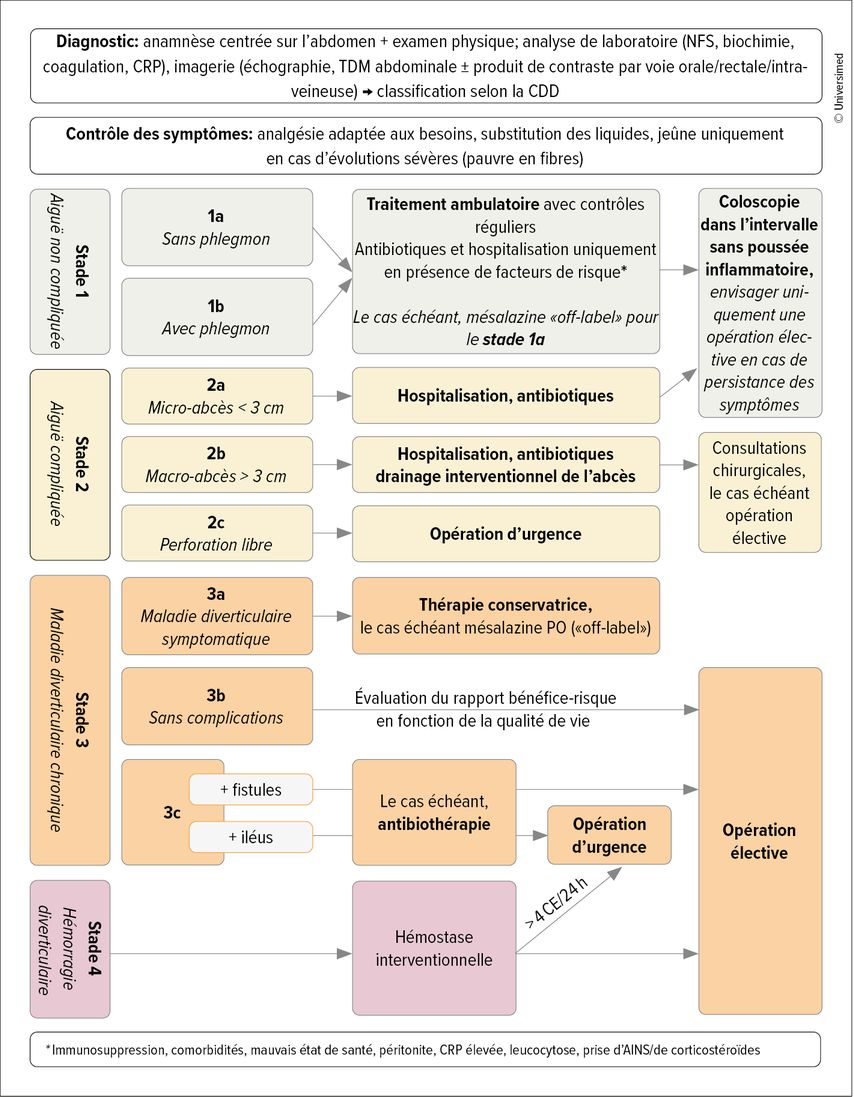
La Classification of Diverticular Disease (CDD) s’est établie comme référence pour la classification par stade de la maladie diverticulaire, surtout dans les pays germanophones (Tab.1). Basée sur la classification de Hinchey, elle découle de la classification de Hansen et Stock, et divise la maladie en cinq stades et sous-stades. Outre l’anamnèse et l’examen physique clinique centrés sur l’abdomen, une analyse de laboratoire des paramètres inflammatoires et, selon l’expérience de la personne chargée de l’examen, une échographie abdominale, la TDM abdominale étant la référence pour le diagnostic et la classification par stade.
Stade 1 – Diverticulite aiguë non compliquée
Sur le plan clinique, les symptômes sont généralement légers, avec des paramètres inflammatoires peu élevés, sans fièvre, ni signe de sepsis ou de péritonite. L’imagerie révèle une inflammation des diverticules, éventuellement accompagnée d’un phlegmon (Fig.1).
Fig.1: TDM d’une diverticulite de stade 1b avec phlegmon selon la CDD
Traitement: En principe, les directives recommandent un traitement symptomatique ambulatoire pour la diverticulite non compliquée ainsi qu’une coloscopie après la résolution de la poussée inflammatoire pour exclure un résultat malin. L’antibiothérapie n’a montré aucun bénéfice significatif à ce stade et ne doit plus être administrée de manière standard.2 Les conditions préalables à l’abandon des antibiotiques et à un traitement ambulatoire sont l’accès à un suivi ambulatoire étroit de l’évolution ainsi qu’un état de santé permettant l’absorption orale de nourriture et de liquide. En outre, la présence de comorbidités telles qu’une hypertension artérielle, une maladie coronarienne, une maladie rénale chronique, une cirrhose du foie, une immunosuppression ou un mauvais état de santé détermine également la constellation de risques individuelle et la nécessité d’un traitement en milieu hospitalier ou de l’administration d’antibiotiques. En présence des facteurs de risque mentionnés, un traitement en milieu hospitalier avec administration d’antibiotiques est recommandé. La résection chirurgicale n’est pas indiquée.
Stade 2 a/b – Diverticulite aiguë compliquée avec perforation couverte
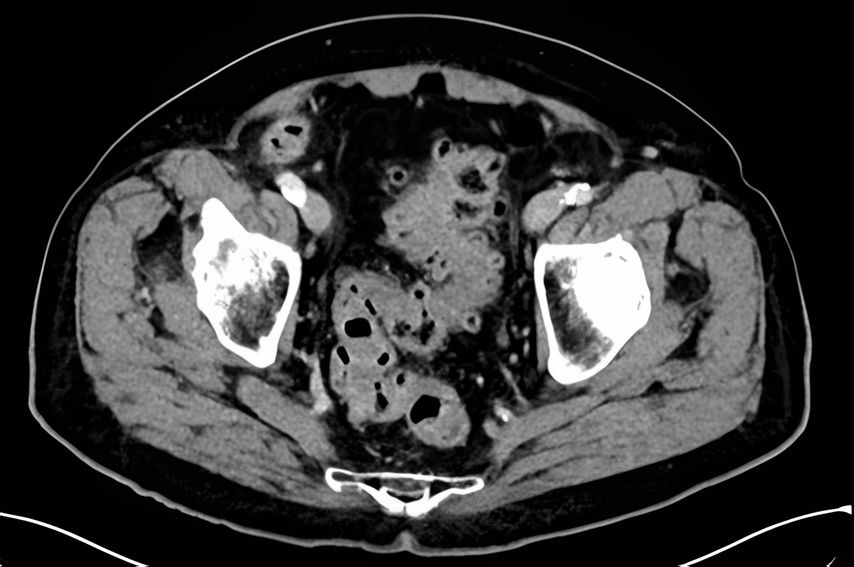
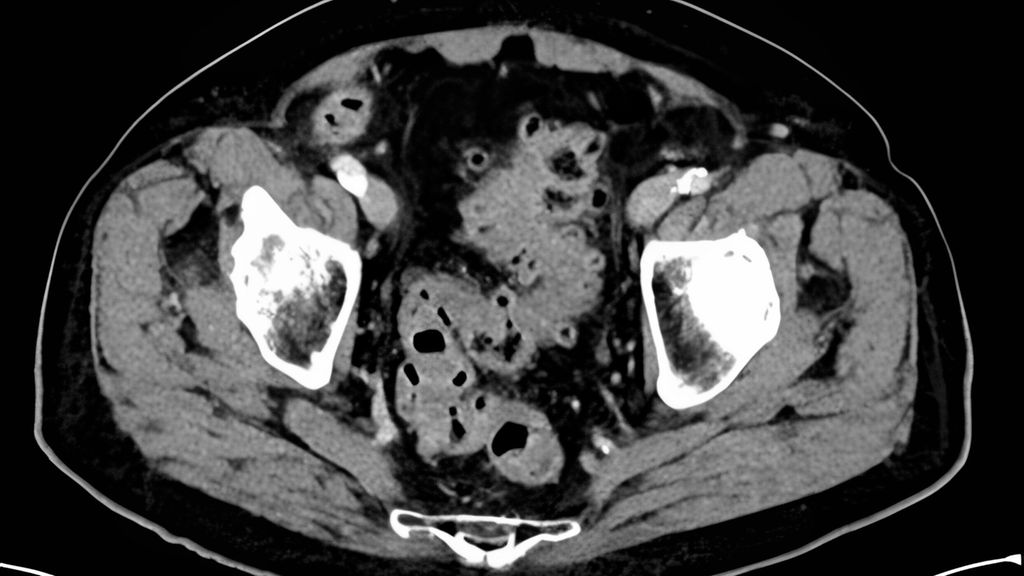
Alors que la présentation clinique chez les patient·es atteint·es de diverticulite avec perforation couverte peut être similaire à celle chez les patient·es atteint·es de diverticulite de stade 1 (au sens d’une péridiverticulite), les paramètres inflammatoires sont généralement plus élevés dans ce cas. La TDM met en évidence un abcès qui, selon sa taille, est classé comme micro-abcès (<3cm) (stade 2a) ou macro-abcès (>3cm) (stade 2b) et qui est déterminant pour la suite du traitement (Fig.2). Le risque de récidive d’autres poussées inflammatoires est en outre corrélé à la taille de l’abcès.
Fig.2: TDM d’une diverticulite de stade 2b avec macro-abcès interentérique selon la CDD
Traitement: Pour les patient·es atteint·es de diverticulite de stade 2a/b, le consensus est une hospitalisation avec initiation d’une antibiothérapie par voie intraveineuse et, le cas échéant, un apport en liquide par voie parentérale. Ici aussi, une coloscopie est recommandée dans l’intervalle sans poussée inflammatoire. En présence d’un micro-abcès, les directives actuelles indiquent uniquement l’opération en cas de persistance des symptômes sous traitement symptomatique et antibiothérapie. En cas de macro-abcès, le drainage de l’abcès sous contrôle radiologique est en revanche recommandé, suivi de l’évaluation possible d’une résection élective après la résolution de la poussée inflammatoire aiguë. Les antibiotiques habituellement utilisés sont, selon le degré de sévérité, l’amoxicilline/acide clavulanique (PO/IV) ou la pipéracilline/tazobactam (IV). Les alternatives comme la ciprofloxacine plus métronidazole doivent uniquement être utilisées en deuxième intention en cas d’allergie, en raison d’un risque accru d’infection à Clostridium difficile.3
Stade 2c – Diverticulite aiguë compliquée avec perforation libre
Les patient·es souffrant d’une diverticulite avec perforation libre présentent généralement un état de santé nettement diminué, des sueurs froides ainsi que des signes de sepsis. Souvent, l’anamnèse permet d’identifier d’abord une phase de douleurs subaiguës diffuses dans le bas-ventre, qui précède un événement douloureux soudain et intense. L’examen physique révèle généralement un abdomen aigu avec une péritonite diffuse. Les paramètres inflammatoires sont nettement plus élevés et de l’air libre et/ou du liquide sont visibles à la TDM abdominale. Le tableau clinique est caractérisé par une péritonite purulente (stade 2c1) ou fécale (stade 2c2) avec migration et sepsis, et constitue une situation d’urgence absolue. Une antibiothérapie doit être initiée le plus rapidement possible. Chaque heure qui s’écoule avant l’initiation du traitement augmente significativement la létalité.
Traitement: La présence d’une perforation intestinale libre constitue une indication d’opération d’urgence immédiate. Selon la directive, il existe un consensus pour la résection de la partie du côlon concernée avec – si possible – une anastomose primaire standard et une iléostomie de protection. Toutefois, chez les patient·es instables souffrant de sepsis, il convient, en fonction des résultats peropératoires et de l’appréciation du·e la chirurgien·ne, de procéder à une opération de Hartmann avec colostomie provisoire et fermeture du moignon (rectal). Une vaste étude multicentrique a cependant montré que, en réalité, l’opération de Hartmann est toujours réalisée plus fréquemment.4 Dans les deux cas, aucune différence significative n’a été observée dans le taux de récidive de la stomie. Une autre option thérapeutique discutée dans les premières études est le lavage péritonéal laparoscopique seul, qui n’a mis en évidence aucune différence significative dans la survenue de complications graves pendant la période de suivi de 5 ans, mais une probabilité nettement plus élevée de récidive de la diverticulite, avec une probabilité significativement faible de stomie.5,6 Compte tenu de la mortalité à 28 jours du sepsis abdominal, qui peut atteindre 42,9% en l’absence d’assainissement chirurgical du foyer, le lavage seul en cas de diverticulite avec perforation libre ne peut pas être recommandé à l’heure actuelle comme alternative à la résection.7
Stade 3 – Maladie diverticulaire chronique
La maladie diverticulaire chronique peut encore être subdivisée: le stade 3a décrit la survenue de troubles persistants ou récurrents, dus à une diverticulose et généralement après des épisodes initiaux de diverticulite aiguë, sans modifications inflammatoires clairement détectables dans les analyses de laboratoire et à la TDM. Il s’agit en fin de compte d’un diagnostic d’exclusion et il est souvent difficile de le distinguer du syndrome du côlon irritable. À l’hôpital, de tels cas nous sont rarement présentés. Les stades 3b et 3c, en revanche, comprennent les diverticulites récidivantes «typiques», sans (stade 3b) ou avec complications (stade 3c), telles que des fistules (généralement vers la vessie), des sténoses ou des adhérences.
Traitement:L’opération n’est pas indiquée pour les personnes atteintes d’une maladie diverticulaire de stade 3a. Selon les directives, un traitement par la mésalazine peut avoir une influence positive sur la fréquence des épisodes symptomatiques ainsi que sur la qualité de vie dans ces cas.
Longtemps en vigueur pour le stade 3b, la recommandation d’une résection chirurgicale après la deuxième poussée inflammatoire n’est plus d’actualité. Contrairement à ce que l’on pensait auparavant, les diverticulites aiguës récidivantes ne sont pas associées à un taux plus élevé de complications ou d’échec de la thérapie conservatrice. L’évolution ultérieure est toutefois marquée par une diminution de la qualité de vie due à la survenue de nouvelles poussées inflammatoires. L’indication de l’opération est déterminée après l’évaluation individuelle du risque opératoire par rapport à la diminution subjective de la qualité de vie. Dans l’essai DIRECT et, entre-temps, dans d’autres études, la qualité de vie s’est avérée significativement plus élevée après une résection recto-sigmoïdienne élective par rapport à la thérapie conservatrice.8 En résumé, la résection chirurgicale du sigmoïde en tant que foyer inflammatoire est associée à une amélioration de la qualité de vie.
En présence de fistules, de sténoses symptomatiques ou d’adhérences dans le cadre d’une maladie diverticulaire de stade 3c, seul une opération permet en principe d’améliorer les symptômes. Il existe toutefois également des rapports de cas qui soutiennent la possibilité d’une thérapie conservatrice chez les patient·es présentant des fistules colovésicales, mais il est indispensable d’exclure une maladie sous-jacente maligne.9,10 En cas de suspicion de fistule, nous recommandons le test des graines de pavot suivi d’un assainissement chirurgical.
«Smoldering diverticulitis»
Une forme particulière de diverticulite chronique est la «smoldering diverticulitis» (diverticulite subintrante), qui se développe chez environ 5% des patient·es et qui, après une poussée inflammatoire aiguë, ne permet jamais d’obtenir une résolution totale des symptômes. L’inflammation est certes régressive, mais ne guérit jamais complètement, comparable à un «feu couvant». Il en résulte un taux de récidive nettement plus élevé avec des intervalles plus courts entre les poussées inflammatoires aiguës.11 Jusqu’à présent, il n’existe guère de données d’études distinctes sur cette sous-forme, mais une intervention chirurgicale rapide semble être l’option la plus prometteuse.12 En cas de survenue d’une «smoldering diverticulitis», nous recommandons la résection chirurgicale de la partie de l’intestin avec des diverticules enflammés.
Opération
Dans les hôpitaux expérimentés, l’opération élective est aujourd’hui mini-invasive grâce à la technique laparoscopique ou robotique. La diverticulite sigmoïdienne nécessite la résection du segment avec des diverticules enflammés sur une longueur d’environ 20cm. La question toujours posée par les patient·es concernant la longueur du segment intestinal à réséquer est surtout déterminée par la présence fréquente d’un allongement du côlon avec un net allongement de l’anse sigmoïde. On peut rassurer les patient·es en leur disant que le segment à réséquer n’est pas long et que cela devrait peu impacter la qualité des selles. La résection du segment intestinal doit se faire dans le rectum proximal afin de maintenir le risque de récidive à un niveau faible. Elle est effectuée dans une partie de l’intestin non enflammée, à peu près à la jonction entre le côlon descendant et le sigmoïde. Avec les traitements «fast track» actuels, la durée d’hospitalisation est de 3 à 5 jours en cas de forme non compliquée. Dans les bons hôpitaux, le taux d’échec de l’anastomose dans le cadre d’une opération élective s’élève de 3 à 5% (données propres). L’opération peut donc être considérée comme sûre.
Suivi
Recommandations nutritionnelles
Selon les directives actuelles, il n’existe aucune preuve en faveur d’une prophylaxie secondaire spécifique basée sur l’alimentation, au-delà des recommandations générales d’une alimentation saine et équilibrée.
Pertinence d’une endoscopie après une poussée inflammatoire
Bien que l’utilisation accrue de la TDM à haute résolution remette de plus en plus en question la recommandation traditionnelle de la coloscopie dans l’intervalle sans poussée inflammatoire, une méta-étude a révélé une incidence significativement plus élevée d’adénomes et de carcinomes colorectaux après une diverticulite, mais pas une diverticulose.13 Alors qu’un carcinome colorectal était détecté par coloscopie chez 0,3 à 0,4% de la population générale, il l’était chez 2,0% après une diverticulite, indépendamment de la sévérité de la maladie, et même chez 6,1% après une diverticulite compliquée. Les auteur·es ne supposent pas de lien de cause à effet, mais recommandent toujours une coloscopie 6 à 8 semaines après une poussée inflammatoire chez les patient·es en bonne forme chez lesquels le bénéfice l’emporte sur le risque.
Cas particuliers et diagnostics différentiels
Patient·es immunodéprimé·es
Les patient·es immunodéprimé·es présentent une incidence, un taux de complications et un taux de mortalité plus élevés en cas de diverticulite, le traitement non chirurgical s’est notamment avéré moins prometteur dans ce groupe.14 D’autres études ont révélé, d’une part, un risque accru d’opération d’urgence et, d’autre part, une morbidité accrue des patient·es immunodéprimé·es en cas d’opérations électives ainsi qu’une mortalité accrue en cas d’opérations d’urgence.15,16 Une différence importante dans le diagnostic de la diverticulite chez les patient·es immunodéprimé·es réside en outre dans le fait que les symptômes typiques ainsi que les signes d’inflammation cliniques et biologiques peuvent être atténués ou absents, ce qui réduit la sensibilité et la spécificité de la TDM.17 Malgré des études peu concluantes concernant l’indication de l’opération, la directive S3 actuelle ne fait pas de distinction entre les diverticulites non compliquées et les patient·es asymptomatiques en fonction des maladies antérieures et du statut immunitaire, mais ne recommande pas systématiquement de résection sigmoïdienne élective. Il convient toutefois de poser rapidement le diagnostic par TDM et d’initier obligatoirement un traitement antibiotique.11 L’indication de l’opération doit être posée après évaluation des facteurs de risque individuels et du risque de récidive. Par exemple, les patient·es séropositif·ves sous traitement adapté ne présentaient guère de complications accrues, alors que les patient·es sous corticothérapie obtenaient les résultats les plus défavorables.18,19 Les patient·es ayant subi une transplantation et sous traitement immunosuppresseur ont obtenu de meilleurs résultats qu’avant la transplantation.
Patient·es jeunes
Parmi les patient·es jeunes, en particulier dans le groupe âgé de 40 à 49 ans, on observe une nette tendance à l’augmentation de l’incidence.20 On a initialement supposé que les patient·es jeunes présentaient davantage de récidives et de complications, mais les études qui ont inclus les analyses de survie en tenant compte de la durée de suivi pour le taux de récidive ne confirment pas ce résultat. Aucune différence significative dans la proportion d’évolutions compliquées n’a été observée.21 Par conséquent, les directives ne recommandent pas d’adapter le traitement de la diverticulite en fonction de l’âge. Cependant, il faut informer clairement les patient·es jeunes que d’autres poussées inflammatoires peuvent survenir et avoir un impact sur leur vie.
Colite segmentaire associée à une diverticulose (SCAD)
La colite segmentaire associée à une diverticulose constitue un diagnostic différentiel rare, mais de plus en plus pertinent, de la diverticulite, en particulier de la «smoldering diverticulitis». Parmi les patient·es atteint·es de diverticulose, environ 1% sont concerné·es. L’évolution peut être souvent asymptomatique ou se caractériser par une hématochézie, une diarrhée ou des douleurs abdominales. Sur le plan endoscopique, les lésions inflammatoires visibles de la muqueuse sont interdiverticulaires plutôt que péridiverticulaires, c’est-à-dire situées dans les zones intermédiaires sans diverticule. Sur le plan histologique, la colite segmentaire associée à une diverticulose se présente comme une maladie inflammatoires chroniques de l’intestin, tandis que l’analyse de laboratoire révèle un taux élevé de TNF-α. Sur le plan thérapeutique, seule la mésalazine est utilisée à ce jour.22,23
Conclusion
En résumé, nous avons présenté dans ce travail le large spectre de la diverticulite en tant que maladie, des évolutions non compliquées légères jusqu’aux complications engageant le pronostic vital (Fig.3). Le traitement dépend du stade et va du traitement symptomatique jusqu’à l’opération d’urgence. Un diagnostic et une classification par stade précis ainsi que le choix d’un traitement adapté sont les conditions préalables pour garantir un traitement optimal et le bien-être des patient·es. L’opération est choisie avec de plus en plus de réticence, mais les données sont suffisantes pour la recommander aux patient·es dont la qualité de vie a diminué après plusieurs poussées inflammatoires.
Littérature:
1 Leifeld L et al.: S3-Leitlinie Divertikelkrankheit/Divertikulitis. Gemeinsame Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Allgemein- und Viszeralchirurgie (DGAV). Z Gastroenterol 2022; 60: 613-88 2 Poh CW et al.: Antibiotics vs observational therapy in acute uncomplicated diverticulitis, a systemic review and meta-analysis. Int J Colorectal Dis 2023; 38: 97 3 Gaber CE et al.: Comparative effectiveness and harms of antibiotics for outpatient diverticulitis: two nationwide cohort studies. Ann Intern Med 2021; 174: 737-46 4 Perrone G et al.: Goodbye Hartmann trial: a prospective, international, multicenter, observational study on the current use of a surgical procedure developed a century ago. World J Emerg Surg 2024; 19: 14 5 Azhar N et al.: Laparoscopic lavage vs primary resection for acute perforated diverticulitis: long-term outcomes from the Scandinavian diverticulitis (SCANDIV) randomized clinical trial. JAMA Surg 2021; 156: 121-7 6 Sciascia D et al.: Longer term outcomes of laparoscopic peritoneal lavage in the management of acute Hinchey III perforated diverticulitis: a systematic review and meta-analysis. Dig Surg 2025; 42: 36-47 7 Hecker A et al.: Intra-abdominal sepsis: new definitions and current clinical standards. Langenbecks Arch Surg 2019; 404: 257-71 8 van de Wall BJM et al.: Surgery versus conservative management for recurrent and ongoing left-sided diverticulitis (DIRECT trial): an open-label, multicentre, randomised controlled trial. Lancet Gastroenterol Hepatol 2017; 2: 13-22 9 Zizzo M et al.: Management of colovesical fistula: a systematic review. Minerva Urol Nephrol 2022; 74: 400-8 10 Radwan R et al.: How safe is it to manage diverticular colovesical fistulation non-operatively? Colorectal Dis 2013; 15: 448-50 11 Peery AF et al.: AGA clinical practice update on medical management of colonic diverticulitis: expert review. Gastroenterol 2021; 160: 906-11.e1 12 Rink AD et al.: [Smoldering diverticultis - still a type of chronic recurrent diverticulitis with good indication for surgery? - Surgery for smoldering diverticulitis]. Z Gastroenterol 2019; 57: 1200-8 13 Cao AMY et al.: Endoscopic findings after CT proven acute diverticulitis: a systematic review and meta-analysis. ANZ J Surg 2023; 93: 1150-8 14 Hwang SS et al.: Diverticulitis in transplant patients and patients on chronic corticosteroid therapy: a systematic review. Dis Colon Rectum 2010; 53: 1699-1707 15 Lee JG et al.: Comparative outcomes of acute colonic diverticulitis in immunocompromised versus immunocompetent patients: a systematic review and meta-analysis. Intest Res 2023; 21: 481-92 16 McKechnie T et al.: Operative management of colonic diverticular disease in the setting of immunosuppression: A systematic review and meta-analysis. Am J Surg 2021; 221: 72-85 17 de’Angelis N et al.: Emergency abdominal surgery after solid organ transplantation: a systematic review. World J Emerg Surg 2016; 11: 43 18 Cronley K et al.: Diverticulitis in HIV-infected patients within the United States. HIV Med 2016; 17: 216-21 19 Brandl A et al.: Diverticulitis in immunosuppressed patients: A fatal outcome requiring a new approach? Can J Surg 2016; 59: 254-61 20 Bharucha AE et al.: Temporal trends in the incidence and natural history of diverticulitis: a population-based study. Am J Gastroenterol 2015; 110: 1589 21 van Dijk ST et al.: A systematic review and meta-analysis of disease severity and risk of recurrence in young versus elderly patients with left-sided acute diverticulitis. Eur J Gastroenterol Hepatol 2020; 32: 547-54 22 Cassieri C et al.: How to differentiate segmental colitis associated with diverticulosis and inflammatory bowel diseases. J Clin Gastroenterol 2016; 50: 36 23 Sbarigia C et al.: Common diagnostic challenges and pitfalls in segmental colitis associated with diverticulosis (SCAD). J Clin Med 2023; 12: 6084
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
La nature hétérogène de l’HFpEF
L’HFpEF («heart failure with preserved ejection fraction») est une pathologie complexe. On pense typiquement à un·e patient·e âgé·e, en surpoids et souffrant d’hypertension. L’obésité ...
Comment évaluer la réponse au traitement?
Comment les symptômes de l’asthme sont-ils évalués? Quel questionnaire convient à cet effet et le fait qu’il soit rempli par le personnel soignant ou les personnes concernées joue-t-il ...