Nouvelles approches thérapeutiques et données modifiant les directives
Compte-rendu:
Dr Torsten U. Banisch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données précliniques et cliniques ainsi que les nouvelles technologies, mais aussi de nombreuses mises à jour de directives.
Purpura thrombotique thrombocytopénique
Caplacizumab plus immunosuppresseurs sans plasmaphérèse en cas d’ITP
«Le nanobody caplacizumab se lie au facteur von Willebrand (VWF), bloque son interaction avec les plaquettes et inhibe ainsi la formation de microthrombi», a expliqué le Dr méd. Paul Coppo de la Sorbonne Université en France.1 L’étude de phaseIII MAYARI a évalué les avantages de la combinaison caplacizumab plus immunosuppresseurs sans recourir à une plasmaphérèse (TPE). Les patient·es atteint·es de purpura thrombopénique immunologique (ITP; ≥18 ans; n=46) ont ainsi été traité·es jusqu’à douze semaines et suivi·es pendant douze semaines supplémentaires. Les patient·es présentant des symptômes graves n’ont pas été inclus·es dans l’étude.
93,5% ont obtenu une rémission sous caplacizumab plus immunosuppresseurs. Le délai médian de réponse de la numération plaquettaire était de quatre jours, et plus de 75% ont vu leur taux de plaquettes se rétablir dans les cinq jours. Aucune nouvelle exacerbation ou rechute clinique n’est survenue après la période de traitement et le profil de sécurité était acceptable.
En résumé, l’étude MAYARI a montré que la combinaison caplacizumab plus immunosuppresseurs avec un fardeau thérapeutique réduit sans TPE est sûre et efficace en première ligne chez >93% des patient·es atteint·es d’ITP aiguë sans symptômes graves, ce qui pourrait en faire le nouveau traitement de référence à l’avenir.
Mise à jour de la directive surle TTP
«Sur la base de nouvelles données d’études et du monde réel, le caplacizumab doit être utilisé précocement dans le traitement de l’ITP et non comme traitement de rattrapage», a rapporté P. Coppo.2,3 Sous la combinaison actuelle TPE plus immunosuppresseurs plus caplacizumab, le taux de survie est supérieur à 98%. Le facteur limitant est un pronostic tardif. Dans ce cas, les scores French et PLASMIC doivent être utilisés pour un diagnostic de présomption immédiat, en attendant les résultats du test de l’ADAMTS13.
Dans le cas du purpura thrombotique thrombocytopénique congénital (cTTP), il a été démontré que l’apport d’ADAMTS13 par le plasma était insuffisant et que les thrombocytopénies étaient réduites de 60% sous la protéine ADAMTS13 recombinante (rADAMTS13) en comparaison directe.4 Il est donc recommandé de traiter les patient·es en rémission par rADAMTS13 afin de prévenir les épisodes aigus. Une stratégie thérapeutique attentiste n’est généralement pas recommandée.
Maladie thrombo-embolique veineuse
Étude comparative directe FIRST: rivaroxaban par rapport à apixaban
«Les anticoagulants oraux directs sont le traitement de première ligne de la maladie thrombo-embolique veineuse (MTEV), mais on ignore si leur efficacité diffère», a déclaré la Dre méd. Lana A. Castellucci de l’Institut de recherche de l’Hôpital d’Ottawa, au Canada, en introduction de sa présentation.5
L’étude COBRRA est la première étude comparative directe entre l’apixaban et le rivaroxaban sur la réduction des événements hémorragiques significatifs chez les patient·es atteint·es d’une MTEV aiguë sur une période de traitement de trois mois.
Ont été inclus·es des patient·es âgé·es de ≥18 ans (n=2760) atteint·es d’une MTEV profonde des membres inférieurs proximale aiguë symptomatique ou d’une embolie pulmonaire segmentaire ou sévère.
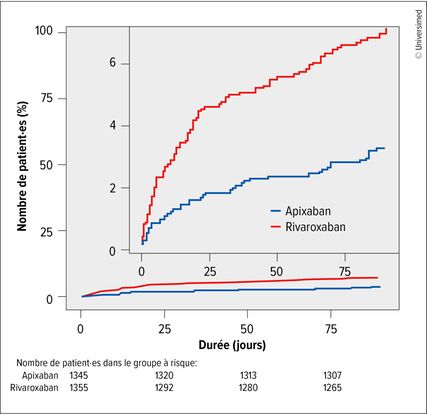
Fig.1: Hémorragies cliniquement significatives sous rivaroxaban par rapport à sous apixaban (modifiée selon Castellucci LA et al.)13
Des hémorragies cliniquement significatives (hémorragies sévères et hémorragies non sévères cliniquement significatives) ont été observées chez 3,3% des patient·es sous apixaban par rapport à 7,2% sous rivaroxaban (OR: 0,44; IC à 95%: 0,31–0,63; p=0,00001; Fig.1). Des hémorragies sévères sont survenues chez 0,4% des patient·es sous apixaban et 2,3% sous rivaroxaban.
En résumé, l’apixaban était supérieur au rivaroxaban en termes d’événements hémorragiques cliniquement significatifs. Les taux de récidive de MTEV et les taux de mortalité étaient comparables. Les résultats de l’étude COBRRA seront donc intégrés dans les futures directives pour la pratique clinique et la modifieront durablement.
Maladie de von Willebrand
Anticorps anti-VWF pour augmenter le taux de VWF
Dans le domaine du traitement de la maladie de von Willebrand (VWD), la Dre méd. Priyanka Rahejal du Royal London Hospital, en Angleterre, a présenté les premières données de l’étude de phaseI/II VELORA Pioneer sur la sécurité de l’anticorps anti-VWF monovalent HMB-002 administré par voie sous-cutanée. Il se lie spécifiquement au domaine CK du VWF et retarde sa clairance, augmentant ainsi les taux de VWF et de FVIII.6,7
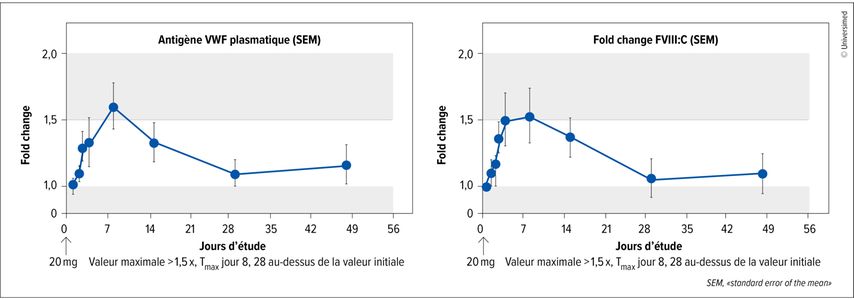
La pharmacocinétique (PK), la pharmacodynamique (PD) et la sécurité du HMB-002 ont été analysées chez des patient·es atteint·es d’une VWD de type 1 (18–65 ans). Dans la cohorte de sécurité (n=3), une dose unique de 20mg a été administrée. Après une période d’observation de 56 jours, aucun effet secondaire n’a été documenté, y compris des événements thrombotiques, des thrombocytopénies ou des modifications des taux de D-dimères. Les tests des ADA («anti-drug antibodies) étaient négatifs à toutes les mesures.
Sous la plus faible dose de HMB-002, à savoir 20mg, le VWF et le FVIII ont été multipliés par 1,5. Les concentrations maximales dans le plasma ont été mesurées à chaque fois au jour 8 et les valeurs sont restées supérieures aux valeurs initiales pendant 28 jours après l’administration (Fig.2). La génération de thrombine a atteint une valeur maximale correspondant à 65% du FVIII. Sur la base des données prometteuses, l’étude VELORA Pioneer poursuit le recrutement ainsi que l’escalade de dose et soutient la poursuite du développement de HMB-002 en tant que traitement prophylactique dans la VWD.
Hémophilie A:
mimétiques du facteur VIIIa
Dans le cas des traitements de l’hémophilie A, l’accent a été mis sur les mimétiques du FVIIIa à administrer par voie sous-cutanée, des anticorps bispécifiques (bsAB) qui se lient au FIXa et au FX sur la membrane plaquettaire activée, imitant ainsi une fonction importante du facteur VIII et rétablissant l’homéostasie.8,9
NXT007: prophylaxie chez les patient·es naïf·ves d’emicizumab et atteint·es d’hémophilie A sans inhibiteurs
«L’emicizumab a été le premier bsAB injectable par voie sous-cutanée à entraîner une réduction des hémorragies traitées», a déclaré Midori Shima de l’Université de médecine de Nara, au Japon.10 NXT007 est un nouveau bsAB développé sur la base de l’emicizumab afin d’obtenir des demi-vies plus longues et de minimiser les variations du taux de principe actif.11
Afin d’évaluer la sécurité, la tolérance, la PK, la PD et l’efficacité, des patient·es (≥12 à <65 ans; n=30) atteint·es d’hémophilie A sévère sans inhibiteurs du FVIII ont été inclus·es dans la partie B de l’étude NXTAGE. Une augmentation dose-dépendante de la concentration plasmatique de NXT007 a été démontrée avec une activité équivalente à celle du FVIII au-dessus du niveau non hémophile. En outre, le taux de saignement annualisé (ABR) a diminué par rapport à la valeur initiale.
NXT007 a été bien toléré et il n’y a pas eu d’augmentation dose-dépendante des effets secondaires. En outre, aucun événement thrombo-embolique n’a été observé. Cependant, des ADA ont été détectés chez 22 des 30 patient·es, avec des effets sur la concentration plasmatique chez deux d’entre eux·elles. Les taux de fragments 1 et 2 de la prothrombine ont montré une augmentation au-delà de la plage de référence, ce qui indique un potentiel de coagulation accru.
En résumé, NXT007 a le potentiel d’atteindre une normalisation de l’hémostase dans l’hémophilie A avec un profil de sécurité acceptable.
FRONTIER5:
initiation de la prophylaxie par Mim8 sans phase de lavage de l’emicizumab
«Le mimétique du FVIIIa Mim8 est un bsAB dont l’efficacité et la bioéquivalence du FVIII sont 15 fois supérieures à celles de l’emicizumab, comme l’ont montré les données sur la génération de thrombine», a expliqué le Prof Dr méd. Johannes Oldenburg de l’Université de Bonn, en Allemagne.8,9,12 L’étude à un seul bras FRONTIER5 porte sur des patient·es atteint·es d’hémophilie A (≥12 ans; n=91) avec ou sans inhibiteurs, qui avaient auparavant reçu l’emicizumab et qui sont passé·es directement au Mim8 sans phase de lavage.
L’emicizumab était éliminé à la semaine 26 et une concentration plasmatique à l’état d’équilibre de Mim8 a été atteinte à la semaine 16. Le passage au Mim8 a entraîné une augmentation durable de la concentration maximale de thrombine dans la plage de référence normale, sans réaction excessive.
Le passage direct d’emicizumab au Mim8 sans phase de lavage a été bien toléré et aucun problème de sécurité n’a été observé. La plupart des effets secondaires étaient légers et n’étaient probablement pas liés au Mim8. Le taux de réactions au site d’injection (ISR) était faible; la plupart étaient légères et toutes étaient transitoires.
Source:
ISTH Congress: Thrombosis and Hemostasis Conference, 21–25 juin 2025, Washington D. C., États-Unis
Littérature:
1 Coppo P et al.: Thrombotic thrombocytopenic purpura: Toward targeted therapy and precision medicine. Res Pract Thromb Haemost 2018; 3(1): 26-37 2 Coppo P et al.: Caplacizumab use in immune-mediated thrombotic thrombocytopenic purpura: an international multicentre retrospective Cohort study (The Capla 1000+ project). EClinicalMedicine 2025; 82: 103168 3 Völker LA et al.: Impact of first-line use of caplacizumab on treatment outcomes in immune thrombotic thrombocytopenic purpura. JThromb Haemost 2023; 21(3): 559-72 4 Scully M et al.: Recombinant ADAMTS13 in congenital thrombotic thrombocytopenic purpura. N Engl J Med 2024; 390(17): 1584-96 5 Ortel TL et al.: American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Adv 2020; 4(19): 4693-738 6 Häger M et al.: HMB-002: elevating von Willebrand Factor for prophylactic treatment of Von Willebrand disease. ISTH 2025; Abstr. #OC08.4 7 Rasmussen C et al.: Favorable nonclinical safety profile of HMB-002 for prophylactic treatment of Von Willebrand disease. ISTH 2025; Abstr. #OC59.5 8 Ostergaard H et al.: A factor VIIIa-mimetic bispecific antibody, Mim8, ameliorates bleeding upon severe vascular challenge in hemophilia A mice. Blood 2021; 138(14): 1258-68 9 Lenting PJ et al.: Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood 2017; 130(23): 2463-8 10 Callaghan MU et al.: Long-term outcomes with emicizumab prophylaxis for hemophilia A with or without FVIII inhibitors from the HAVEN 1-4 studies. Blood 2021; 137(16): 2231-42 11 Teranishi-Ikawa Y et al.: A bispecific antibody NXT007 exerts a hemostatic activity in hemophilia A monkeys enough to keep a nonhemophilic state. JThromb Haemost 2024; 22(2): 430-40 12 Persson P et al.: Mim8, a novel factor VIIIa mimetic bispecific antibody, shows favorable safety and pharmacokinetics in healthy adults. Res Pract Thromb Haemost 2023; 7(6): 102181 13 Castellucci LA et al.: Comparison of bleeding risk between rivaroxaban and apixaban in acute venous thromboembolism. ISTH 2025; Abstr. #LB01.1 14 Raheja P et al.: VELORA Pioneer: first-in-human safety and PK/PD study of HMB-002 in Type 1 Von Willebrand disease. ISTH 2025; Abstr. #LB01.4
Das könnte Sie auch interessieren:
Traitements efficaces pour l’adénocarcinome de l’estomac et de la jonction œsogastrique
Dans le domaine des tumeurs gastro-intestinales, des progrès ont été réalisés, en particulier dans le traitement des patient·es atteint·es d’adénocarcinome de l’estomac et de la jonction ...
Intégration: précoce, progressive, conjointe ou (trop) tardive?
Les nouveaux traitements anticancéreux modifient également l’approche des soins palliatifs. Plus la durée de survie augmente, plus l’accent est mis sur la qualité de vie. Le moment de l’ ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...