Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Compte-rendu:
Dre Ine Schmale
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ont modifié la pratique clinique, présentées lors de la réunion annuelle de l’ESMO 2025.
Carcinome de la vessie
Combinaison périopératoire d’enfortumab vedotin et de pembrolizumab
L’immunochimiothérapie néoadjuvante à base de cisplatine suivie d’une cystectomie radicale et d’un curage ganglionnaire (RC+PLND) demeure le traitement standard du carcinome de la vessie invasif du muscle (MIBC). Environ la moitié des personnes concernées, souvent âgées et présentant des comorbidités, ne sont pas éligibles au cisplatine et restent sans option néoadjuvante validée. L’étude de phaseIII, randomisée et ouverte, KEYNOTE-905 a évalué l’administration périopératoire d’enfortumab vedotin plus pembrolizumab (EV+pembro) versus RC+PLND seule.1 Le critère d’évaluation primaire de l’étude était la survie sans événement (EFS).
L’étude, initiée en 2019, prévoyait le pembrolizumab périopératoire comme thérapie expérimentale. En 2020, le bras EV+Pembro et RC+PLND a été ajouté, puis en 2022, le bras pembrolizumab a été fermé. Au total, 344 patient·es inéligibles au cisplatine ou refusant une chimiothérapie à base de cisplatine ont été inclus·es et traité·es par EV+Pembro + RC+PLND ou par RC+PLND seule.
L’étude a atteint son critère d’évaluation primaire: EV + Pembro a réduit le risque d’événement de 60% (HR: 0,40; IC à 95%: 0,28–0,57; p<0,0001). Avec un suivi médian de 25,6 mois, l’EFS médiane n’était pas atteinte dans le bras expérimental et était de 15,7 mois dans le bras contrôle (Fig.1). La survie globale (OS) était également prolongée avec le traitement périopératoire: HR 0,50 (IC à 95%: 0,33–0,74; p=0,0002). La médiane n’était pas atteinte dans le bras expérimental et était de 41,7 mois dans le bras contrôle. Après 24 mois, 79,7% des patient·es étaient en vie sans événement contre 63,1%, et 74,7% contre 39,4%. Une rémission pathologique complète dans le tissu tumoral réséqué a été constatée chez 57,1% contre 8,6% des patient·es. L’allongement de l’EFS était indépendant de l’obtention d’une pCR sous le traitement périopératoire par EV+Pembro. Les effets indésirables observés correspondaient au profil de sécurité attendu de ces substances actives. Le curage tumoral et ganglionnaire n’a pas été impacté par le traitement néoadjuvant.
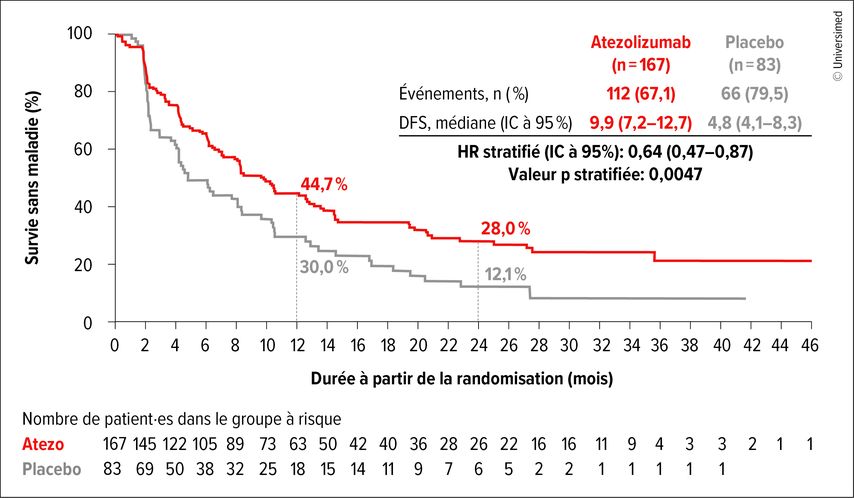
Fig.1: Traitement adjuvant par atezolizumab versus placebo chez des patient·es MIBC sélectionné·es pour leur ADNc (modifiée selon Vulsteke C et al.)3
Conclusion
Le traitement périopératoire par enfortumab vedotin plus pembrolizumab pourrait devenir un nouveau standard thérapeutique pour les patient·es MIBC non éligibles à la chimiothérapie à base de cisplatine.
Atezolizumab adjuvant pour les patient·es sélectionné·es par ADNc
L’étude IMvigor010 n’a pas démontré de bénéfice en DFS ou en OS pour l’atezolizumab adjuvant chez les patient·es MIBC.2 En sélectionnant les patient·es via l’ADN tumoral circulant (ADNc), l’étude de phaseIII IMvigor011 a révélé un bénéfice significatif avec l’atezolizumab.3
Une surveillance de l’ADNc (toutes les 6 semaines) et par imagerie (toutes les 12 semaines) a été réalisée chez 756 patient·es atteint·es de MIBC entre 6 et 24 semaines après la RC, jusqu’à 1 an. En cas d’ADNc positif sans progression radiologique, les patient·es étaient randomisé·es 2:1 pour recevoir atezolizumab ou placebo pendant un an. Les patient·es ayant un ADNc négatif étaient surveillé·es. Le critère d’évaluation primaire de l’étude était la survie sans maladie (DFS) dans la cohorte randomisée.
Au total, 379 patient·es ont présenté un ADNc positif à un moment donné après la RC et 250 ont été randomisé·es dans le bras atezolizumab ou placebo. Avec un suivi médian de 16,1 mois, le risque de rechute était réduit de 36% sous atezolizumab par rapport au placebo (HR: 0,64; IC à 95%: 0,47–0,87; p=0,0047). La médiane de la DFS était de 9,9 mois contre 4,8 mois (Fig.1). L’OS était également significativement prolongée dans la cohorte ADNc positif sous atezolizumab, passant de 21,1 à 32,8 mois (HR: 0,59; IC 95%: 0,39–0,90; p=0,0131). Après 24 mois, 62,8% des patient·es étaient en vie contre 46,9%. Dans la cohorte ADNc négatif persistant, les taux de DFS et d’OS étaient respectivement de 88,4% et 97,1% à 24 mois.
Conclusion
Le monitoring de l’ADNc permet d’identifier les patient·es MIBC susceptibles de bénéficier d’un traitement adjuvant par atezolizumab après une cystectomie radicale et d’éviter un traitement inutile chez les autres.
Conjugué anticorps-médicament ciblé HER2 prometteur
Les conjugués anticorps-médicament (ADC) sont des substances très efficaces, délivrant une cytotoxine directement dans la tumeur via un anticorps. Le disitamab vedotin ciblant HER2 a été évalué dans l’étude chinoise RC48-C016 en première ligne du carcinome urothélial localement avancé ou métastatique exprimant HER2.4
Dans cette étude randomisée, 484 patient·es éligibles au platine ont reçu disitamab vedotin + toripalimab, un inhibiteur de PD-1, ou 6 cycles de gemcitabine + cis- ou carboplatine. La survie sans progression (PFS) et l’OS constituaient les deux critères d’évaluation primaires. Ces deux critères ont montré un bénéfice significatif avec le traitement expérimental (suivi médian: 18,2 mois). La SSP médiane était de 13,1 mois contre 6,5 mois (HR: 0,36; IC à 95%: 0,28–0,46; p<0,0001), et l’OS médiane 31,5 mois contre 16,9 mois (HR: 0,54; IC 95%: 0,41–0,73; p<0,0001). Une réponse a été obtenue chez 76,1% contre 50,2% des patient·es, avec une durée médiane de réponse de 14,6 mois contre 5,6 mois. Les effets indésirables associés au traitement ont entraîné l’arrêt du traitement chez 12,3% contre 10,4% des patient·es.
Conclusion
Le disitamab vedotin plus toripalimab représente une option thérapeutique de première ligne prometteuse pour les patient·es atteint·es d’un carcinome urothélial localement avancé ou métastatique HER2-positif.
Cancer de la prostate
Traitement mieux toléré avec le darolutamide et le docétaxel/ADT
La trithérapie ADT + darolutamide + docétaxel (75mg/m2 q3w) est indiquée chez les patient·es atteint·es de cancer de la prostate hormono-sensible métastatique (mHSPC), sur la base des données de l’étude de phaseIII ARASENS.5Les complications liées à la neutropénie induite par le docétaxel limitent toutefois une large utilisation des régimes à base de docétaxel. L’étude ARASAFE a donc évalué si un docétaxel à dose réduite (50mg/m2 q2w) pouvait diminuer les effets indésirables de grade3–5.6
Au total, 250 patient·es (âge médian de 67–68 ans) ont été inclus·es dans l’étude ARASAFE. Ils·elles ont reçu en moyenne 5,6 doses (q3w) vs 10,7 doses (q2w) de docétaxel, pour un total cumulé de 842,8 vs 1073,5mg. Les événements indésirables de grade3–5, les neutropénies de grade3–4 et les décès (critères d’évaluation primaires) étaient significativement moins fréquents avec l’administration bihebdomadaire. Des événements indésirables de grade3–5 sont survenus chez 78,9% versus 61,2% des patient·es (p=0,0024), et des neutropénies de grade3–4 ou des décès de toute cause chez 64,1% versus 24,0% (p<0,0001). L’efficacité et la qualité de vie feront l’objet d’analyses complémentaires dans l’étude en cours.
Conclusion
L’étude ARASAFE confirme qu’une adaptation du schéma de docétaxel améliore la sécurité de la trithérapie darolutamide + ADT. Ce schéma modifié du docétaxel pourrait devenir un nouveau standard pour la trithérapie.
Radioligandothérapie dirigée par PSMA au stade hormono-sensible
L’étude de phaseIII PSMAddition a évalué le 177Lu-PSMA-617 en complément de l’ADT et de l’inhibiteur du récepteur des androgènes (ARPI) chez des patient·es atteint·es de mHSPC PSMA-positif.7 Les critères d’évaluation incluaient la PFS radiologique (critère d’évaluation primaire), la sécurité et l’OS. Un cross-over du bras contrôle vers le bras expérimental après progression radiologique était autorisé et réalisé par 16% des patient·es.
L’analyse menée après un suivi médian de 23,6 mois a montré qu’ajouter le 177Lu-PSMA-617 à l’ADT et à l’ARPI réduisait significativement le risque de progression ou de décès (HR: 0,72; IC à 95%: 0,58–0,90; p=0,002; Fig.2). La médiane n’était pas atteinte dans les deux bras de l’étude. Pour l’OS, le rapport de risque (HR) était de 0,84 après 14,9% d’événements contre 17,3% dans le bras de l’étude, suggérant une tendance en faveur de la radioligandothérapie (IC à 95%: 0,63–1,13; p=0,125). Une réponse au médicament à l’étude a été observée chez 87,3% contre 80,8% des patient·es, et une rémission complète (RC) chez 57,1% contre 42,3%. Le risque de progression du PSA a diminué de 58% (HR: 0,42; IC 95%: 0,30–0,59) et celui de résistance à la castration de 30% (HR: 0,70; IC à 95%: 0,58–0,84). Aucun nouveau signal de sécurité n’a été observé. Les effets indésirables étaient plus fréquents sous 177Lu-PSMA-617 que sous traitement hormonal seul. Les événements indésirables les plus fréquents associés au 177Lu-PSMA-617 étaient la sécheresse buccale, la fatigue et les nausées. Dans l’enquête sur la qualité de vie menée auprès des patient·es, aucune différence cliniquement significative n’a été observée concernant la qualité de vie ou la douleur.
Fig.2: Survie sans progression radiologique (rPFS) avec radioligandothérapie supplémentaire dans le mHSPC (modifiée selon Tagawa ST et al.)7
Conclusion
La combinaison 177Lu-PSMA-617 + ADT + ARPI exerce un impact cliniquement pertinent sur la PFS et plusieurs paramètres d’efficacité chez les patient·es atteint·es de mHSPC PSMA-positif.
Source:
Congrès annuel de l’European Society of Medical Oncology (ESMO), 17–21 octobre 2025, Berlin et en ligne
Littérature:
1 Vulsteke C et al.: Perioperative enfortumab vedotin plus pembrolizumab in participants with muscle-invasive bladder cancer who are cisplatin-ineligible: The phase III KEYNOTE-905 study. ESMO 2025; Abstr. #LBA2 2 Bellmunt J et al.: Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22: 525-537 3 Powles TB et al.: IMvigor011: Aphase III trial of circulating tumour DNA-guided adjuvant atezolizumab vs placebo in muscle-invasive bladder cancer. ESMO 2025; Abstr. #LBA8 4 Guo J et al.: Disitamab vedotin plus toripalimab versus chemotherapy in first-line locally advanced or metastatic urothelial carcinoma with HER2-expression. ESMO 2025; Abstr. #LBA7 5 Smith et al.: Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. NEngl J Med 2022; 386: 1132-1142 6 Grimm MO et al. 3-weekly docetaxel 75mg/m2 vs 2-weekly docetaxel 50 mg/m2 in combination with darolutamide + ADT in patients with mHSPC: results from the randomised phase III ARASAFE trial. ESMO 2025; Abstr. #LBA92 7 Tagawa ST et al.: Phase III trial of [177Lu]Lu-PSMA-617 combined with ADT + ARPI in patients with PSMA-positive metastatic hormone-sensitive prostate cancer (PSMAddition). ESMO 2025; Abstr. #LBA6
Das könnte Sie auch interessieren:
Traitements efficaces pour l’adénocarcinome de l’estomac et de la jonction œsogastrique
Dans le domaine des tumeurs gastro-intestinales, des progrès ont été réalisés, en particulier dans le traitement des patient·es atteint·es d’adénocarcinome de l’estomac et de la jonction ...
Intégration: précoce, progressive, conjointe ou (trop) tardive?
Les nouveaux traitements anticancéreux modifient également l’approche des soins palliatifs. Plus la durée de survie augmente, plus l’accent est mis sur la qualité de vie. Le moment de l’ ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...
%20avec%20radioligandoth%C3%A9rapie%20suppl%C3%A9mentaire.jpg)