Nouvelles directives et un puissant inhibiteur de BCR-ABL1
Auteure:
Prof. Dre méd. Gabriela Baerlocher
Klinik für Hämatologie & Onkologie,
Hirslanden Zürich
Medica Labor und Pathologie, Zürich
E-mail: gabriela.baerlocher@kho.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les recommandations de l’ELN sur la prise en charge de la LMC seront mises à jour en 2025. L’asciminib, un inhibiteur allostérique sélectif ciblant la poche myristoylée de BCR-ABL1, a récemment fait son entrée dans le traitement de première ligne. Son champ d’application exact reste toutefois à définir.
Au cours des prochaines décennies, on s’attend à une augmentation constante de la prévalence des patient·es atteint·es de leucémie myéloïde chronique (LMC).1 Les recommandations de l’ELN, qui seront mises à jour en 2025 sur la base de la dernière version de 2020, constituent un soutien dans la recherche des meilleurs soins possibles pour les patient·es.2 Les nouveautés prévues ont fait l’objet d’une présentation dans le cadre du 21e symposium de l’ELN à Mannheim, en Allemagne, en février2025.
Classification des maladies et scores pronostiques
En ce qui concerne la classification des stades de la LMC, il convient de noter qu’il existe des différences entre la classification de l’ELN et celle de l’OMS, ce qui ne facilite pas le diagnostic au quotidien. Les différences résident dans la définition du nombre de blastes pour la phase accélérée et la crise blastique. La question se pose de savoir si, à l’avenir, la classification des stades de la LMC ne devrait pas être plutôt biphasique que triphasique.2,3
Les facteurs à haut risque, soit déjà présents au moment du diagnostic, soit apparaissant sous traitement, sont également pertinents. Les facteurs pertinents au moment du diagnostic incluent un score ELTS élevé, 10 à 19% de blastes dans le sang périphérique et/ou la moelle osseuse, ainsi que des anomalies chromosomiques supplémentaires dans les cellules positives pour le chromosome Philadelphie (Ph) (p.ex. monosomie 7, caryotype complexe). En outre, les amas de petits mégacaryocytes ou une fibrose importante de la réticuline et/ou du collagène sont également considérés comme tels au moment du diagnostic. L’absence de rémission hématologique complète sous le premier inhibiteur de tyrosine kinase (ITK) fait partie des facteurs à haut risque qui apparaissent pendant le traitement. Ces facteurs incluent aussi les résistances à deux ITK successifs qui ne peuvent pas être expliquées par une mutation ou l’apparition de mutations complexes sous traitement par ITK, ainsi que les nouvelles aberrations chromosomiques.
Le score ELTS est recommandé pour évaluer le risque, car il se réfère au critère de survie (décès lié à la LMC).4 Le score de Sokal est toujours utilisé en complément, car il a été utilisé dans de nombreuses études et offre ainsi une possibilité de comparaison.5
Surveillance de la réponse au traitement
Un aspect important de la prise en charge consiste à contrôler la réponse au traitement. Dans ce domaine, les nouvelles recommandations visent à être aussi faciles à appliquer que possible par les médecins, spécialisés ou non dans la LMC, qui traitent des patient·es atteint·es de LMC dans le monde entier. La progression doit être prévenue ou retardée afin de prolonger la survie. Il est important d’identifier les patient·es dont le pronostic est défavorable. En outre, il convient d’identifier les patient·es pour lesquel·les l’arrêt du traitement (rémission sans traitement) semble justifié. La réponse au traitement par ITK présente différentes évolutions. Certains patient·es présentent une résistance primaire (env.10%) ou secondaire (env.10%), d’autres ont une réponse en plateau au-dessus du seuil MR4 (BCR-ABL1 <0,01%; env.50%), et d’autres encore présentent une réponse profonde et restent sans traitement après l’arrêt de l’ITK (15%), tandis que d’autres subissent une récidive avec une réexposition à l’ITK (15%).6
Les recommandations de l’ELN de 2020 délimitent, sur la base de la réponse moléculaire, du score de risque ELTS et de la nouvelle apparition d’anomalies chromosomiques supplémentaires, l’évolution optimale par rapport à une évolution à surveiller («Warning») et à l’échec du traitement.2 La mise à jour des recommandations entraînera certainement un changement de nom des catégories («favorable» au lieu de «optimal» et «unfavorable» au lieu de «failure»), tandis que les étapes clés resteront inchangées. Comme le suggèrent les données actuelles, aucun changement d’ITK ne devrait être effectué sur la base d’un résultat isolé au niveau d’une des étapes clés. Certains patient·es figurant dans la catégorie «échec» peuvent être des répondeurs tardifs. De plus, les patient·es âgé·es souffrent souvent de comorbidités et le passage à des médicaments plus puissants peut présenter un risque d’effets secondaires, ce pourquoi il peut être déconseillé de passer à un ITK plus puissant.
Traitement de première ligne: ASC4FIRST
Pour le traitement de première ligne de la LMC en phase chronique, on disposait jusqu’à présent en Suisse des quatre ITK imatinib, nilotinib, dasatinib et bosutinib.6 En deuxième ligne, il est possible de passer à l’une des autres substances. Le ponatinib est utilisé en deuxième ligne en cas de résistance ou d’intolérance à un ITK de deuxième génération ou en présence d’une mutation T315I, de mutations composites ou d’une progression vers la phase accélérée/blastique. Il en va de même pour l’asciminib, sauf en cas de progression vers la phase accélérée/blastique et avec une dose de médicament plus élevée (200mg/d) en présence d’une mutation T315I.
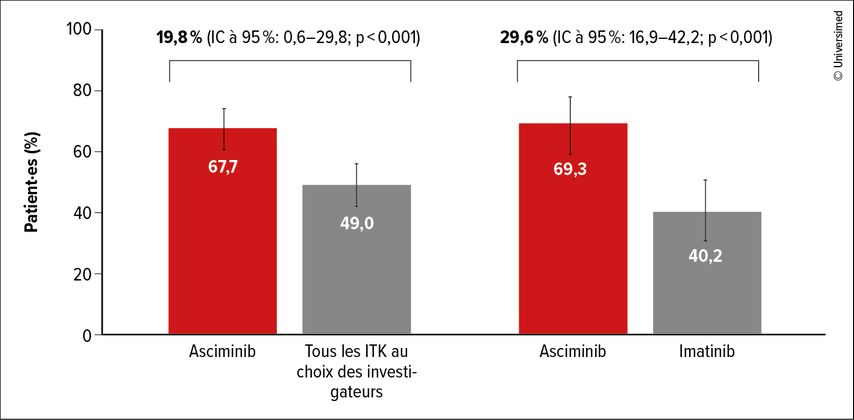
Fin janvier 2025, l’asciminib a été autorisé en Suisse chez les adultes atteints de LMC Ph positive en phase chronique nouvellement diagnostiquée ou prétraitée par un cABL-TKI.7 Ceci reposait notamment sur l’étude de phaseIII ASC4FIRST, au cours de laquelle les patient·es ont reçu 80mg/d d’asciminib ou une dose d’ITK standard de manière randomisée. Le choix du comparateur a été individualisé lors d’une phase de pré-randomisation. Le critère d’évaluation primaire était la réponse moléculaire «majeure» (RMM) à 48 semaines, comparée à tous les autres ITK ou, séparément à l’imatinib.
L’asciminib a obtenu des résultats significativement meilleurs dans les deux comparaisons (p<0,001 dans les deux cas; Fig. 1).8 La supériorité de l’asciminib s’est manifestée dans tous les sous-groupes. Un bénéfice particulier semblait être observé chez les patient·es âgé·es de ≥75ans. Après un an, les taux de rémissions moléculaires profondes ont presque doublé dans le bras expérimental par rapport au groupe de patient·es ayant reçu tous les autres ITK (MR4: 38,8% vs 20,6%; MR4,5: 16,9% vs 8,8%); la comparaison avec l’imatinib a montré des différences encore plus importantes (MR4: 42,6% vs 17,8%; MR4,5: 17,8% vs 4,9%). L’asciminib a également présenté des avantages en termes de fréquence des effets indésirables de grade supérieur (grade≥3). L’asciminib a été associé aux taux les plus faibles d’événements indésirables ayant entraîné des arrêts de traitement ou des ajustements de dose. Dans le domaine non hématologique, la diarrhée, les éruptions cutanées, les nausées et les œdèmes faciaux sont apparus avec une incidence plus faible que sous imatinib et, en partie, que sous les ITK de deuxième génération.
Fig. 1: Réponse moléculaire «majeure» à 48 semaines sous asciminib vs ITK comparateur au choix des investigateurs ou imatinib (modifiée selon Hughes TP et al.)8
Les talons d’Achille de l’asciminib
Pour l’instant, la valeur de l’asciminib est relativisée par le fait que la manifestation de mutations BCR-ABL1 en lien avec le traitement doit encore faire l’objet de recherches approfondies. Un certain nombre de mutations différentes ont été identifiées dans l’étude de phaseI.9 Les observations cliniques contredisent l’hypothèse selon laquelle les spectres des mutations de résistance ne se chevauchent pas entre les inhibiteurs ATP-compétitifs et l’asciminib.
Dans l’ensemble, la substance présente certains talons d’Achille qui doivent encore être observés et décrits de manière plus approfondie afin de définir le domaine d’application idéal.
Littérature:
1 Lauseker M et al.: Improved survival boosts the prevalence of chronic myeloid leukemia: predictions from a population-based study. J Cancer Res Clin 2016; 142: 1441-7 2 Hochhaus A et al.: European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 34(4): 966-84 3 Arber DA et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405 4 Pfirrmann M et al.: Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia. Leukemia 2016; 30(1): 48-56 5 Sokal JE et al.: Prognostic discrimination in «good-risk» chronic granulocytic leukemia. Blood 1984; 63(4): 789-99 6 Baerlocher GM, Oppliger Leibundgut E: Pocket cards for the monitoring of patients with chronic myeloid leukemia. Third Edition 2022 based on recommendations from the European LeukemiaNet 2020 7Information professionnelleScemblix® 8 Hughes TP et al.: ASC4FIRST, apivotal phase 3 study of asciminib vs investigator-selected tyrosine kinase inhibitors in newly diagnosed patients with chronic myeloid leukemia: primary results. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA6500 9 Hughes TP et al.: Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019; 381(24): 2315-26
Das könnte Sie auch interessieren:
Nouvelle époque, nouveaux pollens?
Le changement climatique, avec l’augmentation du CO2, la hausse des températures et la modification du régime des précipitations, influence la concentration, l’allergénicité et la la ...
Nouvelles données sur l’apparition de lymphopénies liées aux principes actifs
Le champ thérapeutique de la sclérose en plaques (SEP) a considérablement évolué au cours des dernières décennies grâce au développement de traitements de fond efficaces. Outre les ...
Stratégies thérapeutiques de la MASLD en 2025
La stéatose hépatique non alcoolique ou MASLD («metabolic dysfunction-associated steatotic liver disease») est une maladie métabolique liée à une accumulation de graisse dans le foie.1 ...