Les incrétinomimétiques dans les études cliniques
Compte-rendu:
Reno Barth
Journaliste médical
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Des études de phase III présentées dans le cadre du congrès de l’EASD 2025 ont examiné l’efficacité de médicaments ciblant les récepteurs au GLP. Entre autres, on dispose désormais de données de comparaison directe entre le double agoniste des récepteurs du GIP et du GLP-1 tirzépatide, ainsi que l’analogue du GLP-1 dulaglutide. Une perte de poids significative a été obtenue sous l’agoniste oral des récepteursdu GLP-1 orforglipron. De nouvelles substances agissant sur GIP et GLP-1 font l’objet d’études cliniques en phase précoce.
Keypoints
-
Le tirzépatide ne s’est pas révélé inférieur au dulaglutide en ce qui concerne le critère d’évaluation primaire MACE-3.
-
Une perte de poids significative a été obtenue sous l’agoniste oral des récepteurs du GLP-1 orforglipron dans le cadre d’une étude de phase III.
-
De nombreux doubles incrétinomimétiques font l’objet d’études cliniques.
-
L’activation combinée des récepteurs du GLP-1 et du GLP-2 doit permettre de perdre du poids tout en gagnant de la masse musculaire.
Les résultats de la première étude des critères d’évaluation cardiovasculaires portant sur le double agoniste des récepteurs du GIP et du GLP-1 tirzépatide (SURPASS-CVOT) étaient très attendus. Comme les agonistes des récepteurs du GLP-1 (GLP-1-RA) font partie du traitement de référence du diabète de type 2, l’étude n’a pas pu être contrôlée par placebo pour des raisons éthiques, mais uniquement par un comparateur actif. Le GLP-1-RA dulaglutide a été utilisé à cet effet. Le bénéfice cardiovasculaire du dulaglutide a été démontré dans l’étude REWIND, où il a réduit significativement de 12% le critère d’évaluation combiné d’infarctus du myocarde, d’accident vasculaire cérébral et de décès d’origine cardiovasculaire.1 Pour l’étude SURPASS-CVOT, 13165 patient·es ont été recruté·es dans 30 pays et suivi·es pendant une période d’environ quatre ans. La population de l’étude a reçu un excellent traitement cardiovasculaire concomitant, 86% des personnes étant traitées par une statine et 30% par un inhibiteur du SGLT2 (iSGLT2).
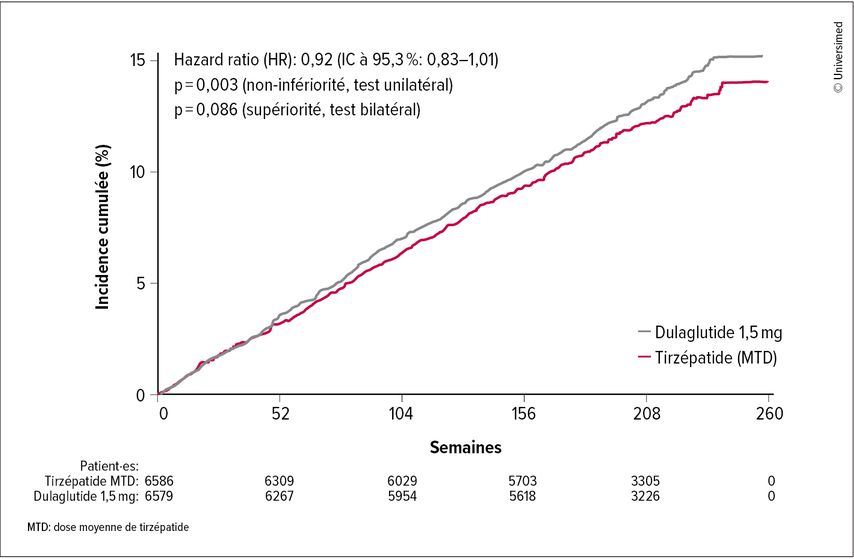
Étude SURPASS-CVOT: le tirzépatide montre une non-infériorité par rapport au dulaglutide
Lors du congrès de l’EASD, le Pr Stephen Nicholls de l’Université Monash de Melbourne, Australie, a présenté les résultats de l’étude SURPASS-CVOT. Le tirzépatide s’est avéré non inférieur au dulaglutide en ce qui concerne le critère d’évaluation primaire combiné (MACE-3) d’infarctus du myocarde, d’accident vasculaire cérébral et de décès d’origine cardiovasculaire (HR: 0,92; IC à 95%: 0,83–1,01). La non-infériorité était cohérente à travers toutes les composantes du critère d’évaluation primaire. En revanche, le deuxième critère d’évaluation primaire de supériorité n’a pas pu être démontré avec une valeur de p de 0,086. Alors que la non-infériorité a été démontrée en ce qui concerne la mortalité cardiovasculaire, une analyse exploratoire a révélé une réduction de 16% de la mortalité toutes causes confondues sous tirzépatide par rapport au dulaglutide, ce qui pourrait être dû à une réduction des décès d’origine non cardiovasculaire, notamment dus à des infections.
L’étude contrôlée par placebo REWIND a permis de comparer le tirzépatide avec un groupe sous placebo fictif. Celui-ci a révélé une réduction de 28% du risque de MACE-3 (HR: 0,72; IC à 95%: 0,55–0,94) et de 39% de la mortalité toutes causes confondues (HR: 0,61; IC à 95%: 0,45–0,82). «Cela confirme l’effet cardioprotecteur du tirzépatide», a déclaré S. Nicholls. Sur plusieurs critères d’évaluation métaboliques, le tirzépatide s’est révélé significativement supérieur au dulaglutide. Ainsi, l’HbA1c d’une valeur initiale de 8,39% a diminué de 1,73% sous tirzépatide par rapport à 0,9% sous dulaglutide. La perte de poids était plus prononcée sous tirzépatide par rapport à sous dulaglutide. Dans le sous-groupe des patient·es atteint·es de maladie rénale chronique, le DFGe a diminué de manière nettement plus significative dans le groupe sous dulaglutide par rapport au groupe sous tirzépatide.
La tolérance a été bonne, les troubles gastro-intestinaux constituant l’effet indésirable le plus fréquent. Le tirzépatide a été titré à une dose de 15mg lorsque cela était possible. Après 3 ans, 72,7% des patient·es ont été traité·es à cette dose. Les arrêts de traitement en raison d’effets indésirables ont été de 13,3% sous tirzépatide et de 10,2% sous dulaglutide.
Étude ATTAIN-1: l’agoniste oral des récepteurs du GLP-1 fait ses preuves en phase III
Une autre session du congrès de l’EASD a été consacrée à la première étude de phase III sur le l’agoniste oral des récepteurs du GLP-1 orforglipron (ATTAIN-1).2 Il s’agit d’une «small molecule» qui, tout comme les hormones peptidiques modifiées utilisées comme analogues du GLP-1, se lie aux récepteurs du GLP-1 en tant qu’agoniste, ce qui entraîne une augmentation de la libération d’insuline en cas de glycémie élevée, une inhibition de la sécrétion de glucagon, un ralentissement de la vidange gastrique et une augmentation de la sensation de satiété. Dans l’étude ATTAIN-1, l’orforglipron n’a pas été étudié dans l’indication du diabète de type 2, mais pour la perte de poids.
L’étude de phase III randomisée, en double aveugle, multinationale ATTAIN-1 a comparé l’orforglipron aux doses de 6, 12 ou 36mg une fois par jour à un placebo.2 En outre, les patient·es ont reçu comme consigne d’adopter une alimentation saine et d’avoir une activité physique suffisante. Il·elles souffraient tou·tes d’obésité, mais pas de diabète. Le critère d’évaluation primaire était le pourcentage de perte de poids sur 72 semaines. 3127 patient·es ont été randomisé·es dans neuf pays.
Fig.1: Étude SURPASS-CVOT – critère d’évaluation primaire MACE-3 de décès d’origine cardiovasculaire, d’infarctus du myocarde et d’accident vasculaire cérébral. Le tirzépatide n’est pas inférieur au dulaglutide. Cependant, il n’est pas non plus supérieur (Nicholls S et al., EASD 2025)
L’étude ATTAIN-1 a atteint le critère d’évaluation primaire. La perte de poids sous orforglipron a été respectivement de 7,5% (6mg), 8,4% (12mg) et 11,2% (36mg) par rapport à 2,5% dans le groupe sous placebo. Parmi les patient·es du groupe recevant 36mg d’orforglipron, plus de la moitié (54,6%) ont obtenu une perte de poids de 10% et 18,4% une perte d’au moins 20%. D’autres critères d’évaluation, tels que le tour de taille, la pression artérielle systolique et le non-HDL-C, se sont ainsi également améliorés.
Le profil d’effets indésirables était typique du GLP-1-RA, les troubles gastro-intestinaux constituant l’effet indésirable le plus fréquent. Entre 5,3 et 10,3% des patient·es des groupes sous traitement actif et 2,7% des patient·es du groupe sous placebo ont arrêté le traitement en raison d’une intolérance. «Après 72 semaines de traitement, tout·es les patient·es des trois groupes sous orforglipron ont connu une perte de poids conséquente, cliniquement significative et proportionnelle à la dose», a déclaré le Dr Sean Wharton de l’Université McMaster d’Hamilton, au Canada. Il indique qu’on peut s’attendre à des bénéfices cardiométaboliques pertinents à partir d’une perte de poids de 10%. Le fait que l’orforglipron soit administré par voie orale pourrait contribuer à rendre le traitement de l’obésité par GLP-1-RA accessible à un plus grand nombre de personnes concernées.
Traitement expérimental: agonistes des récepteurs du GLP-2
D’autres nouvelles substances du groupe des incrétinomimétiques font actuellement l’objet d’études cliniques. Il s’agit pour beaucoup de doubles agonistes agissant sur le GLP-1 et d’autres récepteurs. Le PG-102 est un agoniste bispécifique des récepteurs du GLP-1/GLP-2 développé en Corée. Son action sur le récepteur du GLP-2 doit aider à préserver la masse musculaire malgré la perte de poids, en améliorant l’absorption de l’énergie et des nutriments par le muscle ainsi que sa sensibilité à l’insuline. Il doit ainsi permettre d’éviter la perte de masse musculaire sous GLP-1-RA. Dans le cadre de l’EASD 2025, deux travaux portant sur le PG-102 ont été présentés sous forme de Late-breaking Abstracts. L’un est une étude sur un modèle animal, le second porte sur la première utilisation chez l’être humain.
Dans le modèle murin, le PG-102 associé à l’inhibiteur de la myostatine bimagrumab a entraîné une perte de poids comparable à celle sous sémaglutide (associé au bimagrumab). La masse musculaire des animaux recevant le PG-102 en monothérapie une fois par semaine a été mieux préservée d’environ 5% par rapport au sémaglutide administré quotidiennement. La masse musculaire des souris sous PG-102 plus bimagrumab a augmenté d’environ 5%, tandis qu’elle a diminué de 4% sous sémaglutide plus bimagrumab. Les premiers résultats d’une étude de phase Ic menée chez l’être humain avec 34 patient·es ont également été présentés lors du congrès. Dans cette étude, des doses hebdomadaires allant jusqu’à 80mg ont été bien tolérées. Des effets indésirables gastro-intestinaux sont survenus, mais la plupart étaient légers. Aucune interruption ou aucun arrêt de traitement n’a été nécessaire. La perte de poids dans les groupes sous traitement actif sur 4 semaines a été de 2,4% (60mg) et de 4,8% (80mg) par rapport au placebo, confirmant ainsi une relation dose-effet. Le tour de taille a diminué en fonction de la dose et la tolérance au glucose s’est améliorée. Selon les auteur·rices, ce résultat justifie la poursuite du développement clinique du PG-102.
Source:
61e congrès annuel de l’European Association for the Study of Diabetes (EASD),du 15 au 19 septembre 2025, à Vienne
Littérature:
1 Gerstein HC et al.: Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019; 394: 121-30 2 Wharton S et al.: Orforglipron, an oral small-molecule GLP-1 Receptor agonist for obesity treatment. N Engl J Med 2025; doi: 10.1056/NEJMoa2511774 3 Lee SA et al.: Weekly PG-102 plus bimagrumab enhances net muscle gain compared to daily semaglutide-based regimens. EASD 2025, Late-breaking Abstract LBA 16 4 Yang SI et al.: PG-102, a bispecific GLP-1/GLP-2 Fc fusion protein, outperforms dual-function peptide and combination therapy in preclinical models and induces dose-dependet weight loss in obese subjects. EASD 2025, Late-breaking Abstract LBA 18
Das könnte Sie auch interessieren:
Urgences diabétologiques: hypo- et hyperglycémie
L’insuline ou les sulfonylurées sont la deuxième et la quatrième cause d’hospitalisation d’urgence liée aux médicaments.1 Lors du FOMF Update Refresher médecine interne générale, le Pr ...
Prise en charge pré- et postopératoiredes transplantations en médecinede premier recours
Les médecins de premier recours jouent un rôle important dans le suivi des patients avant et après une transplantation rénale, mais aussi dans l’accompagnement des donneurs vivants ...
Cœur, vaisseaux et yeux: données sur l’efficacité et la tolérance du sémaglutide
Outre des résultats positifs en termes d’efficacité dans le traitement du diabète de type 2 (DT2) et la régulation du poids, les agonistes des récepteurs du GLP-1 (GLP-1-RA) présentent ...