Thermo-ablation des nodules thyroïdiens
Compte-rendu:
Dr méd. Sabina Ludin
Rédactrice en chef
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
En présence de nodules chauds, la thermo-ablation par radiofréquence ou par ablation au laser constitue une bonne alternative au traitement par l’iode radioactif. Ces deux méthodes permettent d’obtenir une réduction volumétrique significative des nodules et, chez une grande partie des patients, une normalisation de la fonction thyroïdienne. Le risque d’hypothyroïdie semble être plus faible avec l’ablation par radiofréquence qu’avec le traitement par l’iode radioactif bien qu’il manque encore des données à long terme à ce sujet.
Depuis deux ans, nous sommes en mesure de proposer à nos patients présentant des nodules thyroïdiens pour lesquels une procédure ablative est indiquée la thermo-ablation du nodule par ablation par radiofréquence bipolaire», a déclaré le Dr méd. Stefan Fischli, co-médecin-chef, au service d’endocrinologie/diabétologie, de l’Hôpital cantonal de Lucerne. L’ablation par radiofréquence (ARF) bipolaire est peu invasive et s’effectue en ambulatoire. Le courant à haute fréquence (200 à 1200kHz) est appliqué de manière ciblée à l’aide d’une sonde bipolaire sous contrôle échographique. Le nodule entier est traité par de multiples décharges qui se superposent, la pointe de la sonde produisant de la chaleur ayant un diamètre de 9 à 40mm.
L’indication de l’ARF est posée conjointement dans une démarche interdisciplinaire impliquant des endocrinologues, des médecins nucléaristes et des chirurgiens. Avant l’intervention, une laryngoscopie est effectuée afin de vérifier qu’il n’y a pas d’anomalies des cordes vocales. En outre, une ponction à l’aiguille fine doit permettre d’exclure toute tumeur maligne dans le nodule ou dans les nodules de l’autre lobe thyroïdien. L’ARF est réalisée sous surveillance (pression artérielle, fréquence cardiaque, saturation en oxygène; canule i.v.). Après l’intervention, le patient reçoit des AINS et des stéroïdes oraux pendant une courte période. Après quatre semaines, l’état des cordes vocales est examiné, une scintigraphie post-ablation est réalisée et plusieurs contrôles échographiques sont effectués à quelques mois d’intervalle.
Efficacité
Taux de réduction volumétrique (TRV)
L’efficacité de l’ARF a été évaluée dans le cadre de différentes études. Le nombre de patients, la taille des nodules et la durée du suivi varient parfois fortement d’une étude à l’autre. Il en va de même pour le taux de réduction volumétrique (TRV) observé dans le cadre des cinq études présentées par l’intervenant, qui est de 64,9 à 97,9%.1–5 Le taux de récidive est également très variable, certaines études faisant ressortir un taux assez élevé de 20 à 25%.2,5 «À y regarder de plus près, on constate qu’une nouvelle croissance tissulaire est observée dans les zones non ablatées ou dans les zones périphériques du nodule. Il est donc important de veiller à ce que les bords soient bien ablatés», a souligné S.Fischli. Dans une méta-analyse de 12 études portant sur un total de 779 patients, le TRV à 6, 12 et 24 mois était respectivement de 68%, 75% et 87%.6 De plus, une diminution significative des symptômes de compression et une amélioration esthétique significative ont été constatées après l’ARF.6
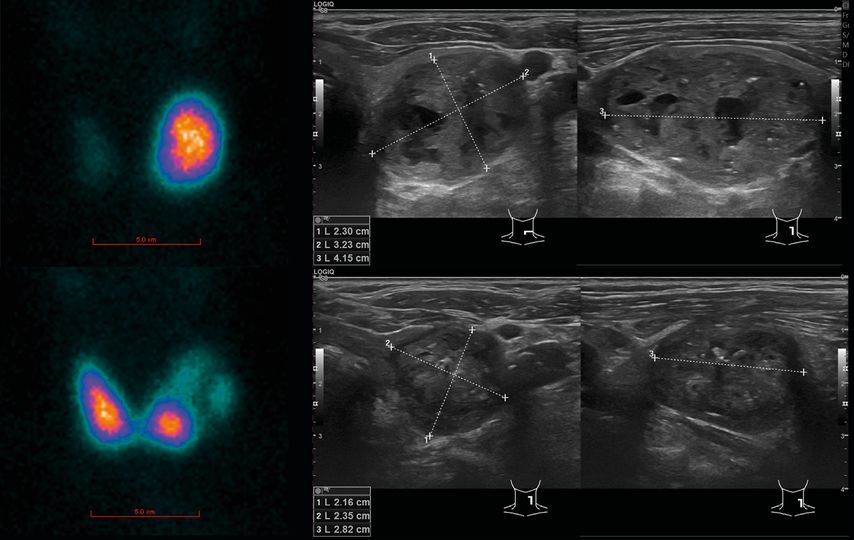
Fig. 1: Patient de 72 ans avec goitre nodulaire, aucun symptôme de compression, hyperthyroïdie T3 isolée en laboratoire avec TSH supprimée. En haut: échographie avec nodule dominant à gauche, identifié comme autonomie focale à la scintigraphie. En bas: scintigraphie 4 semaines après ablation par radiofréquence du nodule avec autonomie régressive et normalisation de la fonction du côté controlatéral, TSH normale en laboratoire. Échographie après 4 mois avec une nette régression de la taille
À l’Hôpital cantonal de Lucerne, 15 patients présentant 16 nodules ont été traités par ARF depuis juin 2019. Dans la plupart des cas (13/16), il s’agissait de nodules chauds (AFTN, «autonomously functioning thyroid nodule»). Cinq patients présentaient une hyperthyroïdie manifeste et ont été partiellement traités par des thyréostatiques avant l’ARF. La durée de l’ARF était en moyenne de 18,3 minutes. «Le TRV lors du dernier contrôle actuel après 18 à 24 mois est de 92% et aucun patient n’a présenté jusqu’à présent de signes de nouvelle croissance tissulaire», a rapporté S.Fischli.
Normalisation de la fonction thyroïdienne
Outre la réduction volumétrique, le deuxième objectif de l’ARF en présence de nodules chauds est la normalisation de la fonction thyroïdienne. Les données à ce sujet sont toutefois encore plus limitées. Dans la plupart des études, le nombre de cas est faible et le suivi ne dépasse pas 24 mois.3,7–11 Dans les études plus anciennes,7, 8 le taux de normalisation de la TSH est parfois ≤50%, mais dans les études plus récentes3,10,11 il avoisine les 90%. Dans une méta-analyse de 14 études portant sur 411 patients, une normalisation de la TSH a été constatée chez 71,2% des patients 12 mois après l’ARF.12 Respectivement 1 et 2 cas d’hypothyroïdie subclinique ont été relevés dans seulement deux études,1,10 aucun patient n’a présenté d’hypothyroïdie après l’ARF dans les autres études. «Les observations faites chez nos patients concordent avec ces données. À l’exception d’un patient qui présentait encore une hyperthyroïdie subclinique 18 mois après l’ARF, les valeurs thyroïdiennes se sont normalisées chez tous les patients. Les thyréostatiques ont pu être arrêtés chez tous les patients et aucun n’a eu besoin d’un traitement substitutif par LT4 pendant le suivi», a rapporté l’intervenant.
Comparaison avec le traitement par l’iode radioactif
Il existe très peu d’études comparant directement les différentes méthodes ablatives – chirurgie, traitement par l’iode radioactif, thermo-ablation – entre elles. Dans le cadre d’une étude ancienne datant de 2007, le traitement par l’iode radioactif a été comparé à la thermo-ablation sous forme d’ablation au laser.13 Les deux méthodes ont permis de réduire pratiquement de moitié le volume du nodule. En ce qui concerne la normalisation de la TSH, le traitement par l’iode radioactif était supérieur à l’ablation au laser. En revanche, l’ablation au laser n’a pas affecté le tissu thyroïdien extranodulaire et aucun patient n’a développé d’hypothyroïdie. Après le traitement par l’iode radioactif, une hypothyroïdie manifeste est apparue chez deux des 13 patients. Dans une étude récente, Crivelli et al. ont comparé le traitement par l’iode radioactif à l’ARF chez 50 patients.10 En ce qui concerne le TRV, il n’y avait pas de différence statistique entre les deux méthodes. Dans le groupe ARF, la TSH s’est normalisée à 90,9%, 2 patients ont développé une hypothyroïdie subclinique. En comparaison, l’ablation par l’iode radioactif a permis d’obtenir une normalisation de la TSH chez 72% des patients, 7 ont développé une hypothyroïdie, dont 5 une hypothyroïdie manifeste.
Complications
Jung Hwan Baek, l’un des pionniers de l’ARF, et ses collègues ont étudié le taux de complications chez 1459 patients traités par l’ARF.14 Ils ont enregistré une complication lors de 3,3% des interventions, dans 20 cas de nature sévère, telle qu’une altération de la voix (n=15), des lésions du plexus brachial (n=1), une rupture du nodule (n=3) et une hypothyroïdie permanente (n=1). Les complications mineures les plus fréquentes étaient les hématomes, les vomissements et les brûlures cutanées.
«Les facteurs en corrélation avec le taux de complications sont l’expertise du médecin exécutant, la taille et la localisation du nodule, mais aussi les difficultés à identifier les structures anatomiques vulnérables, telles que les nerfs et les vaisseaux», selon S. Fischli.
Conclusion
L’ARF se caractérise par plusieurs avantages:
-
Elle peut être réalisée en ambulatoire et est donc moins coûteuse que le traitement chirurgical.
-
Il s’agit d’une intervention locale, peu invasive et réalisée en ambulatoire.
-
Le taux de réduction volumétrique est supérieur à 70%, ce qui entraîne une diminution significative des symptômes de compression.
-
En présence de nodules chauds, une normalisation de la TSH peut être obtenue chez une grande partie des patients.
-
Si l’intervention est réalisée correctement, le taux de complications est faible.
-
Le risque d’hypothyroïdie iatrogène semble très faible.
-
Si nécessaire, elle peut être combinée à un traitement à l’iode radioactif.
Il existe toutefois des points critiques et des questions en suspens:
-
La prudence est de mise chez les patients jeunes, en présence de nodules de grande taille, en cas de localisation rétrosternale, en présence de goitre multinodulaire et en cas de morphologie suspecte à l’échographie.
-
Des données à long terme font encore défaut, notamment en ce qui concerne la fonction thyroïdienne et le taux de récidive.
-
La procédure à suivre chez les patients nécessitant une thyroïdectomie chirurgicale après l’ARF reste à définir (tissu cicatriciel). Dans de tels cas, il ne faut pas effectuer d’ARF au préalable.
-
L’ARF est une méthode qui nécessite beaucoup d’entraînement (au moins 50 interventions pour atteindre une bonne qualité).
«Les nodules chauds d’une taille maximale de 4 à 5cm constituent à mon avis une très bonne indication pour l’ARF.», a déclaré S. Fischli.
Source:
Congrès annuel de la Société suisse d’endocrinologie et de diabétologie (SSED), 11 et 12 novembre 2021, Berne
Littérature:
1Lim HK et al.: Eur Radiol 2013; 23: 1044-9 2 Sim JS et al.: Int J Hyperthermia 2017; 33: 905-10 3 Dobnig H, Amrein K: Thyroid 2018; 28: 472-80 4 Deandrea M et al.: J Clin Endocrinol Metab 2019; 104: 3751-6 5 Bernardi S et al.: Thyroid 2020; 30: 1759-70 6 Trimboli P et al.: Endocrine 2020; 67: 35-43 7 Faggiano A et al.: J Clin Endocrinol Metab 2012; 97: 4439-45 8 Bernardi S et al.: Endocrine 2017; 57: 402-8 9 Cesareo R et al.: Int J Hyperthermia 2018; 34: 617-23 10 Cervelli R et al.: Clin Endocrinol 2019; 90: 608-16 11 Cappelli C et al.: J Endocrinol Invest 2020; 43: 477-82 12 Kim HJ et al.: Eur Radiol 2021; 31: 605-15 13 Døssing H et al.: Eur J Endocrinol 2007; 157: 95-100 14 Baek JH et al.: Radiology 2012; 262: 335-42
Das könnte Sie auch interessieren:
Prise en charge des acouphènes en 2025
Le traitement des acouphènes a évolué au cours des dernières années. Les directives de l’AWMF sur la prise en charge des acouphènes proposent des recommandations fondées sur des preuves ...
Traitement hormonal de réassignation sexuelle et santé cardiovasculaire
Un risque accru d’événements cardiovasculaires a été observé chez les personnes TGD («transgender and gender-diverse»), sans qu’il ne soit possible d’exclure que le traitement hormonal ...
La nouvelle directive KDIGO sur l’ADPKD
En janvier 2025, l’organisation KDIGO (Kidney Disease: Improving Global Outcomes) a publié pour la première fois une directive claire sur le diagnostic et le traitement de la polykystose ...