Kombinationstherapie PARPi+ARPi
Autorin:
OÄ Dr. Veronika Dragschitz
Klinische Abteilung für Urologie Universitätsklinikum St. Pölten
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Zulassung von Poly(Adenosin-Diphosphat-Ribose)-Polymerasen-Inhibitoren (PARPi) in Kombination mit Androgenrezeptor-Signalweg-Inhibitoren (ARPi) markiert einen Paradigmenwechsel in der Therapie des metastasierten kastrationsresistenten Prostatakarzinoms. Dieser Artikel gibt einen umfassenden Überblick über alle drei zugelassenen PARPi+ARPi-Kombinationsregime.
Keypoints
-
Aktuell stehen drei Kombinationstherapien aus einem PARPi und einem ARPi zur Verfügung: Olaparib plus Abirateron, Niraparib plus Abirateron und Enzaltuamid plus Talazoparib.
-
Olaparib plus Abirateron und Enzalutamid plus Talazoparib sind unabhängig vom HRR-(homologe rekombinante Reparatur)-Status zugelassen. Niraparib plus Abirateron ist hingegen nur für BRCA1/2- mutierte Patienten indiziert.
-
Patienten mit Mutationen in Genen der homologen rekombinanten Reparatur, besonders in den Genen BRCA1 oder BRCA2, profitieren am stärksten von einer Kombinationstherapie.
-
Häufigste Nebenwirkungen der Kombinationstherapie sind hämatologische Toxizitäten wie Anämie, Neutropenie und Thrombozytopenie.
Die häufigste Krebserkrankung bei Männern in Österreich ist seit 1994 das Prostatakarzinom, mit einer Inzidenz im Jahr 2023 von 172,8/100000 Männern.1
Trotz Behandlungsmöglichkeiten in frühen Krankheitsstadien kommt es bei einem Teil der Betroffenen zu einer Progression in ein metastasiertes, kastrationsrefraktäres Stadium (mCRPC) mit heterogenem Erkrankungsmuster und verschiedenen molekularen Subtypen. Krebserkrankungen sind gekennzeichnet durch DNA-Schäden und Schäden in den Reparaturmechanismen. Bei ca. 20–30% der Patienten kommt es zu „Loss of function“-Mutationen in Genen, die für DNA-Reparatur zuständig sind, insbesondere der homologen Rekombination, wobei die am häufigsten auftretende Mutation beim Prostatakarzinom BRCA2 ist.2 Im Falle von homologen Rekombinationsdefekten werden DNA-Reparaturmechanismen weniger effizient und andere Mechanismen müssen in Anspruch genommen werden, um die Akkumulation von DNA-Schäden zu verhindern, die schlussendlich zur Apoptose führen würden.
Wirkmechanismus und Rationale hinter der Kombinationstherapie
Poly(ADP-Ribose)-Polymerasen (PARP) sind eine Familie von Enzymen, die eine zentrale Rolle bei der Reparatur von DNA-Schäden, insbesondere Einzelstrangbrüchen, spielen, indem sie an Abschnitte mit DNA-Schäden binden und die Koppelung von Reparaturproteinen vermitteln. Durch die Inhibition kann daher keine Reparatur stattfinden und es treten vermehrt Doppelstrangbrüche auf. Durch Mechanismen der homologen rekombinanten Reparatur (HRR) werden diese im Normalfall ausgeglichen. Liegen allerdings Defekte in Genen der homologen rekombinanten Reparatur vor, wie zum Beispiel BRCA-Mutationen, kann die DNA nicht repariert werden und es kommt konsekutiv zum Zelltod.
Die Rationale für die Kombination von ARPI und PARPi basiert auf der gezielten Ausnutzung der Wechselwirkungen zwischen Androgenrezeptorsignalwegen und DNA-Reparaturmechanismen. Präklinische Studien belegen, dass die Unterdrückung des Androgenrezeptors (AR) mit einer Hochregulierung der PARP-Aktivität einhergeht, da Androgenentzug die Abhängigkeit der Krebszelle von PARP-vermittelten Reparaturmechanismen verstärkt. PARP selbst verstärkt die AR-Aktivität, indem es über Chromatinmodifikation an AR-Bindungsstellen die Transkription AR-abhängiger Gene fördert. Durch die gezielte Blockade dieses Mechanismus könnten PARPi die Resistenz gegen ARPI abschwächen, was die Rationale für kombinierte Therapieansätze in der Behandlung fortgeschrittener Prostatakarzinome unterstreicht.3–4
Kombinationstherapie ARPi plus PARPi
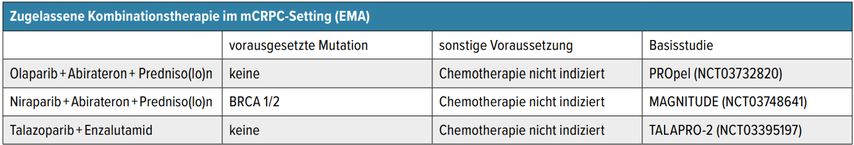
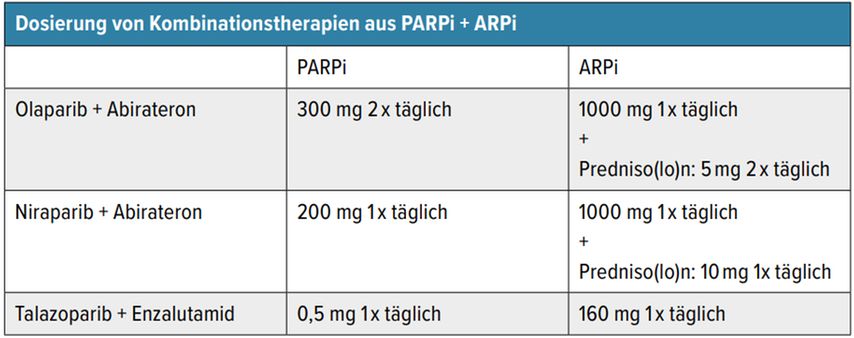
Zum jetzigen Zeitpunkt sind drei Kombinationstherapien in Europa zugelassen (Tab.1 und 2).
Tab. 1: Aktuell zugelassene Poly(Adenosin-Diphosphat-Ribose)-Inhibitoren(PARPi)- und Androgenrezeptor-Signalweg-Inhibitoren(ARPi)-Kombinationen in Europa
Tab. 2: Dosierung von Kombinationstherapien aus PARPi(Poly[ADP-Ribose]-Polymerase-Inhibitoren) und ARPi (Inhibitoren des Androgenrezeptorsignalweges) beim mCRPC (metastasiertes kastrationsrefraktäres Prostatakarzinom)
Olaparib plus Abirateron
In Europa wurde 2022 die Kombination aus Olaparib und Abirateron plus Prednison oder Prednisolon für die Behandlung von erwachsenen Männern im metastasierten kastrationsrefraktären Setting zugelassen, bei denen eine Chemotherapie klinisch nicht indiziert ist. Die Basis für die Zulassung ist die randomisierte Phase-III-Studie PROpel.
In dieser Studie wurden 796 Männer entweder mit Olaparib kombiniert mit Abirateron plus Prednison oder Abirateron plus Prednisolon behandelt. Erlaubte Vortherapie war Docetaxel bei metastasiertem hormonsensitivem Prostatakarzinom. Erst nach der Randomisierung erfolgte die Testung des Tumorgewebes und der Blutproben, um den HRR-Status zu bestimmen. Der primäre Endpunkt war das vom Prüfarzt beurteilte radiologische progressionsfreie Überleben (rPFS), welches in der HRR-unselektierten Population in der Olaparib+Abirateron-Gruppe 24,8 Monate und in der Abirateron + Placebo-Gruppe 16,6 Monate betrug: Hazard-Ratio (HR) 0,66; 95%-Konfidenzintervall (CI) 0,54–0,81; p<0,0001. Das mediane Gesamtüberleben (OS) war mit 42,1 Monaten bei mit Olaparip plus Abirateron behandelten Patienten im Vergleich zu 34,7 Monaten in der Kontrollgruppe nicht signifikant verlängert (HR 0,81; p=0,054). Den stärksten Benefit in der Subgruppenanalyse zeigten Patienten mit einer BRCA1/2-Mutation mit einer HR von 0,2 für rPFS und einer HR von 0,29 für OS.5
Niraparib plus Abirateron
Im Jahr 2023 erfolgte die Zulassung der Kombinationstherapie Niraparib plus Abirateron mit Prednison oder Prednisolon (AAP) bei Männern mit mCRPC, bei denen eine Chemotherapie klinisch nicht indiziert ist und eine Mutation im BRCA1- oder BRCA2-Gen vorliegt. In der zur Zulassung führenden Studie MAGNITUDE wurden 423 Patienten mit einer HRR-Mutation und 247 Patienten ohne nachgewiesene Mutation eingeschlossen. Nach einer ersten Zwischenanalyse der HRR-negativen Gruppe zeigte sich kein Vorteil. Die Hauptanalysen und die Zulassungsrelevanz der Studie beziehen sich daher auf die HRR-mutierte Population. Das mediane rPFS war in der Subgruppe mit nachgewiesener BRCA1- oder BRCA2-Mutation signifikant länger in der Interventionsgruppe verglichen mit denjenigen, die mit AAP und Placebo behandelt wurden (16,6 vs. 10,9 Monate, HR: 0,53). Auch bei Patienten mit mindestens einer HRR-Mutation zeigt sich in der zentralen Auswertung das rPFS signifikant länger als im Interventionsarm (16,5 vs. 13,7 Monate, HR: 0,73).
Die finale Analyse, bei einer medianen Nachbeobachtungszeit von 37,3 Monaten, zeigte keinen signifikanten Unterschied im OS zwischen Niraparib + AAP und Placebo + AAP in der HRR-mutierten Population (HR: 0,931; 95% CI: 0,720–1,203; p=0,585) oder in der Subgruppe mit BRCA1/2-Veränderungen (HR: 0,788, 95% CI: 0,554–1,120; p=0,183). Vorgegebene multivariate Analysen, die für prognostische Ausgangsfaktoren adjustiert wurden, zeigten einen Trend zu einem längeren OS mit Niraparib + AAP gegenüber Placebo + AAP in der HRR-positiven Population (HR: 0,785, 95% CI: 0,606–1,016; nominales p=0,066) und in der BRCA1/2-Subgruppe (HR: 0,663, 95% CI: 0,464–0,947; nominales p=0,024).6
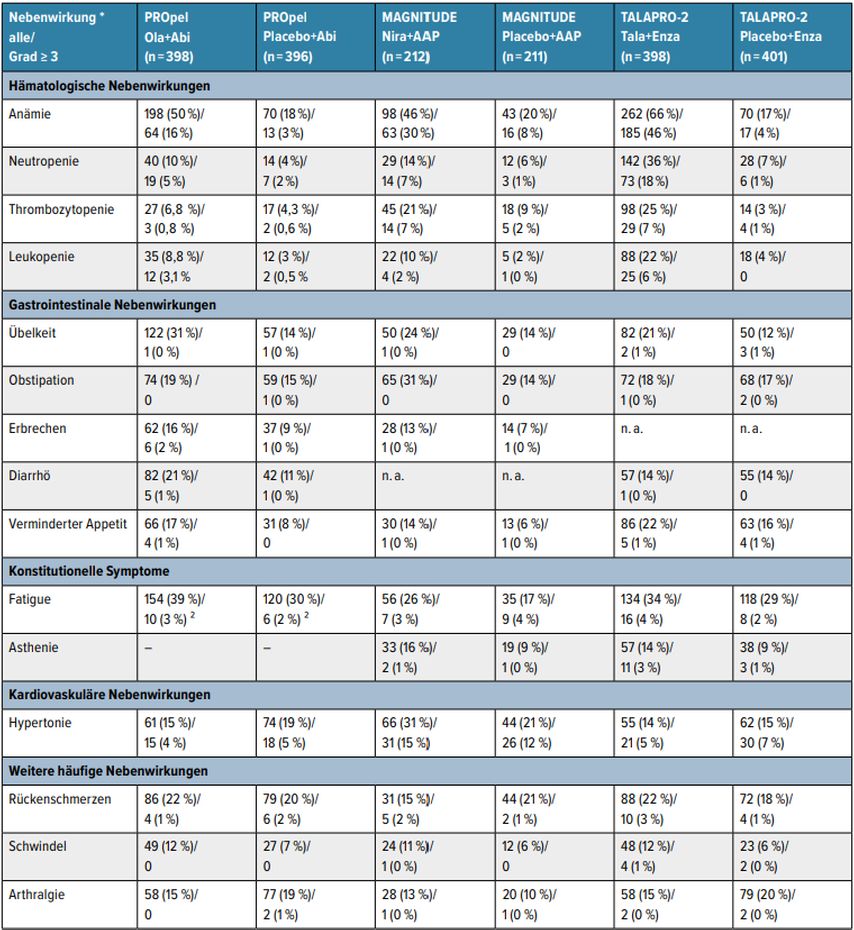
Tab. 3: Erweiterte Nebenwirkungstabelle aus Phase-III-Studien für Inhibitoren der Poly(ADP-Ribose)-Polymerasen (PARPi) und des Androgenrezeptor-Signalweges (ARPi) für die Therapie des metastasierten kastrationsrefraktären Prostatakarzinoms* alle Nebenwirkungen/Grad ≥ 3, ² Fatigue und Asthenie in Studie in Kombination angegeben, Abkürzungen: Ola = Olaparib, Abi = Abirateron, Nira = Niraparib, AAP = Abirateronacetat + Prednison, Tala = Talazoparib, Enza = Enzalutamid, n.a. = nicht angegeben
Talazoparib plus Enzalutamid
Die Kombination aus Talazoparib und Enzalutamid wurde in der Europäischen Union im Jahr 2024 für die Behandlung erwachsener Patienten mit mCRPC, bei denen eine Chemotherapie klinisch nicht indiziert ist, zugelassen. Die Zulassung gilt unabhängig vom HRR-Mutationsstatus und basiert auf den Ergebnissen der Phase-III-Studie TALAPRO-2. In der Gesamtpopulation wurde das mediane rPFS durch die Kombination signifikant verlängert (HR 0,63; 95% CI: 0,51–0,78; p<0,0001). Die Hazard-Ratio für das Gesamtüberleben unter Talazoparib + Enzalutamid im Vergleich zu Placebo + Enzalutamid betrug 0,796 (95% CI: 0,661–0,958; zweiseitiges p=0,0155). Das mediane Gesamtüberleben lag bei 45,8 Monaten (95% CI: 39,4–50,8) versus 37,0 Monate (95% CI: 34,1–40,4 Monate).7
Kombinationstherapien bei genetisch unselektierten mCRPC-Patienten
Erste Hinweise auf die Wirksamkeit von PARPi in Kombination mit Androgenrezeptor-Inhibitoren (ARPi) bei genetisch unselektierten Patienten mit mCRPC lieferte die Phase-II-Studie von Clark N et al.8 Hier zeigte die Kombination aus Olaparib und Abirateron im Vergleich zu Placebo + Abirateron einen signifikanten Vorteil im radiologischen progressionsfreien Überleben (rPFS: 13,8 vs. 8,2 Monate; HR 0,65; p=0,034) unabhängig vom HRR-Mutationsstatus. Diese präklinische Hypothese wurde in zwei nachfolgenden Phase-III-Studien weiter validiert. In der oben bereits erwähnten PROpel-Studie betrug das mediane rPFS 24,8 vs. 16,6 Monate (HR: 0,66; p<0,0001) in der „Intention to treat“-Population, mit konsistentem Benefit in allen Subgruppen (HRR-mutiert HR: 0,50; HRR-Wildtyp HR: 0,76).
In der bereits erwähnten TALAPRO-2-Studie konnte eine HR von 0,70 (95% CI: 0,54–0,89; p=0,0039) für Patienten ohne HRR-Mutation oder mit unbekanntem Mutationsstatus gezeigt werden. Hinsichtlich des OS erreichte der Interventionsarm in der PROpel-Studie formal keine OS-Signifikanz (HR 0,81; p=0,0544), wies aber einen klinisch relevanten Trend zugunsten der Kombination auf (19% Reduktion des Sterberisikos). In der TALAPRO-2 Studie konnte ein Überlebensvorteil zugunsten von Talazoparib + Enzalutamid im Vergleich zu Placebo + Enzalutamid bei Patienten ohne BRCA1/2-Veränderungen (n=439; HR: 0,749; 95% CI: 0,582–0,963) sowie bei Patienten ohne HRR-Veränderungen (n=314; HR: 0,782; 95% CI: 0,582–1,050; p=0,101) gezeigt werden.5,7
Die Daten unterstreichen, dass PARPi/ARPi-Kombinationen auch bei genetisch unselektierten mCRPC-Patienten wirksam sind, insbesondere im Hinblick auf das rPFS.
Nebenwirkungen der Kombinationstherapie
Olaparib + Abirateron (PROpel-Studie)
Basierend auf den veröffentlichten Daten der PROpel-Studie waren die häufigsten Nebenwirkungen aller Grade hämatologische Ereignisse, insbesondere Anämie, die bei 50% der Patienten auftrat. Zudem traten häufiger Fatigue (39% vs. 30%), Übelkeit (31% vs. 14%) und Diarrhö (21% vs. 11%) auf, wobei die Grad-3–4-Ereignisse deutlich seltener waren (Anämie 16% vs. 3%, Fatigue 3% vs. 2%). Das Risiko für venöse Thromboembolien war erhöht, mit einer Inzidenz von 9% vs. 4%. Die Rate an Abbrüchen der Therapie mit Olaparib oder Placebo aufgrund von Nebenwirkungen lag bei 17% vs. 9%. Die Rate der Abbrüche der Abiraterontherapie lag bei 11% vs. 9%.5
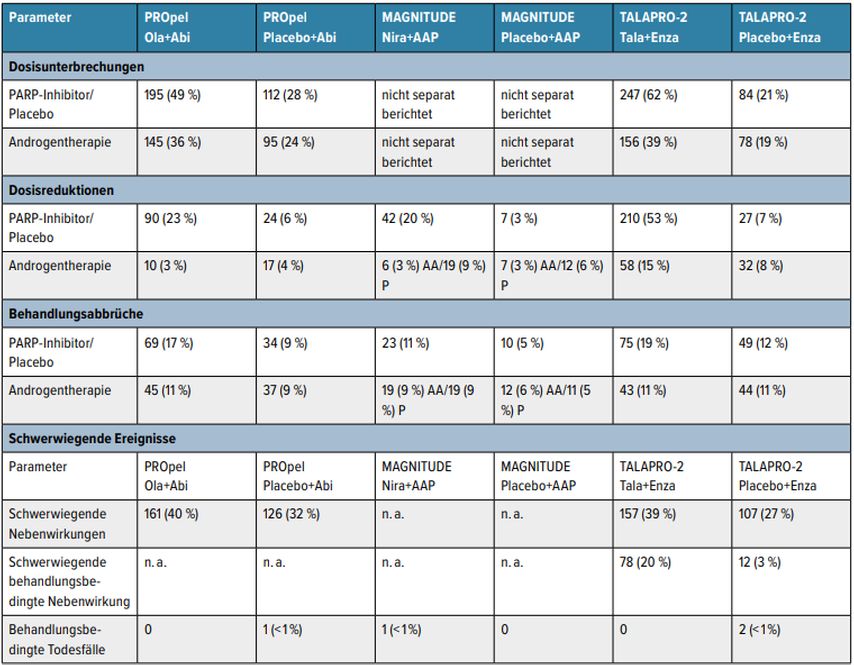
Tab. 4: Dosismanagement, Behandlungsabbrüche, schwerwiegende Ereignisse in den Phase-III-Studien für Inhibitoren der Poly(ADP-Ribose)-Polymerasen (PARPi) und des Androgenrezeptor-Signalweges (ARPi) für die Therapie des metastasierten kastrationsresistenten Prostatakarzinoms. Abkürzungen: Ola = Olaparib, Abi = Abirateron, Nira = Niraparib, AAP = Abirateronacetat + Prednison, AA= Abirateronacetat, P = Prednison, Tala = Talazoparib, Enza = Enzalutamid, n.a. = nicht angegeben
Niraparib + Abirateron (MAGNITUDE-Studie)
Das Sicherheitsprofil der MAGNITUDE-Studie war ebenfalls durch hämatologische Toxizität charakterisiert. Die häufigsten Nebenwirkungen aller Grade waren Anämie (52,4% vs. 22,7%), Hypertonie (34% vs. 23,2%) und Thrombozytopenie (24,1% vs. 9,5%). Schwerwiegende Grad-3–4-Ereignisse umfassten Anämie (30,7% vs. 22,7%), Hypertonie (16,5% vs. 12,8%) und Thrombozytopenie (8,5% vs. 2,4%). Die Therapieabbruchrate lag bei 18,4% im Interventionsarm vs. 6,6% im Kontrollarm.6
Talazoparib + Enzalutamid (TALAPRO-2-Studie)
Die TALAPRO-2-Studie dokumentierte die ausgeprägteste hämatologische Toxizität aller PARPi/ARPi-Kombinationen. Die häufigsten Nebenwirkungen aller Grade waren Anämie (66% vs. 17%), Neutropenie (36% vs. 7%) und Fatigue (34% vs. 29%), wobei Nebenwirkungen von mehr als Grad 3 bei Anämie (46% vs. 17%), Neutropenie (18% vs. 1%), Fatigue (4% vs. 2%) und Thrombozytopenie (7% vs. 1%) auftraten. Die Therapieabbruchsrate ebetrug 19% unter Talazoparib (vs. 12% in der Placebogruppe) und 11% unter Enzalutamid vs. 11% unter Placebo.7
Insgesamt zeigte sich eine handhabbare Toxizität, die jedoch eine sorgfältige Überwachung erfordert. Die Daten deuten darauf hin, dass hämatologische Toxizität die limitierende Nebenwirkung darstellt, sie kann durch regelmäßige Blutbildkontrollen, Dosisanpassungen und supportive Maßnahmen gemanagt werden. Die in den Publikationen dokumentierten Nebenwirkungen sind typisch für PARP-Inhibitoren in Kombination mit einer Hormontherapie und unterstreichen die Bedeutung eines individualisierten Nebenwirkungsmanagements, um Therapietreue und Lebensqualität der Patienten zu sichern.5–9
Fazit zur Kombinationstherapie aus PARPi und ARPi
Die Kombinationstherapie aus PARPi und ARPi stellt beim metastasierten kastrationsrefraktären Prostatakarzinom eine wichtige Therapieoption dar. Anzumerken ist allerdings, dass in den Zulassungsstudien für die Kombinationstherapie zum Großteil Patienten eingeschlossen waren, die zuvor keine Therapie mit einem ARPi erhalten hatten oder bei denen die Anwendung längere Zeit zurückliegt, was nicht mehr den aktuellen Therapieempfehlungen entspricht, da eine Therapie aus ADT mit einem ARPi bereits im metastasierten hormonsensitiven Setting heutiger Standard ist.10 Hinsichtlich genetisch nicht selektionierter Gruppen war in den Studien zwar ein radiologisch progressionsfreier Überlebensvorteil ersichtlich, allerdings scheint dieser nicht mit einem Gesamtüberlebensvorteil einherzugehen. Diese Diskrepanz wirft die wichtige Frage auf, ob Kombinationstherapien unabhängig vom HRR-Mutationsstatus eingesetzt werden sollten. Auch unter Berücksichtigung der nicht unerheblichen Nebenwirkungen sollte es zum Einsatz vor allem bei Patienten mit einer HRR-Mutation kommen.
Literatur:
1 Statistik Austria 2025: Krebserkrankungen in Österreich 2025 – Ergebnisse im Überblick. www.statistik.at/fileadmin/publications/Krebserkrankungen-in-Oesterreich-2025_barrierefrei.pdf 2 Hommerding M et al.: Real-world data on the prevalence of BRCA1/2 and HRR gene mutations in patients with primary and metastatic castration resistant prostate cancer. World J Urol 2024; 42(1): 491 3 Asim M et al.: Synthetic lethality between androgen receptor signalling and the PARP pathway in prostate cancer. Nature Commun 2017; 8(1): 374 4 Cerrato A et al.: Use of poly ADP-ribose polymerase [PARP] inhibitors in cancer cells bearing DDR defects: The rationale for their inclusion in the clinic. J Exp Clin Cancer Res 2016; 35(1): 179 5 Saad F et al.: Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): Final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2023; 24(10): 1094-108 6Chi KN et al.: Niraparib and abiraterone acetate plus prednisone in metastatic castration-resistant prostate cancer: Final overall survival analysis for the phase 3 MAGNITUDE trial. Eur Urol Oncol 2025; S2588-9311(25)00107-5 7 Agarwal N et al.: Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): A randomised, placebo-controlled, phase 3 trial. Lancet 2023; 402(10398): 291-303 8 Clarke N et al.: Olaparib combined with abiraterone in patients with metastatic castration-resistant prostate cancer: A randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol 2018; 9(7): 975-86 9 LaFargue CJet al.: Exploring and comparing adverse events between PARP inhibitors. Lancet Oncol 2019; 20(1): e15-e28
Das könnte Sie auch interessieren:
ADT + ARPI beim metachronen, oligometastasierten Prostatakarzinom
Das metachrone, oligometastasierte Prostatakarzinom stellt eine klinisch besonders relevante Patientengruppe dar, die von einer frühen systemischen Therapiekombination aus ADT plus ...
Ausbildung: Die nächste Generation kommt
Im Rahmen der Session „Die nächste Generation“ wurde gemeinsam mit anderen spannenden Themen auch das Erlernen der Roboterchirurgie im Rahmen der Ausbildung dargestellt. Mehrere ...
Aktuelles und Zukunftsaussichten zur 177Lutetium-PSMA-Radioligandentherapie
177Lutetium-PSMA (177Lu-PSMA) ist eine zielgerichtete Therapieoption zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC). Die Therapie wirkt gezielt über ...