Aktuelles und Zukunftsaussichten zur 177Lutetium-PSMA-Radioligandentherapie
Autorin:
Ap. Prof. Priv.-Doz. Dr. Sazan Rasul, PhD
Universitätsklinik für Radiologie und Nuklearmedizin
Abteilung für Nuklearmedizin
Medizinische Universität Wien
E-Mail: sazan.rasul@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
177Lutetium-PSMA (177Lu-PSMA) ist eine zielgerichtete Therapieoption zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC). Die Therapie wirkt gezielt über prostataspezifische Membranantigen-Rezeptoren (PSMA-Rezeptoren) und ermöglicht durch geringe systemische Toxizität eine Schonung gesunden Gewebes mit positiver Auswirkung auf die Lebensqualität der Patienten. Der Theranostikansatz mit PSMA-PET/CT ermöglicht eine individuelle Patientenauswahl für eine passgenaue Behandlung.
Keypoints
-
Die 177Lu-PSMA-617 Radioligandentherapie ist für die Behandlung des mCRPC zugelassen und in den aktuellen Leitlinien empfohlen.
-
Sie hat eine signifikante anti-tumorale Wirksamkeit, führt häufig zu einer deutlichen Reduktion des PSA-Werts und bietet eine klinisch relevante Schmerzlinderung sowie den Erhalt der Lebensqualität.
-
Ihr Einsatz scheint auch in früheren Krankheitsstadien vor dem Auftreten einer Kastrationsresistenz vielversprechend.
Die Zahl der Krebsneuerkrankungen in Österreich steigt kontinuierlich. Im Jahr 2023 wurden 46518 neue Fälle registriert, was einem Anstieg von 15,6% im Vergleich zu 2013 entspricht. Mit 7485 Neuerkrankungen war das Prostatakarzinom weiterhin die häufigste Tumorerkrankung bei Männern, es stellt eine erhebliche Herausforderung für das Gesundheitssystem dar.
Tatsächlich hängt die 5-Jahres-Überlebensrate beim Prostatakarzinom wesentlich vom Tumorstadium bei der Diagnosestellung ab. Eine frühzeitige Diagnose und eine exakte, stadiengerechte Diagnostik (Staging) sind daher entscheidend. Dennoch kommt es bei bis zu 50% der Patienten nach Primärtherapie innerhalb von fünf Jahren zu einem biochemischen Rezidiv. In diesen Fällen ist die Androgendeprivationstherapie (ADT) Standardtherapie, sie führt jedoch bei den meisten Patienten innerhalb von etwa drei Jahren zur Entwicklung einer Kastrationsresistenz. Trotz zahlreicher verfügbarer systemischer Therapien liegt das mediane Überleben bei metastasiertem kastrationsresistentem Prostatakarzinom (mCRPC) weiterhin bei nur rund 2,5 Jahren.
Die Radioligandentherapie mit 177Lu-PSMA stellt einen vielversprechenden zielgerichteten Therapieansatz für Patienten mit mCRPC dar. Grundlage dieser Behandlung ist die spezifische Bindung des Radioliganden an das prostataspezifische Membranantigen (PSMA), das auf Prostatatumorzellen in hoher Dichte exprimiert wird. Nach Bindung an den PSMA-Rezeptor wird das Radiopharmakon in die Tumorzelle aufgenommen, wo es eine Betastrahlung freisetzt. Diese bewirkt eine gezielte Schädigung und Zerstörung der malignen Zellen unter weitgehender Schonung des umliegenden Gewebes.
Seit März 2022 ist 177Lu-PSMA-617 (Pluvicto®) von der US-amerikanischen Food and Drug Administration (FDA) und seit Dezember 2022 von der European Medicines Agency (EMA) für die Behandlung erwachsener Patienten mit PSMA-positivem mCRPC zugelassen, die zuvor mit Androgenrezeptor-Pathway-Inhibitoren (ARPI) und einer taxanbasierten Chemotherapie behandelt wurden. Diese Zulassung basiert auf den Ergebnissen des VISION-Trials,1 einer prospektiven, multizentrischen, randomisierten Phase-III-Studie, die mehr als 800 Patienten mit mCRPC einschloss. Die Interventionsgruppe erhielt die PSMA-Radioligandentherapie in Kombination mit der Standardtherapie („standard of care“, SOC), während die Kontrollgruppe ausschließlich die Standardtherapie erhielt. Die Studie zeigte eine signifikante Reduktion des Sterberisikos um 38% sowie eine 60% geringere Wahrscheinlichkeit für radiografisches progressionsfreies Überleben (rPFS) oder Tod in der Behandlungsgruppe im Vergleich zur Kontrollgruppe. Darüber hinaus betrug das mediane Gesamtüberleben (OS) in der Interventionsgruppe 15,3 Monate gegenüber 11,3 Monaten in der Kontrollgruppe.
Die derzeit empfohlene Therapiedosis beträgt 7,4 GBq 177Lu-PSMA-617 intravenös alle sechs Wochen, jeweils bis zu sechs Zyklen. Laut den Leitlinien der European Association of Urology (EAU) kommt diese Therapie bei Patienten mit mindestens einer metastatischen Läsion und vorheriger Behandlung mit mindestens einem ARPI sowie ein bis zwei Taxanen infrage. Voraussetzung ist eine hohe PSMA-Expression der Tumorläsionen, die sich durch eine stärkere Radiotracer-Aufnahme im PSMA-PET/CT gegenüber der Leber manifestiert.
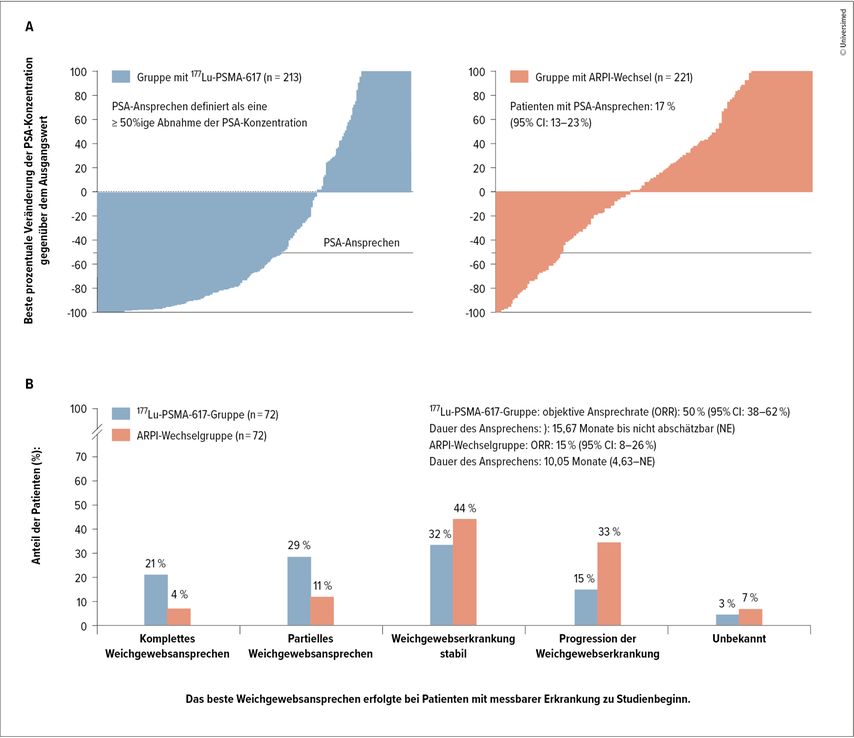
Im September 2024 wurden auch die Ergebnisse der internationalen PSMAfore-Studie (in 74 Zentren in Europa und Nordamerika) veröffentlicht.2 Untersucht wurden 468 Taxan-naive, PSMA-positive mCRPC-Patienten mit Progress unter ARPI. Die Patienten erhielten entweder 177Lu-PSMA-617 (7,4GBq alle 6 Wochen, 6 Zyklen) oder einen ARPI-Wechsel (Abirateron oder Enzalutamid). 177Lu-PSMA-617 verlängerte das rPFS signifikant (9,3 vs. 5,5 Monate) und war besser verträglich (Nebenwirkungen Grad 3–5: 36% vs. 48%; Abb. 1). Daraufhin erweiterte die FDA am 28. März 2025 die Indikation für Pluvicto® auf PSMA-positive mCRPC-Patienten unter ARPI-Therapie, die für eine verzögerte Taxan-Chemotherapie geeignet sind. Weitere Informationen dazu finden Sie auf der FDA-Website – PSMAfore Approval.
Abb. 1: In der PSMAfore-Studie führte eine Therapie mit 177Lu-PSMA-617 zu einer höheren PSA-Ansprechrate (51 % vs. 17 %) und verlängerte das radiologische progressionsfreie Überleben (9,3 Monate vs. 5,5 Monate) im Vergleich zu einem Wechsel des Androgenrezeptor-Pathway-Inhibitors. PSA-Ansprechen wurde definiert als eine ≥ 50%ige Abnahme der PSA-Konzentration (übersetzt, sonst unverändert übernommen aus Morris MJ et al. 2024)2
Prädiktoren und Patientenselektion für die 177Lu-PSMA-617-Therapie
Mehrere Studien identifizieren Prädiktoren für das Ansprechen und Überleben unter 177Lu-PSMA-617 bei mCRPC, darunter waren: Krankheitsdauer, vorherige Chemotherapie, basale Hämoglobinkonzentration, Ausmaß des ossären Befalls, Vorliegen von Lebermetastasen, Anzahl und PSMA-Expression der metastatischen Läsionen sowie der mittlere SUV-Wert der Tumorherde in der PSMA-PET-Untersuchung. Laut der European Association of Nuclear Medicine (EANM) sollten Patienten mit Läsionen ≥1cm, aber geringer PSMA-Aufnahme (<0,5-fache Menge als bei der Speicheldrüse bzw. <1,0-fache Menge als bei der Leber) von der Therapie ausgeschlossen werden. Bei PSMA-negativen Tumoren sollte differenzialdiagnostisch auch an eine neuroendokrine Entdifferenzierung gedacht werden, die mit einer aggressiveren Tumorbiologie und Therapieresistenz einhergeht. Zur Verbesserung der Selektion kann eine kombinierte molekulare Bildgebung mittels 18F-FDG-PET-Untersuchung hilfreich sein. Diskordante Befunde (FDG-positive/PSMA-negative Läsionen) finden sich bei bis zu 30% der mCRPC-Patienten, sind mit einem ungünstigeren Verlauf assoziiert (medianes OS 11,0 vs. 19,1 Monate im TheraP-Trial) und sprechen nicht auf eine PSMA-Therapie an.3
Kombinationstherapien mit 177Lu-PSMA: Studienlage und Ausblick
Neben dem Einsatz bei vorbehandelten mCRPC-Patienten zeigt 177Lu-PSMA-617 auch in Kombination mit bestehenden systemischen Therapien und in früheren Krankheitsstadien vielversprechendes Potenzial. Aktuell laufen weltweit zahlreiche prospektive Phase-I- und Phase-II-Studien, die den Stellenwert dieser Therapieform im Gesamtkonzept der Prostatakarzinombehandlung weiter definieren sollen.
So untersucht die Phase-III-Studie PSMAddition (NCT04720157) den Zusatz von 177Lu-PSMA-617 zu ADT und einem ARPI bei Patienten mit metastasiertem hormonsensitivem Prostatakarzinom (mHSPC). Die Ergebnisse könnten die Erstlinientherapie in diesem Setting nachhaltig verändern.
Ähnliches gilt für die UpFront-Studie bei Patienten mit de novo hochvolumigem mHSPC, bei der 177Lu-PSMA-617 vor Docetaxel verabreicht wurde. In der Kombinationsgruppe erreichten 41% der Patienten nach 48 Wochen ein nicht nachweisbares PSA, gegenüber nur 16% unter Docetaxel-Monotherapie bei vergleichbarer Rate schwerer Nebenwirkungen (25%).
Auch im mCRPC-Stadium wird der Nutzen der Kombinationstherapie weiter erforscht: Die Phase-II-Studie ENZA-p (NCT04419402) zeigte ein signifikant verlängertes PSA-PFS (13,0 vs. 7,8 Monate) durch den Zusatz von 177Lu-PSMA-617 zu Enzalutamid®.4
Weitere Studien evaluieren Kombinationen mit Cabazitaxel (LuCAB, NCT 05340374), PARP-Inhibitoren wie Olaparib (LuPARP, NCT03874884), Immuncheckpoint-Inhibitoren (EVOLUTION, NCT 05150236) oder die Kombination mit Radium-223 (AlphaBet, NCT05383079).
Trotz dieser Fortschritte bleiben zentrale Fragen offen. Insbesondere die optimale Patientenselektion ist noch nicht abschließend geklärt. Die prospektive Validierung klinischer Parameter und bildgebender Biomarker, wie etwa PSMA- und FDG-PET-Befunde, ist entscheidend, um die Wirksamkeit und Sicherheit der Therapie gezielt zu steigern. Auch die Positionierung von 177Lu-PSMA-617 innerhalb bestehender Behandlungsalgorithmen, insbesondere im Hinblick auf Kombinationen mit ARPI, Chemotherapie oder Immuntherapie, erfordert weitere klinische Daten.
Insgesamt steht die individualisierte Radioligandentherapie beim Prostatakarzinom noch am Anfang. Die bisherigen Ergebnisse belegen jedoch ein großes therapeutisches Potenzial, das durch gezielte Forschung in den kommenden Jahren weiter ausgeschöpft werden kann.
Literatur:
1 Sartor O et al.: Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385(12): 1091-103 2 Morris MJ et al.: (177)Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxane-naive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. Lancet 2024; 404(10459): 1227-39 3 Hofman MS et al.: Overall survival with [(177)Lu]Lu-PSMA-617 versus cabazitaxel in metastatic castration-resistant prostate cancer (TheraP): secondary outcomes of a randomised, open-label, phase 2 trial. Lancet Oncol 2024; 25(1): 99-107 4 Emmett L et al.: [(177)Lu]Lu-PSMA-617 plus enzalutamide in patients with metastatic castration-resistant prostate cancer (ENZA-p): an open-label, multicentre, randomised, phase 2 trial. Lancet Oncol 2024; 25(5): 563-71
Das könnte Sie auch interessieren:
Karzinom des oberen Harntrakts: Laserablation, Chemoablation, Operation und neue Entwicklungen
Im Rahmen der ÖBAY-Tagung 2025 sprachen wir mit Prof. Dr. Nirmish Singla, Associate Professor of Urology & Oncology und Director of Translational Research in GU Oncology an der Johns ...
ADT + ARPI beim metachronen, oligometastasierten Prostatakarzinom
Das metachrone, oligometastasierte Prostatakarzinom stellt eine klinisch besonders relevante Patientengruppe dar, die von einer frühen systemischen Therapiekombination aus ADT plus ...
Ausbildung: Die nächste Generation kommt
Im Rahmen der Session „Die nächste Generation“ wurde gemeinsam mit anderen spannenden Themen auch das Erlernen der Roboterchirurgie im Rahmen der Ausbildung dargestellt. Mehrere ...