ADT + ARPI beim metachronen, oligometastasierten Prostatakarzinom
Autoren:
Dr. Felix Melchior
Dr. Michael Ladurner, FEBU
Universitätsklinik für Urologie und Andrologie
Medizinische Universität Innsbruck
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das metachrone, oligometastasierte Prostatakarzinom stellt eine klinisch besonders relevante Patientengruppe dar, die von einer frühen systemischen Therapiekombination aus ADT plus Androgenrezeptor-Pathway-Inhibitoren (ARPIs) erheblich profitiert. Aktuelle Phase-III-Studiendaten belegen sowohl für das progressionsfreie als auch das Gesamtüberleben signifikante Verbesserungen bei gleichzeitig guter Verträglichkeit dieser Kombinationstherapien.
Keypoints
-
Metachrone, oligometastasierte Prostatakarzinompatienten zeigen das längste Langzeitüberleben unter ADT plus ARPI-Kombinationen.
-
Alle verfügbaren ARPIs (Apalutamid, Darolutamid, Enzalutamid; in alphabetischer Reihenfolge) zeigen in Phase-III-Studien in Kombination mit ADT signifikante Verlängerungen des radiologisch progressionsfreien Überlebens beim mHSPC.
-
Die Kombinationstherapien sind für Patienten gut verträglich und sie erhalten die Lebensqualität.
Das metachrone, oligometastasierte mHSPC
Während die Mehrheit der Prostatakarzinome lokal begrenzt bleibt, entwickeln etwa 20% der Patienten einen metastasierenden Verlauf. Dabei zeigt sich ein wichtiger prognostischer Unterschied zwischen synchron (de novo) und metachron metastasierten Tumoren: Bei synchroner Metastasierung ist der Übergang zur Kastrationsresistenz deutlich kürzer als bei metachroner Metastasierung, wodurch sich das mediane Überleben bei synchroner Metastasierung nahezu halbiert.1 Diese epidemiologischen Daten unterstreichen die klinische Relevanz einer differenzierten Betrachtung metastasierter Prostatakarzinome. Das metachrone, oligometastasierte hormonsensitive Prostatakarzinom (mHSPC) ist gekennzeichnet durch das Auftreten einer begrenzten Anzahl von Metastasen nach vorheriger lokaler Therapie der Prostata.
Oligometastasierung wird in der aktuellen Literatur häufig als Auftreten von 1–5 metastatischen Läsionen definiert, wobei alle Metastasenlokalisationen einer sicheren Behandlung zugänglich sein müssen.2 Bei singulärer Metastasierung kann alternativ eine metastasengerichtete Therapie (engl. „metastasis-directed therapy“, MDT) mittels stereotaktischer Bestrahlung oder chirurgischer Resektion erwogen werden, womit vielversprechende Ergebnisse erzielt werden können. Vor einer MDT muss jedenfalls ein Staging mittels PSMA-PET-CT (inkl. eines diagnostischen CT) durchgeführt werden.
Die CHAARTED-Studie etablierte eine prognostisch relevante Klassifikation der Tumorlast. „High volume“-Erkrankungen sind definiert als das Vorliegen von viszeralen Metastasen und/oder ≥ 4 Knochenläsionen, von denen mindestens eine außerhalb der Wirbelsäule oder des Beckens lokalisiert ist. Alle anderen Situationen werden als „low volume“ klassifiziert.
Die Langzeitdaten der CHAARTED-Studie demonstrieren, dass Patienten mit metachronem „Low volume“-mHSPC mit median 8 Jahren das längste Langzeitüberleben aller Subgruppen aufweisen. Die beiden günstigen Prognosefaktoren – metachrone Metastasierung und geringe Tumorlast – machen diese Patientengruppe zu idealen Kandidaten für eine systemische Kombinationstherapie, da hier sowohl die relativen als auch die absoluten Überlebensgewinne am größten sind.3 Zu berücksichtigen ist, dass das in CHAARTED untersuchte Therapieregime (ADT + Docetaxel) obsolet ist, da in den Studien der Tripletherapien ARASENS und PEACE-1 die Kombination ADT + Docetaxel jeweils der Tripletherapie mit ADT + Docetaxel + ARPI unterlegen war. Dennoch sind die beobachteten Zusammenhänge nach aktuellem Kenntnisstand vermutlich auch auf neue Kombinationstherapien übertragbar.4
Phase-III-Daten für ADT plus ARPI
Primärer Endpunkt: radiologisch progressionsfreies Überleben
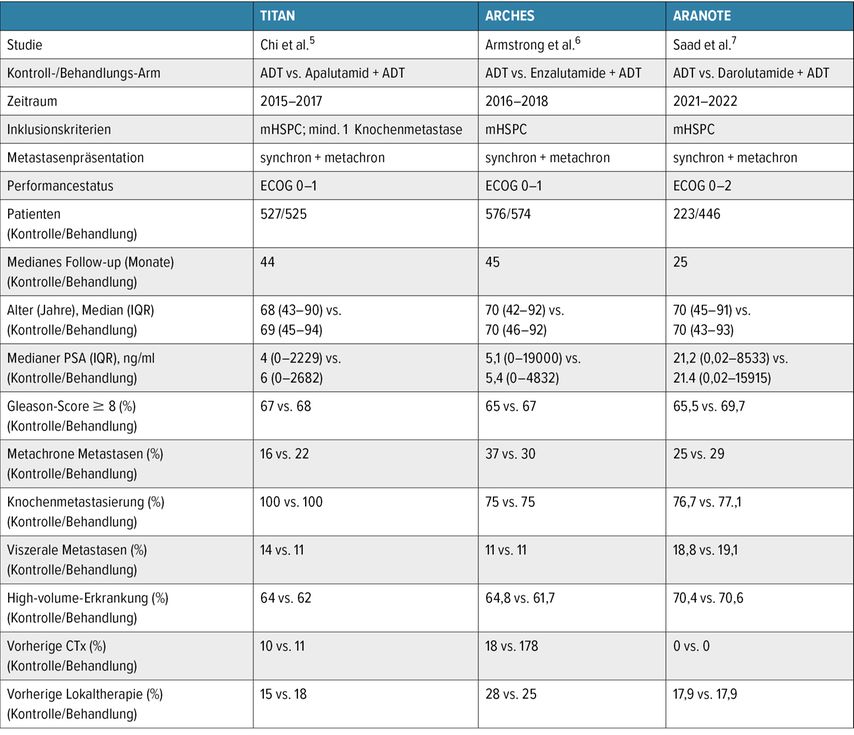
Die drei verfügbaren ARPIs – Apalutamid (TITAN, 2019),5 Enzalutamid (ARCHES, 2019)6 und Darolutamid (ARANOTE, 2024)7– zeigen alle signifikante Verlängerungen des radiologisch progressionsfreien Überlebens (rPFS) bei Patienten mit mHSPC. Die Kombination von ADT + Darolutamid wurde für diese Indikation auf Basis der ARANOTE Daten im Juli 2025 von der europäischen Arzneimittelagentur (EMA) zugelassen.
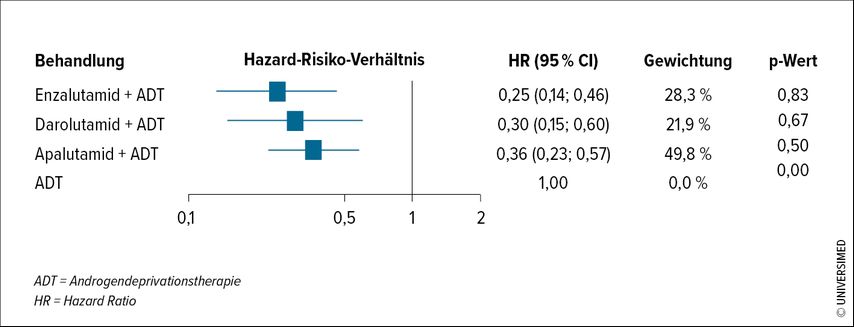
In der TITAN-Studie mit Apalutamid zeigte sich für Patienten mit „Low volume“-mHSPC eine ausgeprägte Verbesserung des rPFS von 64% (HR: 0,36; 95% CI: 0,22–0,57) und bei der ARCHES-Studie mit Enzalutamid wurde eine Verbesserung von 75% für dieselbe Subgruppe nachgewiesen (HR 0,25; 95% CI: 0,14–0,46). Die jüngst veröffentlichte ARANOTE-Studie mit Darolutamid zeigte ebenfalls eine hochsignifikante Verlängerung des rPFS um 70% (HR: 0,30; 95% CI: 0,15–0,60) in der „Low volume“-Subgruppe. In einer Netzwerk-Metanalyse aller verfügbaren Kombinationstherapien im mHSPC-Setting zeigten diese drei Therapien die besten Ergebnisse im „Low volume“-Setting (Abb.1 und Tab.1).8
Abb. 1: Forest Plots des Zusammenhangs zwischen systemischer Therapie und progressionsfreiem Überleben und ADT als Referenz für Patienten mit metastasiertem hormonsensitivem „Low volume“-Prostatakarzinom in TITAN, ARCHES und ARANOTE (n=2871), stratifiziert nach Krankheitsvolumen gemäß CHAARTED (modifiziert nach Hoeh B et. al. 2024)8
Tab. 1: Zusammenfassung der prospektiven, randomisierten, kontrollierten Studien zur Kombinationstherapie bei Patienten mit metastasiertem hormonsensitivem „Low volume“-Prostatakarzinom (mHSPC) stratifiziert nach Krankheitsvolumen gemäß CHAARTED (modifiziert nach Hoeh B et al.: 2024)8
Sekundärer Endpunkt: Gesamtüberleben
Auch für das Gesamtüberleben (OS) zeigten sich durchwegs positive Ergebnisse. Die finale Analyse der TITAN-Studie berichtete von einer Reduktion des Sterberisikos um 35% für ADT plus Apalutamid (HR 0,52; 95% CI: 0,35–0,79) in der „Low volume“- Subgruppe. Die ARCHES-Studie mit Enzalutamid zeigte eine Reduktion des Sterberisikos um 34% (HR 0,66; 95% CI: 0,43–1,03). Bis jetzt wurden noch keine finalen OS-Daten der ARANOTE-Studie veröffentlicht.
Verträglichkeit und Lebensqualität
Die duale Kombination von ADT plus ARPI zeigt bei Patienten mit mHSPC eine bemerkenswert gute Verträglichkeit mit wenigen schwerwiegenden systemischen Nebenwirkungen. Die häufigsten Nebenwirkungen unter ADT plus ARPI-Therapie umfassen Fatigue, Hypertonie und Hitzewallungen, die jedoch meist mild bis moderat ausgeprägt und gut behandelbar bzw. beherrschbar sind. Behandlungsabbrüche aufgrund von Nebenwirkungen sind selten und liegen unter 10% in den Zulassungsstudien.
Besonders relevant ist die Erhaltung der gesundheitsbezogenen Lebensqualität unter der Kombinationstherapie. In allen großen Studien blieb die Lebensqualität über die Behandlungsdauer stabil, was für die klinische Akzeptanz dieser Therapien von erheblicher Bedeutung ist. Umfassende Metaanalysen zur Lebensqualität im mHSPC-Setting stehen jedoch noch aus und wären für eine vollständige Bewertung wünschenswert. Ein weiterer wichtiger Parameter ist die Zeit bis zur nächsten antineoplastischen Therapie, die unter ADT-plus-ARPI-Kombinationen in allen Studien signifikant verlängert wird. Dies hat sowohl prognostische als auch praktische Relevanz für die Patienten und deren Lebensplanung.
Patientenselektion
Die Therapieentscheidung zwischen systemischer Intensivierung und MDT bei oligometastasierten Patienten sollte individualisiert erfolgen. Während bei singulärer Metastasierung eine MDT erwogen werden kann, besteht bei Oligometastasierung mit bis zu 5 Läsionen eine weitaus bessere Evidenz für eine systemische Therapie mit ADT plus ARPI. Die moderne Bildgebung mittels PSMA-PET/CT ermöglicht ein noch präziseres Staging und kann die Therapieentscheidung unterstützen. Dabei ist zu beachten, dass die etablierten CHAARTED-Kriterien auf einer konventionellen Bildgebung mit CT und Knochenscan basieren. Die Anwendung dieser Kriterien auf PSMA-PET-basierte Staging-Ergebnisse bedarf noch prospektiver Validierung. Zudem ist die PSMA-PET/CT leider noch nicht ubiquitär zeitnah verfügbar.
Zusammenfassung
Die verfügbaren Phase-III-Daten zeigen für die Kombination aus ADT plus ARPI konsistent signifikante Vorteile sowohl im progressionsfreien als auch im Gesamtüberleben bei gleichzeitig guter Verträglichkeit. Patienten mit metachronem „Low volume“-mHSPC zeigen im Vergleich die besten Langzeitprognosen mit einem medianen Gesamtüberleben von über 8 Jahren. Die geringe Rate an schwerwiegenden Nebenwirkungen und die Erhaltung der Lebensqualität machen diese Kombinationen zu einer attraktiven Therapieoption.
Literatur:
1 Francini E et al.: Time of metastatic disease presentation and volume of disease are prognostic for metastatic hormone sensitive prostate cancer (mHSPC). Prostate 2018; 78(12): 889-95 2 Mahjoub S, Heidenreich A: Oligometastatic prostate cancer: definition and the role of local and systemic therapy: a narrative review. Transl Androl Urol 2021; 10(7): 3167-75 3 Abhishek T et al.: Eight-year survival rates by baseline prognostic groups in patients with metastatic hormone-sensitive prostate cancer (mHSPC): An analysis from the ECOG-ACRIN 3805 (CHAARTED) trial. J Clin Oncol 2022; 40(16): doi.org/10.1200/JCO.2022.40.16_suppl.5081 4 Borque-Fernando Á et al.: Beyond the status quo: when disease volume and metastatic timing are not enough to personalize treatment in mHSPC. Future Oncol 2025; 21(8): 991-1003 5 Chi Kim N et al.: Apalutamide in patients with metastatic castration-sensitive prostate cancer: final survival analysis of the randomized, double-blind, phase III TITAN study. J Clin Oncol 2021; 39(20): 2294-303 6 Armstrong AJ et al.: Improved survival with enzalutamide in patients with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2022; 40(15): 1616-22 7 Saad F et al.: Darolutamide in combination with androgen-deprivation therapy in patients with metastatic hormone-sensitive prostate cancer from the phase III ARANOTE trial. J Clin Oncol 2024; 42(36): 4271-81 8 Hoeh B et. al: Triplet or doublet therapy in metastatic hormone-sensitive prostate cancer patients: an updated network meta-analysis including ARANOTE data. Eur Urol Focus 2024; S2405-4569(24)00245-1. Online ahead of print.
Das könnte Sie auch interessieren:
Karzinom des oberen Harntrakts: Laserablation, Chemoablation, Operation und neue Entwicklungen
Im Rahmen der ÖBAY-Tagung 2025 sprachen wir mit Prof. Dr. Nirmish Singla, Associate Professor of Urology & Oncology und Director of Translational Research in GU Oncology an der Johns ...
Ausbildung: Die nächste Generation kommt
Im Rahmen der Session „Die nächste Generation“ wurde gemeinsam mit anderen spannenden Themen auch das Erlernen der Roboterchirurgie im Rahmen der Ausbildung dargestellt. Mehrere ...
Aktuelles und Zukunftsaussichten zur 177Lutetium-PSMA-Radioligandentherapie
177Lutetium-PSMA (177Lu-PSMA) ist eine zielgerichtete Therapieoption zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC). Die Therapie wirkt gezielt über ...