Therapie bei schweren Infektionen mit multiresistenten Erregern
Autoren:
Priv.-Doz. Dr. René El Attal
Dr. Laila Raschid-Straka
Landeskrankenhaus Feldkirch
E-Mail: rene.elattal@lkhf.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Infektionen mit multiresistenten Erregern – hierzu zählen der Methicillin-resistente Staphylococcus aureus (MRSA), Vancomycin-resistente Enterokokken und die multiresistenten gramnegativen (MRGN) Erreger – stellen zunehmend ein Problem für die antibiotische Therapie auch in der Orthopädie und Unfallchirurgie dar.
Auch Vorarlberg wird immer wieder mit Patienten konfrontiert, die aus anderen Ländern und Krankenhäusern übernommen werden, in denen eine kritische Antibiotikaresistenzlage besteht. Die Versorgung dieser Patienten benötigt ein interdisziplinäres Team aus Unfallchirurgen, Mikrobiologen, Infektiologen, Pharmazeuten, Pflegekräften und Krankenhaushygienikern. Besonders schwierig antibiotisch zu therapieren sind multiresistente gramnegative (MRGN) Keime. Hier sind die Enterobakterien, der Pseudomonas aeruginosa und der Acinetobacter baumannii von Bedeutung.
MRGN-Bakterien zeichnen sich durch ihre Resistenz gegen mehrere Antibiotikagruppen aus. Die Klassifizierung ergibt sich aus der Resistenz gegen 4 Markersubstanzen der Antibiotikaklassen: Ureidopenicilline, Cephalosporine, Chinolone und Carbapeneme. Sind die Keime gegen 3 der 4 Klassen resistent, so werden sie als 3-MRGN bezeichnet, wenn die Resistenz gegen 4 Klassen besteht, als 4-MRGN. Besteht der Nachweis einer Carbapenemase, ist der Erreger unabhängig von den anderen Antibiotikaklassen als 4-MRGN einzustufen.
Besonders bedeutend für die Infektionen in der Orthopädie und Unfallchirurgie sind die grampositiven Kokken: zum einen die Methicillin-resistenten Koagulase-negativen Staphylokokken und der Methicillin-resistente Staphylococcus aureus (MRSA). Die Methicillin-resistenten Koagulase-negativen Staphylokokken sind als natürlicher Bestandteil der menschlichen Hautflora bekannt. Sie sind ein häufiger Erreger von Protheseninfektionen und periimplantären Infektionen. Koagulase-negative Staphylokokken sind natürlicherweise keine multiresistenten Mikroorganismen. Durch den Erwerb von Resistenzeigenschaften ist jedoch ein erheblicher Teil der Stämme gegenüber zahlreichen Antiinfektiva resistent.
Therapeutisches Vorgehen
Grundsätzliches bei periprothetischen Infektionen
Frühinfektionen (<4 Wochen) können in der postoperativen Phase oder durch hämatogene Streuung auftreten. Bei ihnen sollte ein Erhaltungsversuch unternommen werden: Im englischen Sprachraum wird dieses Vorgehen als DAIR („debridement, antibiotics and implant retention“) bezeichnet. Falls jedoch schon bei der ersten Probengewinnung ein multiresistenter Keim oder ein „Difficult to treat“-Keim gezüchtet wurde, ist DAIR keine Option mehr.
Während bei Spätinfektionen (>4 Wochen) der zweizeitige Wechsel über viele Jahre den Goldstandard darstellte, setzen sich immer mehr auch kürzere Intervalle oder sogar einzeitige Wechsel durch, sofern keine Infektion durch schwer zu behandelnde Keime vorliegt. Voraussetzung ist natürlich auch eine gute Weichteilsituation. Die Gründe für diesen Trend liegen in der geringeren Morbidität und der kürzeren Hospitalisierung und Immobilisierung durch einen einzeitigen Wechsel. Auch sind bessere funktionelle Ergebnisse zu erwarten. Wenn die Kriterien für einen einzeitigen Wechsel gegeben sind, kann ein zweizeitiges Vorgehen sogar als „overtreatment“ gesehen werden.
Die Voraussetzungen für einen einzeitigen Wechsel sind definiert: geringe Knochendefekte, guter oder gering beeinträchtigter Weichteilmantel, keine Voroperationen oder Vorbehandlungen mit biofilmaktiven Antibiotika. Auch sind die Vorerkrankungen des Patienten, z.B. onkologische Erkrankung mit Immunsuppression, Dialysepatient etc., zu berücksichtigen und ein individueller Therapieplan ist zu entwerfen.
Periprothetische Infektionen mitProblemkeimen
Einzeitige Wechsel und kurze Intervalle beim zweizeitigen Wechsel sind bei Infektionen durch Problemkeime nicht angezeigt. Radikales Débridement (siehe unten), hochvolumige Spülungen, konsequentes Totraummanagement und mehrzeitige Wechsel sind in der Regel erforderlich.
Aufgrund verlängerter Intervalle müssen zwischenzeitig auch Spacer entfernt werden, weil diese nach spätestens 8 Wochen selbst biofilmaktive Oberflächen bieten. Entweder werden sie erneuert oder – sofern möglich – ausgebaut und im nächsten kürzeren Intervall ganz weggelassen, bevor eine Reimplantation der Prothese durchgeführt werden kann.
Grundsätzliches bei periimplantären Infektionen
Bei Infektionen nach Frakturversorgung stellt sich die zentrale Frage, ob die Fraktur konsolidiert ist oder nicht. Im einfachsten Fall ist die Fraktur geheilt. Das Vorgehen besteht dann in der vollständigen Metallentfernung und einem fachkundigen Débridement, gefolgt von einer antibiotischen, dem Keim angepassten Therapie. Der Keim bestimmt die Art des Antibiotikums und die Dauer der Gabe.
Schwieriger wird es, wenn die Fraktur nicht geheilt ist. Dann muss die nächste entscheidende Frage beantwortet werden: Handelt es sich um einen Frühinfekt (<6 Wochen) oder um einen Spätinfekt (>6 Wochen)? Dies lässt sich in aller Regel leicht eruieren. Der Frühinfekt bei guter stabiler Frakturversorgung und guter Weichteildeckung erlaubt die Erhaltung der Osteosynthese unter Durchführung eines gründlichen Débridements und antibiotischer Therapie. Unter Umständen ist eine Suppressionstherapie bis zur Frakturheilung erforderlich.
Beim Spätinfekt (nicht geheilt) hängt das Vorgehen zur Eradikation nun davon ab, ob es sich um einen sogenannten „Difficult to treat“-Keim oder aber einen multiresistenten Erreger handelt. Bei gut zu behandelnden Keimen kann eine einzeitige septische Reosteosynthese durchgeführt werden. Voraussetzungen sind eine gute Weichteildeckung und ein Débridement, welches nur gesundes, gut durchblutetes Gewebe hinterlässt. Sind diese Voraussetzungen nicht gegeben, ist ein zweizeitiges (mehrzeitiges) Vorgehen erforderlich.
Periimplantäre Infektionen mitmultiresistenten Bakterien
Bei multiresistenten Pathogenen ist immer ein (mindestens) zweizeitiges Vorgehen erforderlich. Zunächst muss das Implantat inklusive aller Schrauben und verbliebener Metalloberflächen (z.B. Bohrerspitzen) entfernt werden. Nach einem fachkundigen Débridement (siehe unten) erfolgt eine temporäre, möglichst stabile Osteosynthese. Eine stabile Fraktursituation ist eine wichtige Voraussetzung für die Heilung jedes periimplantären Infektes. In der Folge muss abhängig vom Pathogen für 6–12 Wochen eine Antibiotikagabe erfolgen. Bei blanden Wunden und normalen Laborwerten erfolgt, nach einem erneuten Débridement, eine stabile Reosteosynthese. Wiederum ist in der Regel für 6 Wochen die Gabe von Antibiotika erforderlich.
Antibiotikatherapie
Bei schweren periimplantären Infektionen mit multiresistenten Erregern erfolgt immer eine individualisierte antibiogrammgerechte Antibiotikatherapie.
Eine besondere Herausforderung sind Infektionen mit MRGN-Keimen, die oft eine mehrwöchige antibiotische Therapie notwendig machen. Im gramnegativen Bereich stehen uns bei MRGN oft nur parenterale Antibiotika zur Verfügung, die zwei- bis dreimal täglich verabreicht werden müssen.
Im Sinne einer ambulanten parenteralen Antibiotikatherapie bei resistenten grampositiven Kokken steht uns mit Dalbavancin (bei Knochen- und Protheseninfektionen als Off-label-Indikation) eine neue Substanz zur Verfügung, die wir seit 2015 mit hoher klinischer Heilungsrate einsetzen. Dalbavancin ist ein Lipoglykopeptid mit langer Halbwertszeit (346h) und guter Penetration in den Knochen, bei insgesamt sehr guter Verträglichkeit.
Zentrale Bedeutung hat das chirurgische Débridement!
Wie soll das Débridement erfolgen?
Gleich zu Beginn muss betont werden, dass das Débridement von einem sehr erfahrenen Chirurgen durchzuführen ist. Es handelt sich keinesfalls um eine „Anfängeroperation“ am Ende eines Operationstages.
Damit der Infekt saniert werden kann, muss nekrotisches Gewebe radikal mit dem Messer entfernt werden. Daher ist fast ausschließlich ein offenes Vorgehen mit Erweiterung bestehender Zugänge erforderlich. Nach Gewebetaschen, in die sich der Infekt gegraben hat, ist aktiv zu suchen. Zur vollständigen Entfernung von Fisteln und Fistelgängen hat sich die Markierung mit Methylenblau bewährt. Knochensequester müssen, ebenso wie Fremdkörper, vollständig entfernt werden. Dies sind neben den Implantaten selbst auch alle Cerclagen, Schrauben, K-Drähte und abgebrochene Bohrerspitzen. Auch Nahtmaterial wird besiedelt und muss vollständig entfernt werden. Zementreste aus dem Implantatlager und dem Markraum müssen z.B. mit Hohlmeißeln minutiös entfernt werden. Ziel ist es ja, bereits gebildeten Biofilm zu entfernen bzw. eine Neubildung zu verhindern.
Bei intramedullärer Beteiligung muss der Markraum aufgebohrt und gefenstert werden. Das Anfrischen der Verriegelungslöcher oder Schanzschraubenlöcher darf nicht vergessen werden. Sollte eine Osteomyelitis auch die Kortikalis betreffen, erfordert dies die Dekortizierung, die Knochenresektion und unter Umständen sogar eine Segmentresektion. Zur Bestimmung der Ausdehnung ist die präoperative Abklärung mittels PET-CT/MRT hilfreich. Klinisch intraoperativ muss immer wieder geprüft werden, ob der verbliebene Knochen durchblutet ist. Es empfehlen sich Hohlmeißel und Fräsen.
Eine hochvolumige Spülung ohne Druck sorgt für einen Verdünnungseffekt und eine Verminderung der Keimlast, ohne Pathogene in entferntere Gewebeschichten zu bringen. „The solution to pollution is dilution.“ Als intraoperative Spüllösung in der Orthopädie und Unfallchirurgie ist neben Elektrolytlösungen (NaCl, Ringer) auch Polyhexanid 0,02/ 0,04% zugelassen.
Nach dem Débridement ist das Totraummanagement entscheidend. Es sollen keine großen Höhlen im Knochen und/oder Weichteil verbleiben, die sich mit Blut füllen und einen guten Nährboden für Bakterien bieten können. Es kommen antibiotikabeschichtete Ketten, zementbeschichtete Stäbe, Zementspacer etc. zum Einsatz, um den nach dem Débridement entstandenen Defekt zu füllen. Ketten haben den Nachteil, dass sie selbst Sekretion hervorrufen können. Sie sind daher nur für einen kurzen Zeitraum einzusetzen und immer vollständig zu entfernen.
In jedem Fall ist ein frühzeitiger, wenn möglich primärer Wundverschluss anzustreben. Dies kann auch eine plastische Weichteildeckung (meist Muskellappen oder freier Lappen) direkt im Anschluss an die definitive Reosteosynthese oder Reimplantation erfordern. Eine Vakuumtherapie sollte nur kurz als überbrückende Maßnahme eingesetzt werden. Eine genaue Abstimmung über die zeitlichen Abfolgen und operativen Eingriffe mit den Kollegen der plastischen Chirurgie ist erforderlich. Es macht sehr viel Sinn, die Kollegen bereits während des Débridements hinzuziehen.
Wie sinnvoll sind Isolationsmaßnahmen? Was ist „State of the Art“ bei Patienten mit multiresistenten Erregern?
Die Hygienemaßnahmen bei Nachweis von multiresistenten Keimen bestehen im Krankenhaus v.a. in der Isolierung betroffener Patienten. Haube, Mundschutz, Schutzmantel und natürlich Handschuhe sind Pflicht bei jedem Kontakt und jeder Pflegemaßnahme. Patienten mit MRSA- und 4-MRGN-Keimen müssen im Krankenhaus isoliert werden, um eine nosokomiale Ausbreitung zu verhindern. Daher sind alle Mitarbeiter zu informieren, wenn der Patient in den OP, ins Röntgen/CT oder zu anderen Untersuchungen außerhalb der Station gebracht wird.
Fallbeispiel
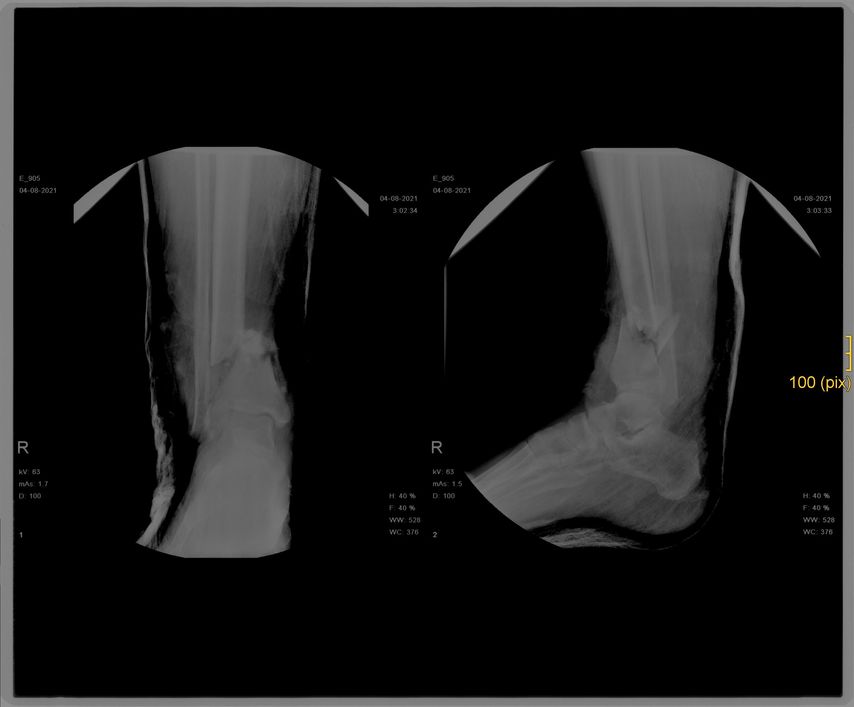
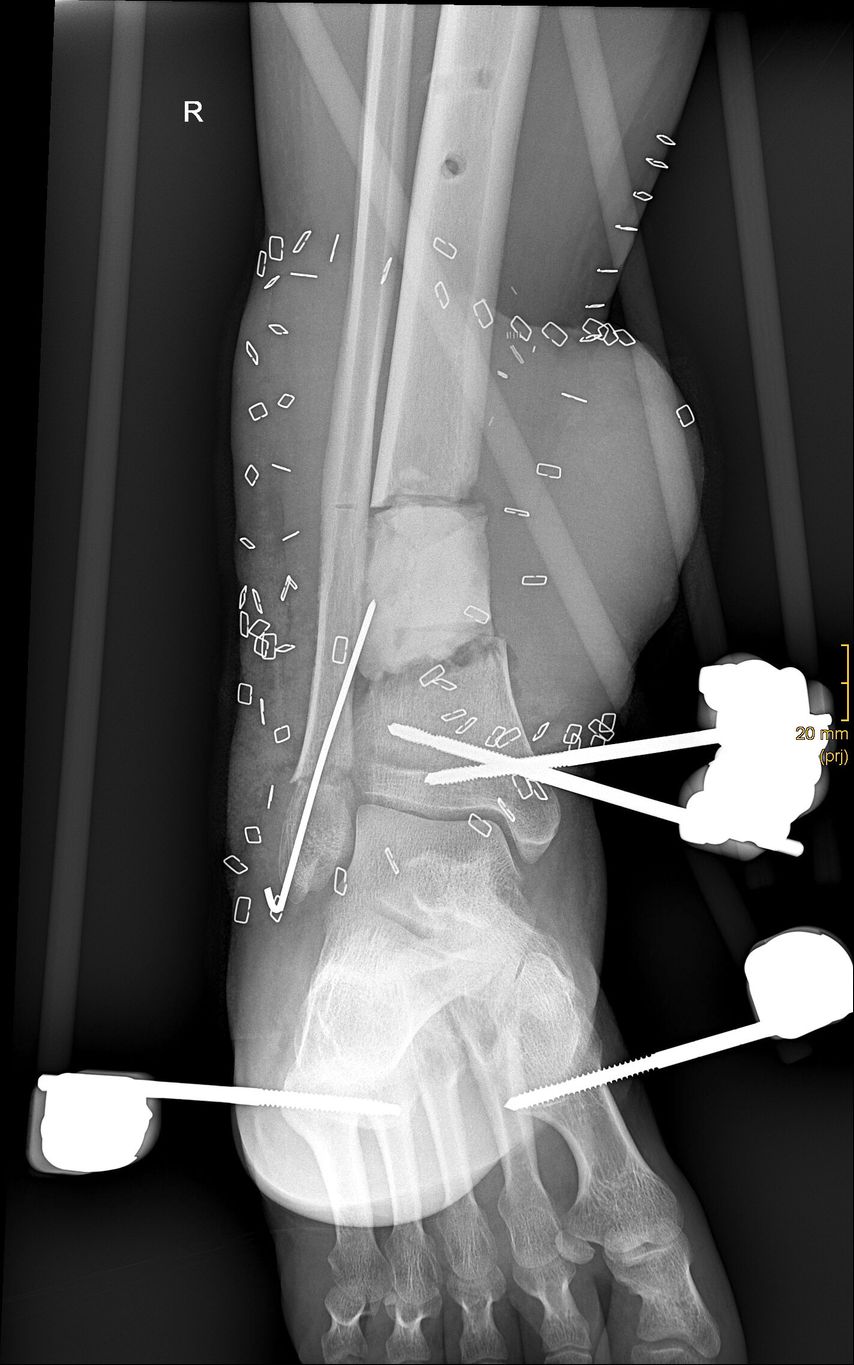
Ein 31-jähriger Vorarlberger erlitt auf Heimaturlaub in Serbien, nachdem ihm ein Traktor auf den rechten Fuß gekippt war, eine III-gradig offene Tibiafraktur, welche in Serbien mit einem Fixateur externe versorgt wurde (Abb. 1).
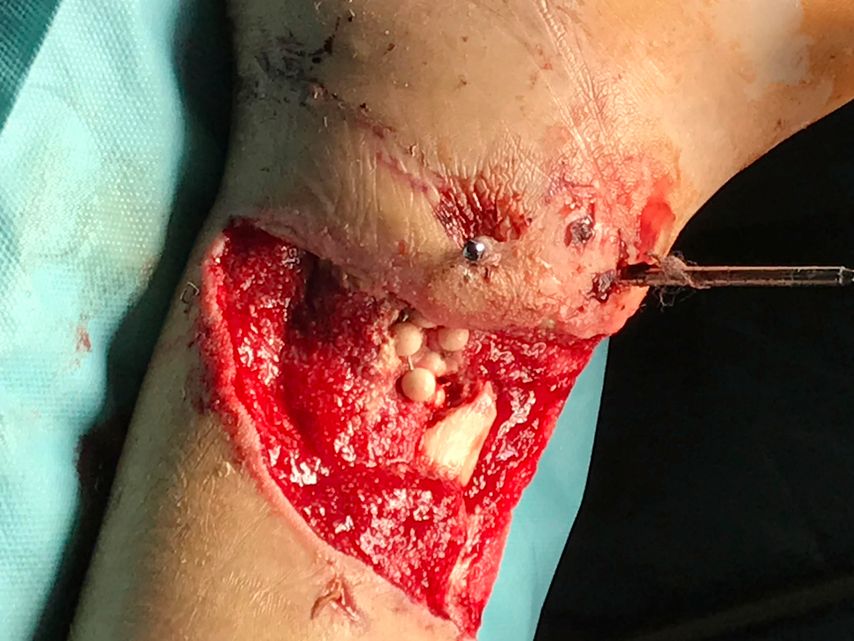
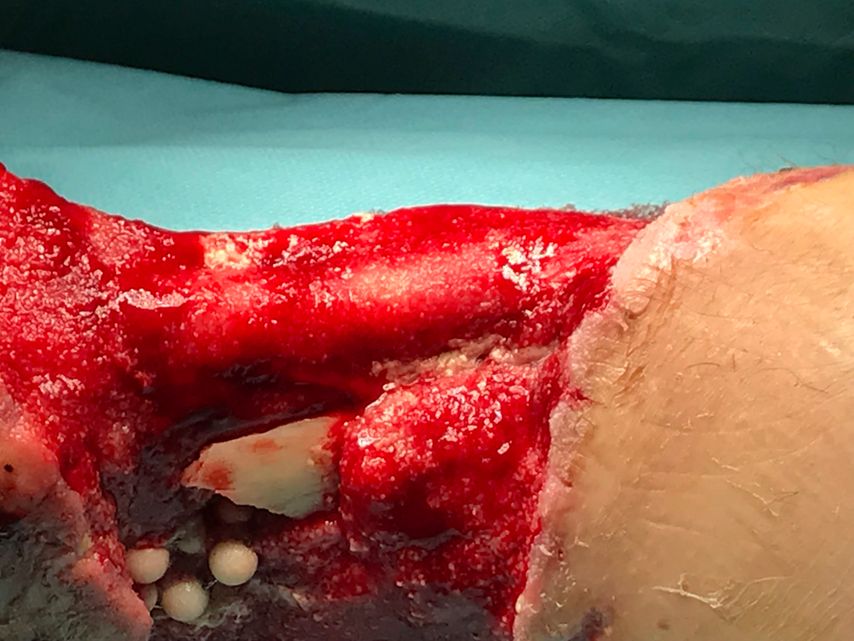
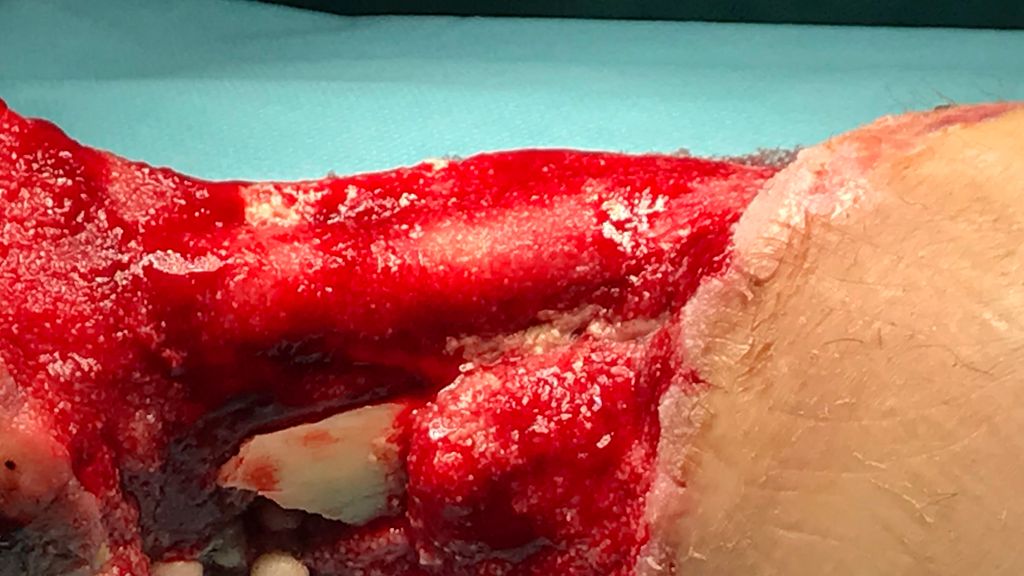
Zum Zeitpunkt des Transfers in unser Krankenhaus zeigte der Patient einen ausgedehnten Haut-Weichteil-Defekt. Er wurde isoliert und es erfolgte ein Screening auf MRSA und MRGN-Keime. Von unfallchirurgischer Seite erfolgte ein ausgedehntes Débridement (Abb. 2 und 3), der Fixateur externe wurde gewechselt und ein VAC angelegt. Der Totraum wurde mit Gentamycinketten (Abb. 4) gefüllt.
In den intraoperativ entnommenen Gewebeproben zeigten sich mikrobiologisch MRGN-Bakterien: Acinetobacter baumanii (NDM, Neu-Dehli-Metallobetalactamase, Carbapenem-resistent, Cefiderocol-resistent, Aztreonam-Cetazidim/Avibactam-resistent, Tigecyclin- und Colistin-sensibel), 3-MRGN Enterobacter cloacae (Carbapenem-sensibel) sowie grampositive Enterokokken und im zweiten Débridement v.a. Corynebacterium striatum.
Es erfolgte eine individuell angepasste systemische Antibiotikatherapie mit Tigecyclin, Meropenem und Dalbavancin. Nach repetitiven chirurgischen Débridements wurde nach 2 Wochen eine Zementplombe eingesetzt (Masquelet-Technik, Abb. 5). Der ausgedehnte Haut-Weichteil-Defekt wurde von plastisch-chirurgischer Seite im selben Eingriff mit einem freien Latissimus-dorsi-Lappen gedeckt. Die Fraktur wurde weiterhin mit einem Fixateur externe stabilisiert.
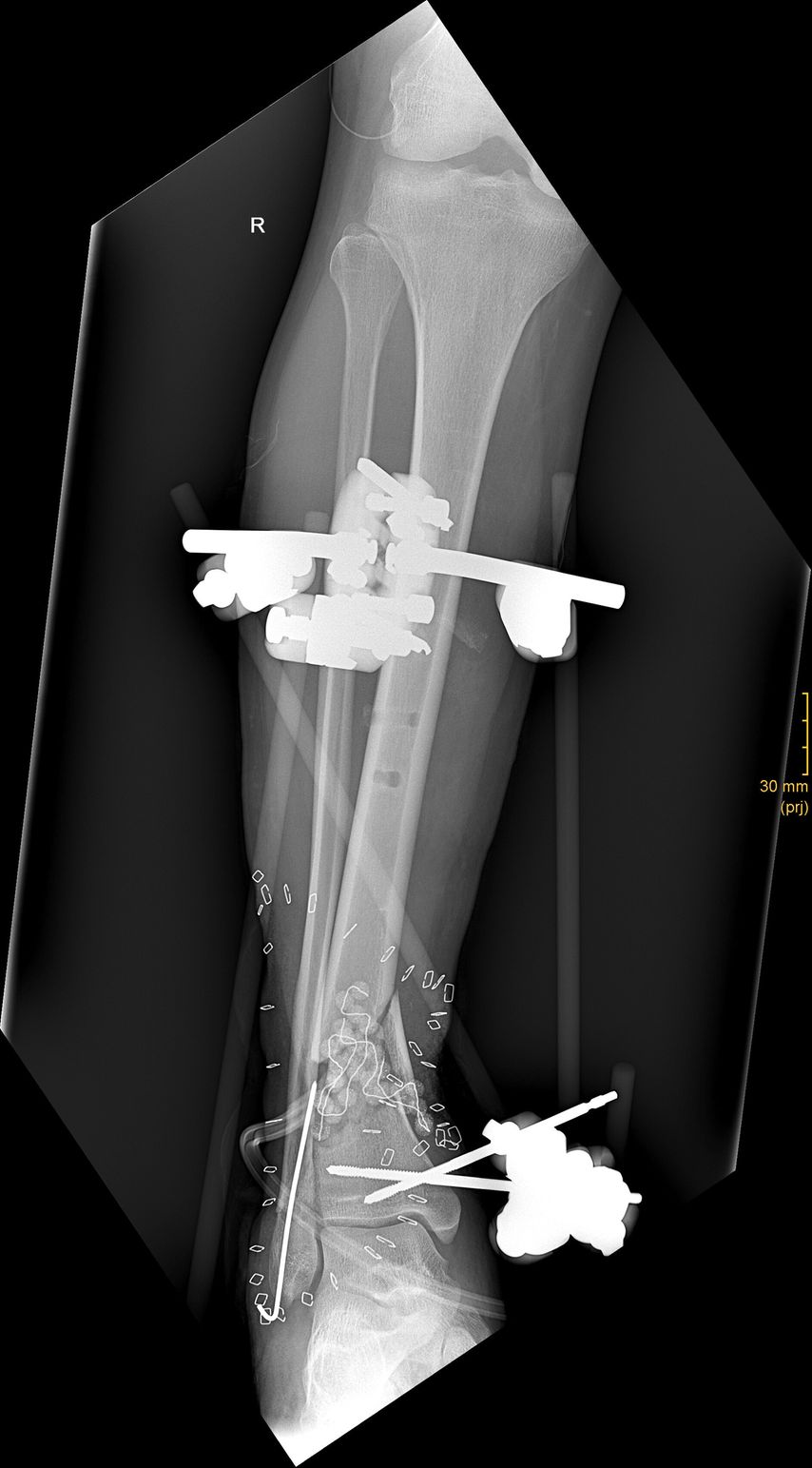
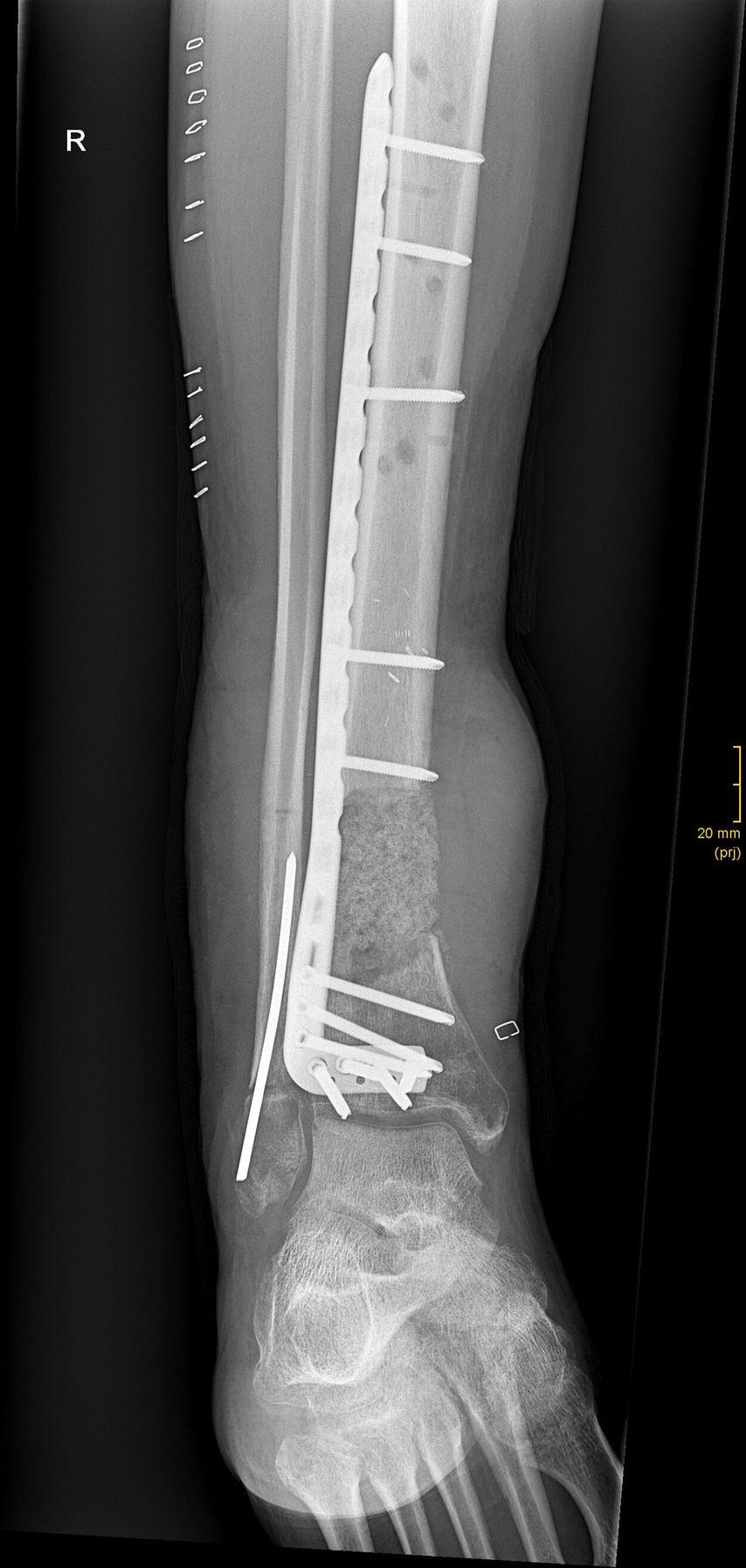
Die antibiotische Therapie verursachte beim Patienten, wie von Tigecyclin bekannt, ausgeprägte Übelkeit. Diese wurde begleitend antiemetisch therapiert. Nach einem 11-wöchigen Intervall wurde der Lappen gehoben und die Fraktur wurde dann endgültig plattenosteosynthetisch versorgt, nachdem die Zementplombe vorsichtig entfernt und die entstandene gefäßreiche Membran um den Defekt durch Knochenmaterial (mittels RIA aus dem kontralateralen Oberschenkelmarkraum gewonnen) aufgefüllt worden war (Abb. 6).
Perioperativ wurde die antibiotische Therapie von Tigecyclin für 10 Tage auf Colistin umgestellt. Die intraoperativen Abstriche zeigten eine Eradikation der Bakterien. Das postoperative Ergebnis war erfreulicherweise sehr gut.
Abb. 6: Auffüllung des Defektes mit autologem Knochen vom Markraum des kontralateralen Oberschenkels mittels RIA
Zusammenfassung
Dieser Fall demonstriert die multidisziplinäre Herausforderungen für den Chirurgen (großzügiges Débridement und gute Planung bei der ossären Versorgung der Fraktur), den plastischen Chirurgen (Deckung des Haut-Weichteil-Defektes) und den Mikrobiologen und Infektiologen (optimale antiinfektive Therapie). Eine gute Zusammenarbeit ist essenziell für diese herausfordernden seltenen Fälle.
Das könnte Sie auch interessieren:
Periphere Nervenkompressionssyndrome der oberen Extremität
Periphere Nervenkompressionssysteme der oberen Extremitäten sind verhältnismäßig häufig, insbesondere der Nervus medianus und der Nervus ulnaris sind oft im Bereich des Hand- bzw. ...
Konservative Behandlungsmöglichkeiten bei peripheren Nervenläsionen
Eine periphere Nervenläsion erfordert nicht nur eine Dekompression, Naht oder Rekonstruktion. Um Gelenke beweglich zu erhalten, eine Atrophie der Muskulatur zu verhindern und die ...
Bildgebende Diagnostik des peripheren Nervensystems
Die komplexen Nerventopografien machen die Nervenbildgebung zu einer fordernden Aufgabe, die allerdings eine wichtige Rolle dabei spielt, eine funktionelle Wiederherstellung der ...