Prävention von Infektionen in der Endoprothetik
Autoren:
Dr. Johannes Neugebauer
Prof. Dr. Martin Thaler
Universitätsklinik für Orthopädie und Traumatologie,
Medizinische Universität Innsbruck
Korrespondierender Autor:
Dr. Johannes Neugebauer
Während zu Beginn der Endoprothetik biomechanische und materialkundliche Fragen dominierten, steht aktuell vor allem die Auseinandersetzung mit Komplikationen im Fokus. In diesem Artikel wollen wir uns mit den infektassoziierten Komplikationen und ihrer Vermeidung befassen.
In einer Zeit, in der die Bevölkerung durchschnittlich immer älter wird, steigt neben dem durchschnittlichen BMI auch die Zahl der damit verbundenen muskuloskelettalen Begleiterkrankungen, wodurch der Endoprothetik in Bezug auf die Lebensqualität der Patienten eine revolutionäre Stellung zuteil wird.1–3 Die muskuloskelettale Integrität ist für die Lebensqualität bei zunehmendem Alter essenziell. So verzeichnen die Register in den letzten Jahren einen stetigen Anstieg der Zahl gelenkersetzender Operationen.4 Während zu Beginn der Endoprothetik vor allem biomechanische und materialkundliche Fragen dominierten, ist aktuell, durch minimal invasive Zugänge mit geringem Weichteiltrauma und die kontinuierliche Materialentwicklung, vor allem die Auseinandersetzung mit Komplikationen en vogue.5 Die Liste an potenziellen Komplikationen ist lang und ihre Einteilung autorenabhängig. Verschiedene Einteilungen sind zu finden: von prä-, intra- und postoperativen, mechanischen und nicht mechanischen, operateur- und patientenassoziierten Komplikationen bis zu implantatbedingten, stabilitätsbedingten oder infektassoziierten Komplikationen.
Letztere wollen wir einmal mehr in den wissenschaftlichen Fokus rücken und ihre Vermeidung unterstützen. Per definitionem spricht man dann von einer Protheseninfektion, wenn im Gewebe, in dem diese eingebracht wurde, eine Umgebungsreaktion entsteht.6 Die Komplikation einer periprothetischen Infektion wird in der Literatur mit 0,2–2% angegeben, bei Megaprothesen beträgt diese sogar 9–15%.4,7–12 Die Kenntnis der Risikofaktoren und ein optimales perioperatives Management wirken oft protektiv in der Vermeidung dieser gefürchteten Komplikation. Kommt es aufgrund verschiedener Quellen doch zu einer Infektion, steht diagnostisch die intraartikuläre Erregergewinnung mit einer Spezifität und Sensitivität von mehr als 90% für eine schnellstmögliche resistogrammgerechte Einleitung einer antibiotischen Therapie an erster Stelle.4,9,12,13 Bei kurzer Symptomdauer und zeitnahem Therapiebeginn ist ein Prothesenerhalt bei etwa 35–90% der Patienten möglich.4 Neben der spezifischen antimikrobiellen Therapie sind ein chirurgisches Débridement, eine Lavage des Gewebes zur Keimzahlreduktion und gegebenenfalls der Wechsel der nicht knochenverankerten Teile durchzuführen.4 Führen diese Maßnahmen nicht zum gewünschten Erfolg oder ist die Infektion fulminant, der Erreger resistent oder nur schwer nachweisbar, ist ein Prothesenwechsel notwendig. Dieser wiederum kann eines ein- oder zweizeitigen Wechsels bedürfen.4
In der Literatur werden Hüftprotheseninfektionen nach Primärimplantation mit 2–10% angegeben und liegen dabei an dritter Stelle hinter den aseptischen Lockerungen (etwa 36%) und den Luxationen (etwa 17%).4,10 Bei Revisionseingriffen steigt der Wert sogar auf 5%.10–12,14–16 Die Inzidenz der einzelnen Gelenksinfektionen beträgt:4,17
-
Hüfte: <1%
-
Schulter: <1%
-
Knie: <2%
-
Ellenbogen: 9%
-
Mega- und Tumorprothesen: 15%
Die Infektion ist neben mechanischen Komplikationen einer der häufigsten Gründe für Revisionseingriffe.4 Liegt eine Gelenkinfektion vor, gilt zur Wahl des therapeutischen Algorithmus primär die Klassifikation bzw. Entscheidung, ob ein Früh- oder Spätinfekt vorliegt. Ist diese Entscheidung getroffen, sollte die entsprechende Therapie konsequent verfolgt werden.4
Die angeführten Zahlen und Fakten sollen beim Leser keinesfalls eine negative Assoziation mit der Endoprothetik hervorrufen, sondern die Sinne schärfen. Subjektiv ist der Großteil der Patienten mit dem postoperativen Ergebnis zufrieden. Da die Anzahl endoprothetischer Operationen stetig steigt, erhöht sich auch die Zahl der Infektionen. Der Prozentsatsz verändert sich dabei nur geringfügig. Nach unserer Literaturrecherche bleibt zu resümieren, dass der Expertise des behandelnden Arztes nach wie vor ein gleich großer Anteil innerhalb der Entscheidungsfindung der Behandlungsstrategie zuteil wird wie dem evidenzfundierten Wissen.9,18 Selbst mehr als 400 Experten dieser Welt kommen nach einem Treffen in Philadelphia überein, dass jede Gelenkinfektion individuell therapiert werden muss.9,19 Aufschlussreiche randomisierte Studien sind rar.9,18,19 In Fachkreisen wird weiterhin die Länge der antibiotischen Behandlung (6 Wochen vs. 12 Wochen), ihre Applikationsform (oral vs. intravenös), der Zeitpunkt einer möglichen Oralisierung und bei Entscheidung zum Prothesenwechsel das Vorgehen (einzeitig vs. zweizeitig) diskutiert. Wir wollen mit unseren Überlegungen jedoch einen Schritt früher ansetzen und Input geben, wie oben genannte Szenarien vermieden werden können.
Perioperative Risikofaktoren
Eine aktive Infektion des zu operierenden Gelenks (septische Arthritis), das Vorliegen einer Sepsis sowie das Vorhandensein einer aktiven, lokalen kutanen, subkutanen oder tiefen Gewebeinfektion sind signifikante Risikofaktoren für eine intraoperative oder postoperative Gelenkinfektion und stellen damit Kontraindikationen für einen elektiven Gelenkersatz dar.20 Potenzielle Risikofaktoren für die Entwicklung von Infektionen sind: postoperative Infektionen in der Vorgeschichte, ein schlecht eingestellter Diabetes mellitus (Glukose >200mg/l oder HbA1c >7%), Unterernährung, Adipositas (BMI >40 kg/m2), aktive Lebererkrankung, chronische Nierenerkrankung, übermäßiges Rauchen (mehr als eine Packung pro Tag), übermäßiger Alkoholkonsum (>40 Einheiten pro Woche), intravenöser Drogenmissbrauch, kürzlicher Krankenhausaufenthalt, längerer Aufenthalt in einer Rehabilitationseinrichtung, männliches Geschlecht, entzündliche Arthropathie, vorangegangener chirurgischer Eingriff am betroffenen Gelenk und schwere Immunschwäche.20
Allgemein sollte beim elektiv zu Operierenden kein Infektherd vorhanden sein. Die Zähne bilden oft ein Schlupfloch für unentdeckte Herde und sollten per Fragebogen oder Zahnarzt examiniert werden.20
Eine Empfehlung zum allgemeinen Screening auf multiresistente Keime besteht nicht – auch nicht für jene Patienten, die im Gesundheitswesen arbeiten. Jedoch lautet auch hier die Expertenmeinung, dass eine individuelle Kasusentscheidung zu fällen ist.20
Auch die routinemäßige Urinuntersuchung ist nicht zwingend erforderlich, sollte aber bei positiver Anamnese oder bei symptomatischen Patienten durchgeführt werden.20
Krankheitsmodifizierende immunsuppressive Medikamente sollten perioperativ mit dem behandelnden Arzt abgesetzt werden. Eine Liste bezüglich des perioperativen Managements kann unter https://www.msis-na.org eingesehen werden.20
Alle Patienten, die in der Vergangenheit eine Gelenk- bzw. Protheseninfektion hatten, müssen serologisch sowie per Punktat auf Infektionen abgeklärt werden.20
Perioperatives Management
Eine Empfehlung zur präoperativen Reinigung der Haut mit Chlorhexidingluconat (CHG) oder zumindest der Verwendung einer antiseptischen Seife am Vorabend wird abgegeben. Auf frische Bettwäsche sollte geachtet und die Anwendung von topischen Mitteln vermieden werden.20 Es gibt keinen wesentlichen Unterschied zwischen verschiedenen Haut- und Händedesinfektionsmitteln.20
Bezüglich des perioperativen Managements der Haare ist das Schneiden dem Rasieren überlegen. Sollte eine Rasur nötig sein, ist diese so kurz wie möglich vor dem Hautschnitt durchzuführen.20
Perioperative antibiotische Abschirmung
Die präoperative antibiotische Abschirmung sollte innerhalb einer Stunde nach dem Hautschnitt verabreicht werden.
Bei Routineeingriffen sind Cephalosporine der ersten und zweiten Generation die Therapie der Wahl. Teicoplanin und Vancomycin sind Alternativen. Bei Penicillinallergie kann auf Clindamycin und Vancomycin zurückgegriffen werden. Es gibt keine Evidenz dafür, dass die Antibiotikagabe postoperativ verlängert werden müsste, wenn Harnkatheter und/oder Drainagen einliegen. Beide sollten jedoch nicht länger als notwendig verbleiben. Die perioperative antibiotische Abschirmung sollte nicht länger als 24Stunden dauern, außer intraoperativ wird die Entscheidung zu einer Verlängerung gefällt. Bei einer langen OP-Dauer sollte die Gabe nach zwei Halbwertszeiten wiederholt werden. Die Empfehlung einer neuerlichen Gabe gilt auch bei hohem Blutverlust > 2000ml und einer großen Flüssigkeitsrückführung > 2000ml. Aufgrund der Pharmakokinetik der verschiedenen Substanzen sollte auf eine Gewichtsadaptierung geachtet werden. Im Fall von MRSA-Trägern ist die Verwendung von Vancomycin oder Teicoplanin empfohlen. Große Tumoreingriffe sowie Patienten mit schlecht eingestelltem Diabetes mellitus oder unter Immunsuppression benötigen keine Anpassung der perioperativen Prophylaxe.20
Operatives Umfeld
Die Wahrscheinlichkeit für das Auftreten einer Wundinfektion korreliert direkt mit der Menge an Bakterien, die die Wunde erreicht. Daher werden Strategien zur Verringerung dieser empfohlen. Luftgetragene Partikelbakterien sind eine Hauptquelle für Kontamination. In der OP-Saal-Umgebung werden diese vor allem vom Personal ausgeschieden, daher sollte auf einen konsequent getragenen Mundschutz geachtet und dieser regelmäßig gewechselt werden. Bezüglich der Verwendung eines Laminar-Airflows kann kein Vorteil beobachtet werden. Jedoch tragen die Bewegungen innerhalb des OP-Saals negativ zur Luftaufwirbelung bei und sollten daher auf ein Minimum beschränkt werden. Interessant ist, dass das Mitbringen von (privaten) elektronischen Geräten sowie die intraoperativ gesprochenen Worte mit einer höheren Infektionsrate in Verbindung gebracht werden. Gleiches gilt für die Dauer der Operation. Sie sollte in Abhängigkeit ihres individuellen Schwierigkeitsgrads so kurz wie möglich gehalten werden. Die Körpertemperatur – ein Parameter, der eher von den Kollegen der Anästhesie im Auge behalten wird – sollte stets auf einem normothermen Niveau gehalten werden.20
Prozedur
Es wird eine Empfehlung abgegeben, dass für einen sichereren Kontaminationsschutz ein doppeltes Paar Handschuhe getragen werden sollte. Dieses sollte mindestens alle 90 Minuten, nach Zementierung, bei Perforation und vor Implantation der Prothese gewechselt werden. Das Instrumentarium sollte so kurz wie möglich vor dem Eingriff geöffnet werden, Gleiches gilt für das Öffnen von Prothesen(teilen). Die Hautklinge sollte nicht für die Präparation tieferer Schichten verwendet werden. Die Wahl der Prothese hat keinen Einfluss auf die Infektionsrate, die Größe jedoch schon – Megaprothesen haben, wie bereits zuvor erwähnt, eine höhere. Antibiotikum-imprägnierter Polymethylmethacrylat-Zement (ABX-PMMA) reduziert die Inzidenz von periprothetischen Infektionen und sollte bei Patienten mit hohem Risiko verwendet werden. Das Zementieren birgt jedoch auch kardiopulmonale Risiken, sodass ein Abwägen erforderlich ist. Bei Revisionseingriffen, die eine zementierte Komponente benötigen, sollte diese unbedingt mit Antibiotika versetzt werden.20
Biofilme/Prothesenoberflächen
Die Themen Biofilm und Prothesenoberfläche vermögen ganze Kongresse zu füllen. Auch hier ist die Evidenz rar, jedoch wird das der Ansatz künftiger Forschungsarbeiten sein müssen. Das Gewebe hat die Fähigkeit zur Selbstregeneration und kann durch Pharmaka unterstützt werden – diese beiden Charakteristika fehlen dem Prothesenmaterial. Sie bieten jedoch ein breites Feld für zukünftige Überlegungen, die vor allem die Protektion der A-priori-Infektion in den Fokus stellen.20
Wir konkludieren, dass die Angst vor Komplikationen die endoprothetische Versorgung von Patienten nicht negativ beeinflussen sollte, sondern dass durch Disziplin, Vorsicht und Kenntnis des evidenzfundierten Wissens eine wesentliche medizinische Errungenschaft des 21. Jahrhunderts eine breite Anwendung findet.
Wir wollen jedoch gleichzeitig auf das Entwicklungspotenzial und die Notwendigkeit der Weiterentwicklung einer der erfolgreichsten Operationen der Medizin hinweisen. Rudolf von Bennigsen-Foerder wird das Zitat „Stillstand ist Rückschritt“ zugesprochen und nach dessen Motivation wollten wir einmal mehr die Risikofaktoren einer Protheseninfektion in den wissenschaftlichen Fokus rücken und geben als Ausblick die Hoffnung, neue Verfahren und Methoden in den Bereichen des Bioengineerings und der Pharmakologie zu gewinnen, welche die chirurgischen Fähigkeiten unterstützen können – mit dem Resultat, die physische Integrität des Patienten wiederherzustellen und das individuelle Niveau an Lebensqualität zu restaurieren.
Literatur:
1 BMI (Body Mass Index): https://www.statistik.at/web_de/ statistiken/menschen_und_gesellschaft/gesundheit/gesundheitsdeterminanten/ bmi_body_mass_index/index.html 2 Body-Mass-Index. Wikipedia, 2021 3 Österreich – Durchschnittsalter Bevölkerung 2021. Statista: https://de.statista.com/statistik/daten/studie/217730/ umfrage/durchschnittsalter-der-bevoelkerung-in-oesterreich/ 4 Otto-Lambertz C et al.: Periprosthetic infection in joint replacement. Dtsch Arztebl Int 2017; 114(20): 347-53 5 Learmonth ID et al.: The operation of the century: total hip replacement. The Lancet 2007; 370(9597): 1508-19 6 Barg A et al.: Total ankle replacement. Dtsch Arztebl Int 2015; 112(11): 177-84 7 Schulte Strathaus R: Endoprothetik: Zwischen Anspruch und Realität. Dtsch Arztebl 2016; 113(3): A80-2 8 https://www.aerzteblatt.de/nachrichten/104605/ Infektionsrisiko-bei-Gelenkersatz-auch-nach-Jahren-vorhanden 9 Cats-Baril W et al.: International consensus on periprosthetic joint Infection: description of the consensus process. Clin Orthop Relat Res 2013; 471(12): 4065-75 10 Wetters NG et al.: Risk factors for dislocation after revision total hip arthroplasty. Clin Orthop Relat Res 2013; 471(2): 410-6 11 Ong KL et al.: Prosthetic joint infection risk after total hip arthroplasty in the Medicare population. J Arthroplasty 2009; 24(6 Suppl): 105-9 12 Gundtoft PH et al.: The “true” incidence of surgically treated deep prosthetic joint infection after 32,896 primary total hip arthroplasties: a prospective cohort study. Acta Orthop 2015; 86: 326-4 13 Kurtz SM et al.: Prosthetic joint infection risk after TKA in the Medicare population. Clin Orthop Relat Res 2010; 468(1): 52-6 14 Mahomed NN et al.: Epidemiology of total knee replacement in the United States Medicare population. J Bone Joint Surg Am 2005; 87(6): 1222-8 15 Phillips CB et al.: Incidence rates of dislocation, pulmonary embolism, and deep infection during the first six months after elective total hip replacement. J Bone Joint Surg Am 2003; 85(1): 20-6 16 Urquhart DM et al.: Incidence and risk factors for deep surgical site infection after primary total hip arthroplasty: a systematic review. J Arthroplasty 2010; 25(8): 1216-22.e1-3 17 Trampuz A, Zimmerli W: Diagnosis and treatment of implant-associated septic arthritis and osteomyelitis. Curr Infect Dis Rep 2008; 10(5): 394-403 18 Parvizi J, Gehrke T: Executive summary. J Arthroplasty 2014; 29(2 Suppl): 5 19 Parvizi J, Gehrke T: International consensus on periprosthetic joint infection: let cumulative wisdom be a guide. J Bone Joint Surg Am 2014; 96(6): 441 20 Gehrke T, Parvizi J: Proceedings of the international consensus meeting on periprostetic joint infection: https://www.efort.org/wp-content/uploads/2013/10/philadelphia_consensus.pdf
Das könnte Sie auch interessieren:
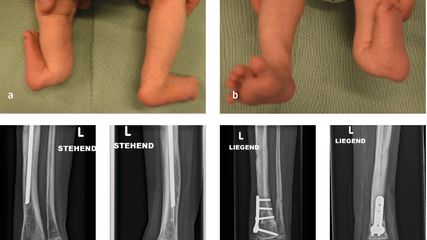
Angeborene Fehlstellungen des Unterschenkels
Kongenitale Deformitäten des Unterschenkels gehören zu den seltenen, aber medizinisch bedeutenden und operativ herausfordernden Diagnosen der Kinderorthopädie. Eine differenzierte ...
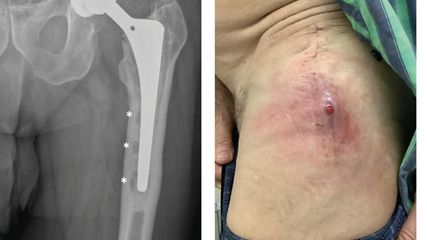
Einzeitiger und mehrzeitiger septischer Endoprothesenwechsel
Die periprothetische Infektion (PPI) stellt eine der gefürchtetsten Komplikationen im Bereich der Orthopädie und Traumatologie dar. Sie ist verbunden mit hohen Morbiditäts- und ...
Hochgradige ACG-Luxationen – wann konservativ behandeln, wann nicht?
Verletzungen des Akromioklavikulargelenks (ACG) gehören zu den häufigsten Schulterverletzungen bei jungen und aktiven Menschen, insbesondere auch aufgrund der zunehmenden Beliebtheit von ...