Zwischen PROSPECT und DESTINY: Neuerungen in der Darmkrebs-Behandlung
Autor:
Assoc. Prof. Dr. Lukas Weiss, PhD
Universitätsklinik für Innere Medizin III
Salzburg Cancer Research Institute (SCRI)
Paracelsus Medizinische Universität
E-Mail: lu.weiss@salk.at
Ein Kaleidoskop an Themen wurde am ASCO-Kongress 2023 auf dem Gebiet des Kolorektalkarzinoms (CRC) präsentiert: von der Therapiedeeskalation beim Rektumkarzinom, der Sinnhaftigkeit der neoadjuvanten Chemotherapie beim Kolonkarzinom über den (wenn auch mit Überraschungen) fortgesetzten Siegeszug der Antikörper-Wirkstoffkonjugate bei HER2+ Malignomen bis hin zu neuer Evidenz für die ctDNA-Analyse als Schlüsseltechnologie für die weitere Therapieoptimierung beim CRC.
Verzicht auf neoadjuvante Radiotherapie bei lokal fortgeschrittenem Rektumkarzinom
Die randomisierte Phase-III-Studie PROSPECT wurde 2012 in den USA initiiert, als das lokal fortgeschrittene Rektumkarzinom klassischerweise mit einer neoadjuvanten Langzeit-Chemoradiotherapie, gefolgt von Operation und anschließender adjuvanter Chemotherapie, behandelt wurde. In dieser Studie mit 1194 Patient:innen wurde der Stellenwert der Strahlentherapie als Teil der neoadjuvanten Therapie untersucht.1
Die Inklusionskriterien stellen auch den größten Kritikpunkt der Studie dar: Tumoren im oberen oder mittleren Drittel, cT1 bis cT3, cN0 oder cN+, somit auch Tumoren, welche in vielen europäischen Zentren ohne jedwede neoadjuvante Therapie oder lediglich nach Kurzzeit-Radiotherapie einer Operation zugeführt werden. Ziel der Studie war es, die Behandlung zu deeskalieren und auf die Strahlentherapie ohne Beeinträchtigung der klinischen Effektivität zu verzichten.
Die Patient:innen wurden 1:1 randomisiert: zum einen in die Kontrollgruppe mit der Standardtherapie einer neoadjuvanten Langzeit-Chemoradiotherapie, gefolgt von Operation und anschließender adjuvanter Chemotherapie, zum anderen in die experimentelle Gruppe, in der Patient:innen 6 Zyklen FOLFOX erhielten und dann einem Restaging unterzogen wurden. Sofern die Tumoren um ≥20% geschrumpft waren, wurde auf die zusätzliche Chemoradiotherapie verzichtet und die Patient:innen wurden direkt der Operation zugeführt. Bei unzureichendem Ansprechen (<20% Tumorschrumpfung) erhielten sie Chemoradiotherapie gefolgt von der Operation. Patient:innen in beiden Gruppen erhielten eine adjuvante Chemotherapie, aber das Regime und die Anzahl der Zyklen oblagen dem/der behandelnden Arzt/Ärztin.
Das Ziel der Nichtunterlegenheit hinsichtlich der 5-Jahres-Rate des krankheitsfreien Überlebens wurde erreicht (80,8% vs. 78,6%), obwohl nur 9% der Patient:innen im experimentellen Arm eine neoadjuvante Chemoradiotherapie erhielten. Auch in Bezug auf das Gesamtüberleben (HR: 1,04; 95% CI: 0,74–1,44) und die Lokalrezidivrate (HR: 1,18; 95% CI: 0,44–3,16) zeigte sich kein Nachteil im Falle des Verzichts auf die Chemoradiotherapie.
Fazit
Die größte Bedeutung muss dieser Studie für ihren Versuch beigemessen werden, die therapieassoziierte Morbidität zu reduzieren: Bei ansonsten größtenteils ähnlichen Nebenwirkungsraten wurde signifikant weniger sexuelle Dysfunktion 12 und 24 Monate nach Operation in der experimentellen Gruppe berichtet – eine Komplikation, der im klinischen Alltag sicherlich zu wenig Aufmerksamkeit geschenkt wird.
Ob diese Resultate insgesamt den Therapiestandard des lokal fortgeschrittenen Rektumkarzinoms ändern werden, bleibt abzuwarten, insbesondere da eine Risikostratifizierung gemäß Becken-MRI heutzutage als Standard gilt. Patient:innen in der PROSPECT-Studie haben nur teilweise ein derartiges Staging erfahren und die Daten für diese Subgruppe wurden bislang noch nicht berichtet.
Neoadjuvante Chemotherapie beim Kolonkarzinom
Die randomisierte Phase-III-Studie NeoCol untersuchte die Wirksamkeit einer neoadjuvanten Chemotherapie mit 3 Zyklen CAPOX gefolgt von der Resektion im Vergleich zu einer Standardbehandlung mit primärer Resektion bei Patient:innen mit lokal fortgeschrittenem Kolonkarzinom, definiert als cT3 mit >5mm Invasionstiefe oder cT4, cN0-2, cM0 (Staging mittels CT).2 Die Indikation für die adjuvante Chemotherapie wurde in Abhängigkeit vom (y)pTNM-Stadium gestellt.
Die skandinavische Studie rekrutierte von 2013 bis 2019 und konnte hinsichtlich des primären Endpunkts krankheitsfreies Überleben (DFS) nach 2 Jahren keinen signifikanten Unterschied feststellen (p=0,94), ebensowenig wie im Gesamtüberleben (p=0,95).
Mit insgesamt 250 Patient:innen ist diese Studie deutlich kleiner als die ähnlich aufgebaute FoxTROT-Studie mit 1052 Patient:innen, jedoch war auch die FoxTROT-Studie formal negativ: Trotz eines numerischen Vorteils hinsichtlich der DFS-Rate nach 2 Jahren mit 83% im neoadjuvanten/perioperativen Arm vs. 77% im Standardarm konnte das prädefinierte Signifikanzniveau nicht erreicht werden. Insgesamt belegen beide Studien jedoch die Sicherheit der neoadjuvanten Chemotherapie, sowohl in Hinblick auf die perioperativen Komplikationen als auch auf die relevanten klinischen Endpunkte. Im Alltag wird diese Option wohl eher ausgewählten Patient:innen vorbehalten bleiben, welche z.B. aufgrund eines rezenten thromboembolischen Ereignisses nicht zeitnahe einer Operation zugeführt werden können, oder Patient:innen mit cT4-Tumoren, bei welchen eine Multiviszeralresektion erforderlich wäre und die von einem Downstaging profitieren. Die Ungenauigkeit des klinischen Staging beim Kolonkarzinom lässt einen breiteren Einsatz nicht zu, da ein relevantes Risiko für Übertherapie besteht.
T-DXd beeindruckt beim metastasierten HER2+ Kolorektalkarzinom
Auch wenn die Gruppe der HER2+ nur 2–3% aller Kolorektalkarzinome umfasst, findet derzeit der größte therapeutische Fortschritt in dieser Subgruppe statt. Nachdem die Daten der MOUNTAINEER-Studie für die chemotherapiefreie Kombination des Anti-HER2-Antikörpers Trastuzumab und des HER2-Tyrosinkinasehemmers Tucatinib bereits im Jänner 2023 zur FDA-Zulassung geführt hatten, wurden nun am diesjährigen Meeting der ASCO beeindruckende Daten für Trastuzumab Deruxtecan (T-DXd) berichtet.3
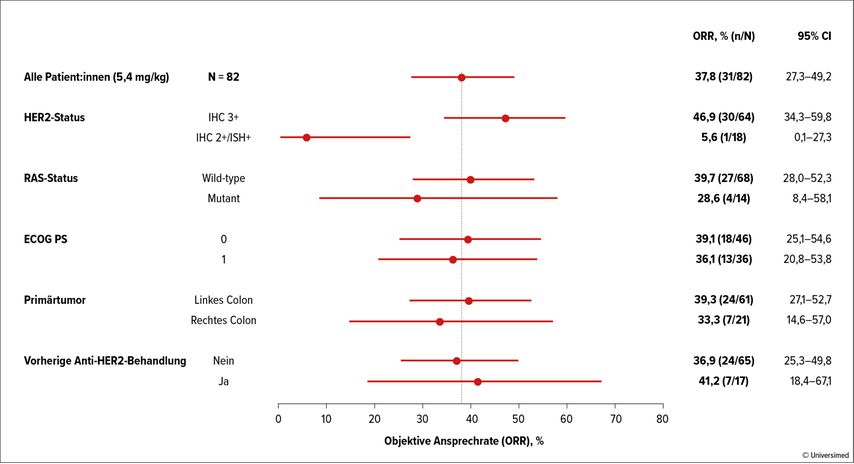
Die internationale randomisierte Phase-II-Studie DESTINY-CRC02 bewertete die Wirksamkeit und Sicherheit von T-DXd bei Patient:innen mit HER2-positivem mCRC (definiert als IHC3+ oder IHC2+/ISH+) in zwei verschiedenen Dosierungen (5,4mg/kg oder 6,4mg/kg; beide Q3W). Die Studie erreichte ihren primären Endpunkt der objektiven Ansprechrate (ORR), mit einer ORR von 37,8% bei 82 Patient:innen, die die niedrigere Dosierung erhielten, und 27,5% bei den 40 Patient:innen, die mit der höheren Dosierung behandelt wurden. Das allgemeine Sicherheitsprofil war konsistent mit den bekannten Profilen von T-DXd, jedoch zeigte sich eine reduzierte Rate von Pneumonitiden in der Gruppe mit der niedrigeren Dosierung.
Mehrere Dinge an dieser Studie sind bemerkenswert: In Zusammenschau mit der bereits berichteten Studie DESTINY-CRC01 scheint im Gegensatz zu anderen Entitäten wie z.B. dem Mammakarzinom die Effektivität von T-DXd beim CRC ausschließlich auf die Gruppe mit IHC3+-Überexpression beschränkt zu sein. Darüber hinaus wurde eine Wirksamkeit von T-DXd auch im Falle von RAS-Mutationen nachgewiesen, die in dieser Studie – im Unterschied zur MOUNTAINEER-Studie – explizit eingeschlossen werden durften. Und zu guter Letzt war T-DXd auch nach einer vorangegangenen anti-HER2-gerichteten Therapie wirksam (Abb. 1).
Unterschätzte Häufigkeit der RAS-Mutation?
Praxistipp
Neue Studienkonzepte untersuchen den Ansatz einer individualisierten Risikostratifizierung beim Kolonkarzinom anhand von postoperativ nachgewiesener ctDNA, um bei ctDNA-Negativität die adjuvante Therapie zu deeskalieren bzw. bei ctDNA-Positivität neue, experimentelle Ansätze zu ermöglichen. In Österreich wird derzeit über die ABCSG an vielen Zentren die CIRCULATE-Studie (NCT04089631) angeboten, welche bei Kolonkarzinom im Stadium II bei postoperativer ctDNA-Positivität in einen Arm mit adjuvanter Chemotherapie oder alleiniger Nachbeobachtung randomisiert.Gleich zwei ASCO-Präsentationen haben sich der Analyse der RAS-Mutation bei metastasierter Erkrankung anhand zirkulierender Tumor-DNA (ctDNA) gewidmet.
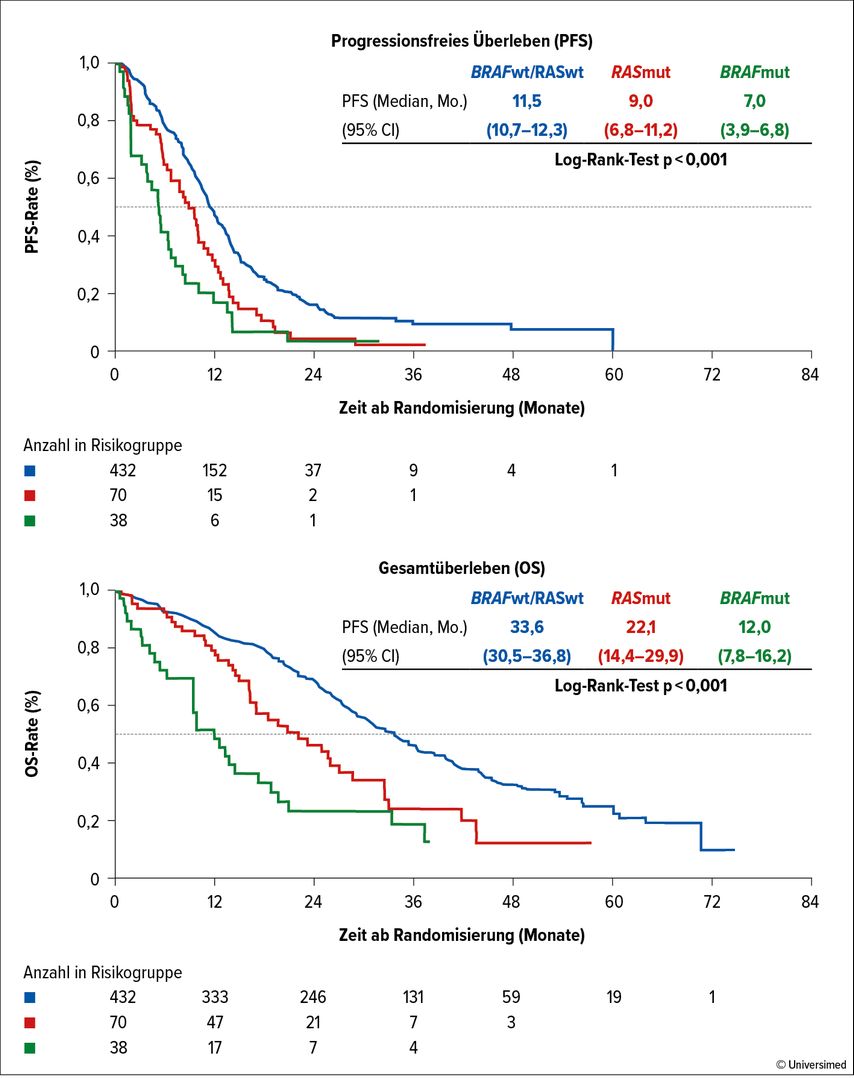
In der randomisierten Phase-III-Studie FIRE-4 wurden Patient:innen mit zuvor unbehandelter Erkrankung mit einer Anti-EGFR(epidermaler Wachstumsfaktor-Rezeptor)-basierten Therapie mit FOLFIRI und Cetuximab behandelt.4 Im experimentellen Arm erfolgte eine sogenannte „Switch-Maintenance“ mit 5-FU/Capecitabin und Bevacizumab, während im Kontrollarm die Therapie bis zum Progress fortgesetzt wurde. Obwohl alle inkludierten Patient:innen in der lokalen Analyse des Tumorgewebes einen RAS-Wildtyp aufweisen mussten, wurde in 12% bzw. 14% der Fälle eine RAS-Mutation in der zentralen ctDNA-Analyse bei Studieneinschluss detektiert. Dies war auch von klinischer Relevanz, denn sowohl das progressionsfreie als auch das Gesamtüberleben waren kürzer bei Vorliegen einer mittels ctDNA detektierten RAS-Mutation (Abb. 2). Zudem wurde gezeigt, dass das Neu-Auftreten einer RAS-Mutation unter laufender Anti-EGFR-Therapie keinen negativen Einfluss auf das progressionsfreie Überleben oder das Gesamtüberleben hatte. Dies überrascht ein wenig angesichts des negativen Einflusses der mittels ctDNA detektierten RAS-Mutation im Falle einer sog. Anti-EGFR-„Rechallenge“ in den späteren Therapielinien, nach zuvor dokumentiertem Ansprechen und dann Fortschreiten auf eine Anti-EGFR-basierte Therapie.
Abb. 2: Effekt der Ausgangs-ctDNA-Analyse auf das progressionsfreie und das Gesamtüberleben in FIRE-4. Modifiziert nach Stintzing S et al.4
Mit der PARADIGM-Studie wurde in einer weiteren randomisierten Phase-III-Studie bei 5,9% bzw. 6,3% der Patient:innen eine RAS-Mutation in der zentralen ctDNA-Analyse bei Studieneinschluss detektiert, obwohl die – hier ebenso zentral durchgeführte – Analyse des Tumorgewebes negativ verlief. Und wiederum wurde ein negativer Effekt der mittels ctDNA detektierten RAS-Mutation auf das progressionsfreie Überlebenund das Gesamtüberleben im Falle einer Anti-EGFR-basierten Erstlinientherapie mit FOLFOX und Panitumumab berichtet.
Literatur:
1 Schrag D et al.: PROSPECT: a randomized phase III trial of neoadjuvant chemoradiation versus neoadjuvant FOLFOX chemotherapy with selective use of chemoradiation, followed by total mesorectal excision (TME) for treatment of locally advanced rectal cancer (LARC) (Alliance N1048). ASCO 2023; Abstr. #LBA2 2 Jensen LH et al.: Phase III randomized clinical trial comparing the efficacy of neoadjuvant chemotherapy and standard treatment in patients with locally advanced colon cancer: the NeoCol trial. ASCO 2023; Abstr. #LBA2 3 Rhagav KPS et al.: Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. ASCO 2023; Abstr. #3501 4 Stintzing S et al.: Phase III FIRE-4 study (AIO KRK-0114): influence of baseline liquid biopsy results in first-line treatment efficacy of FOLFIRI/cetuximab in patients with tissue RAS-WT mCRC. ASCO 2023; Abstr. #3507 5 Yamazaki K et al.: Efficacy of panitumumab in patients with left-sided disease, MSS/MSI-L, and RAS/BRAF WT: a biomarker study of the phase III PARADIGM trial. ASCO 2023; Abstr. #3508
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...