ASH 2020 – Highlights zu den aggressiven Lymphomen
Autor:
Univ.-Prof. Dr. Clemens A. Schmitt
Vorstand Med Campus III
Johannes Kepler Universität
Univ.-Klinik für Hämatologie und Internistische Onkologie
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien, individualisierte Therapieadaptation und Chemotherapie-reduzierte bis -freie Konzepte für vulnerable, vor allem ältere und komorbide Patientenpopulationen, somit sehr bedeutsame Lösungsansätze für die realen Herausforderungen unserer täglichen klinischen Praxis.
Aggressive B-Zell-Lymphome/DLBCL
Zunächst aber zu einer praxisrelevanten Dauerkontroverse, der Hochdosis-Methotrexat(HD-MTX)-Prophylaxe zur Verhinderung metachroner ZNS-Manifestationen bei aggressiven B-Zell-Lymphomen, die insbesondere bei hohem CNS-IPI (also der um die Nieren-/Nebennierenbeteiligung erweiterte IPI)1 aufgrund der ungünstigen Prognose bei ZNS-Beteiligung breit eingesetzt wird. In einer retrospektiven kanadischen Kohortenstudie mit über 900 konsekutiven Patienten mit diffus großzelligem B-Zell-Lymphom (DLBCL) erfüllte etwa ein Drittel Kriterien eines erhöhten ZNS-Risikos (d.h. hoher CNS-IPI, Double-Hit-Lymphom oder testikulärer Befall) und qualifizierte so für zwei Kurse HD-MTX (3,5g/m2 i.v.).2 Tatsächlich erhielten aber zwei Drittel der Patienten diese Therapieerweiterung nicht, wofür mehrheitlich keine Gründe dokumentiert waren. Vor dem Hintergrund einer stark eingeschränkten und womöglich selektionsverzerrt verabreichten HD-MTX-Gabe konnte in dieser Kohorte kein Rückgang der ZNS-Manifestationsrate, verglichen mit Literaturerwartungen bei weitgehendem Verzicht auf eine Prophylaxe,1 verzeichnet werden. Auch in einer retrospektiven US-amerikanischen Kohortenstudie mit über 1000 DLBCL-Patienten mit erhöhtem ZNS-Risiko vermochte eine MTX-Prophylaxe, dort bei etwa einem Fünftel der Patienten als HD-MTX i.v. appliziert, die gemäß CNS-IPI vorausgesagte Rate an ZNS-Manifestationen nicht abzusenken.3 Auch hier blieb offen, nach welchen Kriterien zwischen der mehrheitlich (und weithin für, wenn überhaupt, weniger effektiv gehaltenen) intrathekalen gegenüber einer intravenösen MTX-Gabe entschieden wurde. Interessanterweise fand die kanadische Studie allerdings Hinweise dafür, dass eine konsolidierende Hochdosistherapie mit autologem Stammzellsupport die Rate an ZNS-Rückfällen senken könnte. Kritisch ist also trotz der beachtlichen Größe der beiden retrospektiven Studien festzuhalten, dass Auswahl und Anteil tatsächlich mit HD-MTX prophylaktisch behandelter Patienten zu einer erheblichen Verzerrung geführt haben mögen. Ich wäre persönlich vorsichtig, die Daten als generelle Absage an die Wirksamkeit einer HD-MTX-Prophylaxe zu interpretieren. Auch wird abzuwarten sein, inwieweit die für bestimmte Patientensubgruppen, darunter auch Double-Expressor-Lymphome mit erhöhtem ZNS-Risiko, potenziell interessante Erweiterung von R-CHOP um den Blut-Hirn-Schranken-gängigen BTK-Inhibitor Ibrutinib nicht zu einer Reduktion sekundärer ZNS-Lymphome führen wird, wie diesbezügliche, wenn auch in ihrer Effektstärke eher bescheidene Signale aus der PHOENIX-Studie (R-CHOP ± Ibrutinib) andeuten.4
CAR-T-Zell-Therapie
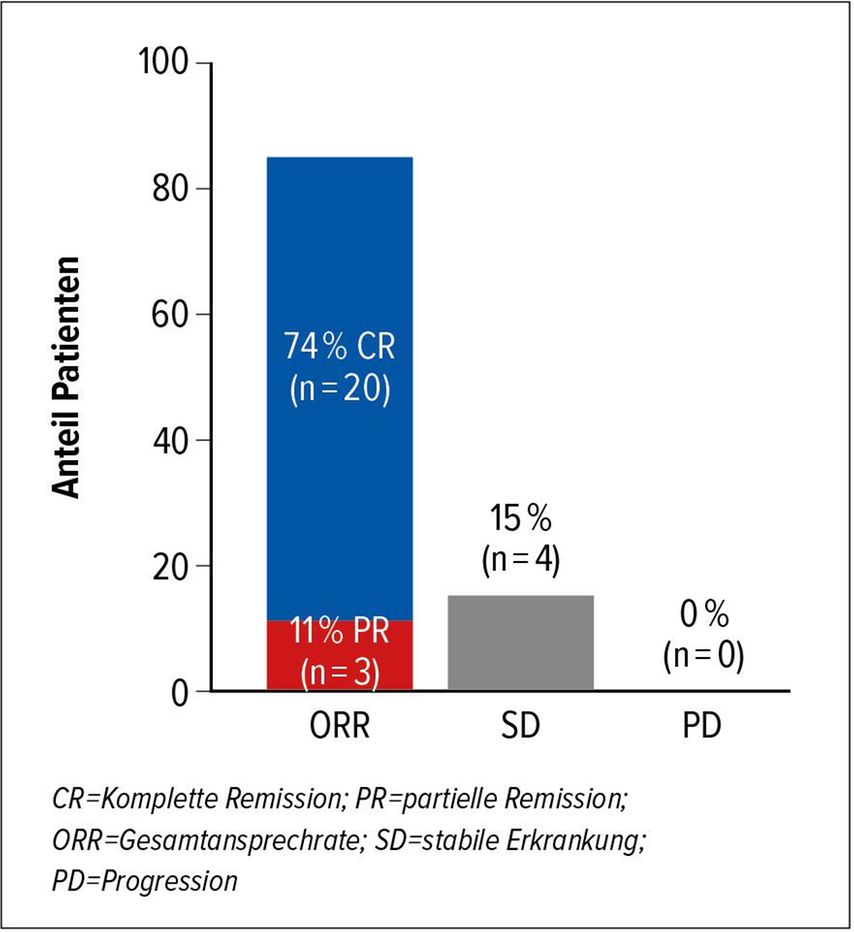
Aus den zahlreichen Abstracts zu zumeist maturierten Responsedaten verschiedener CAR-T-Zell-Produkte möchte ich gerne Daten der ZUMA-12-Studie zu Axicabtagen Ciloleucel als Frühkonsolidierung in der Erstlinie bei Patienten mit positivem Interim-PET sowie Double- oder Triple-Hit-High-Grade-Lymphom bzw. Höher-Risiko-DLBCL (IPI ≥3) vorstellen.5 Knapp drei Viertel der eingeschlossenen 27 Patienten erzielten eine mehrheitlich auch anhaltende CR, wobei kein „cytokine-release syndrome“ (CRS) vom Grad 3/4 und bei 25% Grad-3/4-Neurotoxizität auftraten. Für diese vermeintlich „Hardtocure“-Patientenpopulation stellt dieser frühzeitige „Chemo-zu-Immun-Angriff“-Therapiewechsel eine vielversprechende Strategie dar. Allerdings darf nicht übersehen werden, dass auch eine R-CHO(E)P-basierte Standardtherapie einen großen Teil dieser Risikopatienten heilt – und dies vermutlich auch zu einem guten Teil bei der sehr früh erfassten Post-Zyklus-2-Interim-PET-Positivität. Gerade Patienten mit sehr ausgedehnter Bulk-Lymphomlast mögen biologisch gut ansprechen, sind aber nach nur zwei Induktionskursen einfach noch nicht PET-negativ und würden so potenziell unnötig einer ungleich aufwendigeren und teuren CAR-T-Zell-Therapie zugeführt.
Bispezifische Antikörper
Einen regelrechten Boom gab es bei den bispezifischen CD20xCD3-Antikörpern; hier wurden neue Daten zu Mosunetuzumab, Glofitamab, Odronextamab und Epcoritamab vorgestellt.6–9 Gemeinsam ist diesen, dass die Formulierung als Voll-Antikörper (im Gegensatz zu kleinen Single-Chain-Antikörpern) die Verabreichung im Wochen- bis mehrwöchigen Intervall ermöglicht. Intensiv vorbehandelte Patienten mit rezidiviertem/refraktärem (R/R) DLBCL erreichen so Gesamtansprechraten von 50–70%, mit Raten an kompletten Remissionen (CR) um 30–45%, wobei die Dauer des Ansprechens zwischen diesen frühen Studien stark schwankt und vermutlich dosisabhängig ist. Ob eine partielle Remission (PR) als ähnlich ungünstig wie bei CAR-T-Zellen einzuschätzen ist, muss noch abgewartet werden. „Cytokine-release syndrome“ (CRS) bzw. neurologische Ereignisse ≥Grad 3 wurden kaum beobachtet. Ein wichtiges Thema sind Bestrebungen, die Verträglichkeit durch schrittweise Aufdosierung, Subkutanformulierung, Anti-CD20-Vortherapie oder Steroid-/Tocilizumab-Gabe zu steigern. Besonders herausstellen möchte ich ein Abstract zu Mosunetuzumab als Single-Agent-Erstlinientherapie für ältere, in ihrer allgemeinen Fitness reduzierte DLBCL-Patienten, die entweder über 80 Jahre alt waren oder als mindestens 60-Jährige zusätzliche Einschränkungen in den Alltagsaktivitäten oder Ausschlusskriterien für eine Chemo-Immuntherapie aufweisen mussten.9 Die auswertbaren 29 Patienten vertrugen den bispezifischen Antikörper mit sehr überschaubarem Toxizitätsprofil, insbesondere hinsichtlich der Frequenz durchwegs milder CRS-Ereignisse. Recht beeindruckend waren in der Zusammenschau zweier Dosisstufen eine CR-Rate von knapp 50% mit ausnahmslos anhaltenden Responses, zum Teil bereits jenseits der aktiven Therapiephase von i.d.R. acht Zyklen. Für eine Bewertung des progressionsfreien Überlebens (PFS) sowie des Gesamtüberlebens (OS) und damit eine Wirksamkeitsabschätzung im Vergleich zu den hier relevanten Standard- bzw. Alternativoptionen R-miniCHOP oder R-Bendamustin ist die Datenlage dieser reinen Immun-Erstlinientherapie noch zu unreif.
Checkpoint-Inhibitoren
Immuncheckpoint-Inhibition hat beim DLBCL aufgrund bescheidener Ergebnisse im R/R-Setting bisher keinen klaren Stellenwert. Ein Phase-II-Studien-Update zur R-CHOP-Erweiterung um den PD-1-Blocker Pembrolizumab in der Erstlinie einer kleinen (30 Patienten) Höher-Risiko-Population (mit 73% Erkrankungen im Stadium III/IV) lieferte nun mit einem medianen Follow-up von 32 Monaten eine 3-Jahres-PFS-Rate von 73%, damit deutlich besser als der Vergleichswert der GOYA-Studie (CHOP plus Rituximab oder Obinutuzumab für IPI ≥2).10,11 Interessant war die „Sandwich-Sequenzierung“ einer R-CHOP-Induktion mit Vor- und Nachschaltung des PD-L1-Blockers Avelumab (plus Rituximab in der Initialphase).12 Basierend nicht nur auf Checkpoint-Blockade, sondern womöglich direkter ADCC-Auslösung an L1-exprimierenden Lymphomzellen erreichte bereits alleinig die chemofreie Initialphase von zwei Zyklen „Doppel-Immuntherapie“ in der kleinen und sicher eher günstigen Studienpopulation von 28 Patienten ein Gesamtansprechen von 60% und eine PET-negative CR von 21%. Man darf gespannt sein, inwieweit zukünftige Studien diesen Ansatz für Chemotherapie-ineligible Patienten aufgreifen und bei PET2-Respondern das chemofreie Avelumab/Rituximab-Konzept fortführen.
Abb. 1: Ansprechraten unter Erstlinientherapie mit Axicabtagen Ciloleucel in der ZUMA-12-Studie (nach Neelapu SS et al.)5
Hodgkin-Lymphom
Bei den Hodgkin-Lymphomen im fortgeschrittenen Stadium gab es ein aus BEACOPP-gewohnter Sicht wichtiges Update der LYSA-AHL2011-Studie zur Doppel-PET-gesteuerten Therapieeskalation oder -deeskalation. Wir deeskalieren ja seit der HD18-Studie der Deutschen Hodgkin-Studiengruppe (GHSG) PET2-Negative auf nur noch zwei weitere Zyklen BEACOPP, wodurch für PET2-Positive wie -Negative kaum unterscheidbare exzellente 5-Jahres-Gesamtüberlebensraten um 95% erzielt werden.13 Das französische AHL2011-Vorgehen sah nun vor, bei PET2-Negativität nicht etwa die Zahl der BEACOPP-Zyklen, sondern auf volle vier weitere Kurse, allerdings mit ABVD, zu deeskalieren.14 Des Weiteren entschied sich in einem erneuten Interim-PET nach vier Zyklen, ob die sechs Therapiezyklen zu Ende geführt oder ob bei PET4-Positivität bereits nach vier Kursen auf eine Salvage-Therapie gewechselt werden soll. Zwischen Standard-Arm (6x BEACOPP-eskaliert) und PET-gesteuerter Therapie gab es im Outcome keinen Unterschied, wobei im Standardarm weniger Lymphom-, dafür aber mehr Toxizitäts-bedingte Todesfälle auftraten. Wichtig ist die im PET-Arm verzeichnete deutlich besser erhaltene männliche Fertilität. In der französischen Studie unterschieden sich allerdings Patienten mit PET2-Negativität versus PET2-Positivität (aber PET4-Negativität) im 5-Jahres-Gesamtüberleben schon (98,2 vs. 93,5%), was im Interstudien-Vergleich mit der GHSG-HD18 überrascht, da dieser Unterschied bei PET4-Negativität auch nicht über eine potenziell in der LYSA-Studie unterbliebene Nachbestrahlung erklärbar ist. Bemerkenswerterweise erzielten die als besonders ungünstig einzuschätzenden, da chemorefraktären PET4-Positiven mit der frühzeitigen Salvage-Strategie – also Nicht-Komplettierung von 6 Kursen BEACOPP-eskaliert und Verzicht auf Nachbestrahlung bei etwaigem Restbefund – noch eine 5-Jahres-OS-Rate von 91,9%.
Antikörper-Wirkstoff-Konjugate
Interessante, auf Brentuximab Vedotin (BV) basierte Ansätze in der Erstlinie wurden für ältere Hodgkin-Patienten präsentiert, für die ja BEACOPP keine Option, Bleomycin nicht selten zu toxisch und Anthrazykline oft kardial nicht möglich sind. Mit der ECHELON-1-Studie ist ja das Anti-CD30-Antikörper-Drug-Konjugat BV als Option in die Erstlinie vorgerückt, allerdings in Kombination mit AVD (Doxorubicin, Vinblastin und Dacarbazin). Beim ASH-Meeting 2020 wurden nun neben der BV-Monotherapie Zweierkombinationen mit Dacarbazin, Bendamustin oder Nivolumab präsentiert.15 Während sich BV/Bendamustin als zu toxisch erwies, erzielten die anderen Arme bei medianem Patientenalter von 69–78 Jahren und durchwegs hohem Anteil an Stadium-III/IV-Erkrankungen (62–80%) CR-Raten von 72% und mehr. Unter den Toxizitäten war erwartungsgemäß die periphere Polyneuropathie prominent und bei nicht wenigen Patienten (20–38%)auch Abbruchgrund. Bemerkenswert sind allerdings Gesamtüberlebensraten im Sinne eines 3-Jahres-Überlebens für BV-mono von 73%, für BV-DTIC von 94% und für BV-Nivolumab von 84% – verglichen mit 67% bei dem Polychemotherapie-basierten GHSG Elderly-Protokoll PVAG (Prednison, Vincristin, Adriamycin und Gemcitabin).16 Die herausragende Effektivität bei besonders günstigem Toxizitätsprofil machen insbesondere die BV-Dacarbazin-Kombination zu einem attraktiven Schema für diese Patientengruppe.
Salvage-Optimierung vor Hochdosistherapie
Für die klinische Praxis gleichfalls relevant war eine Arbeit vom Memorial Sloan Kettering Cancer Center zur Salvage-Optimierung beim Hodgkin-Lymphom vor geplanter Hochdosistherapie.17 Unter der Maßgabe eines Brentuximab-freien (da in ausgewählten Settings ja womöglich in der Erstlinie bereits eingesetzt), möglichst wenig toxischen Chemo-Backbones (verglichen mit platinhaltigen Regimen wie DHAP oder ICE) wurde GVD (Gemcitabin, Vinorelbin und liposomales Doxorubicin) ausgewählt und mit dem PD-1-Blocker Pembrolizumab kombiniert. Ziel war eine PET-negative CR (CMR) nach möglichst kurzer Therapiedauer. Tatsächlich erreichten dies 92% der 37 evaluierbaren Patienten nach nur zwei Zyklen Pembrolizumab-GVD; weitere drei Patienten nach vier Zyklen (also insgesamt 95% CMR). Nahezu alle Patienten wurden in der Folge Hochdosis-therapiert; ein Drittel dieser erhielt dann in Analogie zur AETHERA-Studie eine Konsolidierung mit BV.18 Als interessantes Nachfolge-Studienkonzept verfolgt die New Yorker Gruppe nun die Idee, die Pembrolizumab-GVD-Salvage-Therapie mit einer Pembrolizumab-Erhaltung zu extendieren, um so auf die Hochdosistherapie mit autologem Stammzellsupport gänzlich zu verzichten.
Die AETHERA-Studie beim R/R Hodgkin-Lymphom war auch Grundlage für einen Ansatz, bei analogen Ausgangskriterien – dem Vorliegen mindestens eines AETHERA-Risikofaktors (primär refraktär, Rezidiv in weniger als 12 Monaten, keine CR nach Salvage-Therapie, Extranodalbefall, B-Symptomatik beim Rückfall oder mindestens zwei Salvage-Therapien)18 – nach erfolgter Hochdosistherapie eine Konsolidierung anzubieten, jedoch hier in Form einer BV-Nivolumab-Kombination.19 Eine vorausgegangene Exposition, allerdings nicht Refraktärität gegenüber BV oder Nivolumab, war zulässig. Mit einer 19-Monats-PFS-Rate von 92% war dieses an 59 Patienten geprüfte Vorgehen klar besser als die 18-Monats-PFS-Rate von 65% der AETHERA-Studie. Diese Ergebnisse blieben auch nach Auflösung bzgl. eines, zweier oder dreier Risikofaktoren immer noch stabil bzw. hoch (93%, 96% und 83%). Die 19-Monats-Gesamtüberlebensrate von 98% ist überragend, wenngleich hier, wie auch bei der Pembrolizumab-GVD-Studie, zu bedenken ist, dass all diese R/R-Fälle Versagen nach ABVD-, nicht BEACOPP-basierter Induktion repräsentieren und somit ein vergleichsweise gutes Ansprechen auf die Salvage-Therapie zeigen sollten. Bemerkenswert ist allerdings auch die hohe Rate von 27% an Steroid-pflichtigen Immun-Ereignissen, sodass die Autoren über ein Folgekonzept nachdenken, in dem nicht eine BV-Nivolumab-Kombination, sondern eher eine BV-Nivolumab-Sequenz verabreicht werden soll.
Fazit
Zusammenfassend ist festzuhalten, dass neue Immuntherapeutika (CAR-T-Zellen, bispezifische Antikörper, ADCs) in ausgewählten Patientenpopulationen nunmehr mit überzeugenden Signalen in die chemoreduzierte oder gar chemofreie Erstlinie drängen. Unterschiedliche, potenziell synergistische Therapieprinzipien werden nicht nur miteinander kombiniert, sondern in Sequenz (bspw. Immun-Checkpoint-Blocker als Priming/Maintenance-Sandwich-Konzept) intelligent komponiert. Individualisierte Dosisadaptation (bspw. mittels PET- oder molekularer „liquid biopsy“-basierter Steuerung) in beiderlei Richtung, auch hinsichtlich frühzeitiger Therapiewechsel, wird ein immer wichtigeres Prinzip. Und so sind in diesem Sinne lange etablierte Standards dann doch nicht notwendigerweise für die Ewigkeit gemacht, wie das Wanken der HD-MTX-Prophylaxe oder das Infragestellen eines R-CHOP-Induktions-Dogmas andeutungsweise erahnen lassen.
Literatur:
1 Schmitz N et al.: CNS International Prognostic Index: Arisk model for CNS relapse in patients with diffuse large B-cell lymphoma treated with R-CHOP. J Clin Oncol 2016; 34: 3150-56 2 Puckrin B et al.: Lack of effectiveness of intravenous high-dose methotrexate for prevention of CNS relapse in patients with high-risk DLBCL: a retrospective analysis from Alberta, Canada. ASH 2020; Abstr. #477 3 Orellana-Noia VM et al.: CNS prophylaxis during front-line therapy in aggressive non-hodgkin lymphomas: real-world outcomes and practice patterns from 19 US Academic Institutions. ASH 2020; Abstr. #478 4 Younes A et al.: Randomized phase III trial of ibrutinib and rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone in non-germinal center B-cell diffuse large B-cell lymphoma. J Clin Oncol 2019; 37: 1285-95 5 Neelapu SS et al.: Interim analysis of ZUMA-12: a phase 2 study of axicabtagene ciloleucel (axi-cel) as first-line therapy in patients (pts) with high-risk large B cell lymphoma (LBCL). ASH 2020; Abstr. #405 6 Bannerji R et al.: Odronextamab (REGN1979), a human CD20 x CD3 bispecific antibody, induces durable, complete responses in patients with highly refractory B-cell non-hodgkin lymphoma, including patients refractory to CAR T therapy. ASH 2020; Abstr. #400 7 Olszeweski AJ et al.: Single-agent mosunetuzumab is a promising safe and efficacious chemotherapy-free regimen for elderly/unfit patients with previously untreated diffuse large B-cell lymphoma. ASH 2020; Abstr. #401 8 Hutchings M et al.: Subcutaneous epcoritamab induces complete responses with an encouraging safety profile across relapsed/refractory B-cell non-hodgkin lymphoma subtypes, including patients with prior CAR-T therapy: updated dose escalation data. ASH 2020; Abstr. #402 9 Hutchings M et al.: Glofitamab step-up dosing induces high response rates in patients with hard-to-treat refractory or relapsed non-hodgkin lymphoma. ASH 2020; Abstr. #403 10 Vitolo U et al.: Obinutuzumab or rituximab plus cyclophosphamide, doxorubicin, vincristine and prednisone in previously untreated diffuse large B-cell lymphoma. J Clin Oncol 2017; 35, 3529-37 11 Smith SD et al.: Pembrolizumab with R-CHOP in previously untreated diffuse large B-cell lymphoma: long term follow up and analysis of the mechanism of PDL-1 tumor expression. ASH 2020; Abstr. #2111 12 Hawkes EA et al.: Safety and efficacy of induction and maintenance avelumab plus R-CHOP in patients with diffuse large B-cell lymphoma (DLBCL): analysis of the phase II Avr-CHOP study. ASH 2020; Abstr. #597 13 Borchmann P et al.: PET-guided treatment in patients with advanced-stage Hodgkin’s lymphoma (HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet 2018; 390: 2790-802 14 Casasnova O et al.: PET-guided strategy improves the safety of BEACOPP-based treatment in advanced hodgkin lymphoma: prolonged follow-up of the Lysa Ahl 2011 phase 3 study. ASH 2020; Abstr. #475 15 Yasenchak CA et al.: Frontline brentuximab vedotin as monotherapy or in combination for older hodgkin lymphoma patients. ASH 2020; Abstr. #471 16 Böll B et al.: Phase 2 study of PVAG (prednisone, vinblastine, doxorubicin, gemcitabine) in elderly patients with early unfavorable or advanced stage Hodgkin lymphoma. Blood 2011; 118: 6292-98 17 Moskowitz A et al.: Phase II study of pembrolizumab plus GVD as second-line therapy for relapsed or refractory classical hodgkin lymphoma. ASH 2020; Abstr. #470 18 Moskowitz C et al.: Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapse or progression (AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015; 385: 1853-62 19 Herrera-AF et al.: Consolidation with nivolumab and brentuximab vedotin after autologous hematopoietic cell transplantation in patients with high-risk hodgkin lymphoma. ASH 2020; Abstr. #472
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Adjuvantes Osimertinib reduziert ZNS-Rezidive bei EGFR-mutierter Erkrankung
Etwa 30% der Patienten mit nicht kleinzelligem Lungenkarzinom (NSCLC) präsentieren sich mit resezierbarer Erkrankung und werden einer kurativen Operation unterzogen. Viele Patienten ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...