Zielgerichtete Therapie mit IDH-Inhibitoren: Studienlage und klinischer Einsatz
Autor:
Prof. Dr. med. Andreas Hottinger, MD, PhD
Gründungsdirektor des Zentrums für Hirn- und Wirbelsäulentumore, CHUV
Leiter der Neuroonkologie
Centre Hospitalier Universitaire Vaudois, CHUV, Lausanne
E-Mail: andreas.hottinger@chuv.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Niedriggradige Gliome (LGG) sind eine heterogene Gruppe primärer Hirntumoren, die der WHO-Grad-2-Kategorie zugeordnet werden und Astrozytome sowie Oligodendrogliome umfassen. Sie treten überwiegend bei jüngeren Erwachsenen auf und machen etwa 17–22% aller primären Hirntumoren aus. Mit einer Inzidenz von 0,15–0,5 pro 100000 Einwohner:innen werden in der Schweiz jährlich etwa 20–40 neue Fälle diagnostiziert. Trotz ihrer grundsätzlich unheilbaren Natur können LGG über Jahre hinweg stabil bleiben, ein langsames Wachstum zeigen oder im Verlauf der Erkrankung zu aggressiveren Gliomen fortschreiten. Das mediane Überleben von Patient:innen mit IDH-mutierten Gliomen liegt, abhängig von Faktoren wie Histologie, Grad, Tumorlokalisation und molekularen Eigenschaften, zwischen fünf und 15 Jahren.
IDH-Mutationen bei LGG
Die Entdeckung von Mutationen im Gen der Isocitrat-Dehydrogenase (IDH) als Schlüsselfaktor der Tumorentstehung hat das Verständnis von niedriggradigen Gliomen (LGG), deren Prognose und Therapieansätzen entscheidend verändert.
Seit der WHO-Klassifikation von 2021 sind IDH-Mutationen eine notwendige molekulare Komponente bei der Diagnose von Oligodendrogliomen und Astrozytomen der WHO-Grade 2 oder 3. Über 80% dieser Mutationen betreffen den Aminosäureaustausch R132H im IDH1-Gen. Selten werden Mutationen an anderen Stellen von IDH1 oder im IDH2-Gen festgestellt. Die mutierten IDH-Enzyme wandeln α-Ketoglutarat (α-KG) in den Onkometaboliten D-2-Hydroxyglutarat (D-2HG) um. Die Anhäufung von D-2HG stört den normalen Zellstoffwechsel und die epigenetische Regulation durch Hemmung α-KG-abhängiger Enzyme wie Histon-Demethylasen und DNA-Reparatur-Enzyme. Diese epigenetische Umprogrammierung trägt zur Tumorentstehung und -progression bei.
IDH-Mutationen haben wichtige klinische Implikationen:
-
Patient:innen mit IDH-mutierten LGG haben eine bessere Prognose im Vergleich zu jenen mit IDH-Wildtyp-Gliomen.
-
Tumoren ohne IDH-Mutationen werden als Glioblastome klassifiziert, unabhängig von ihrer histopathologischen Erscheinung.
-
IDH-Mutationen sind mit charakteristischen genetischen Begleitveränderungen wie der 1p/19q-Kodeletion (bei Oligodendrogliomen) oder TP53-Mutationen (bei Astrozytomen) assoziiert.
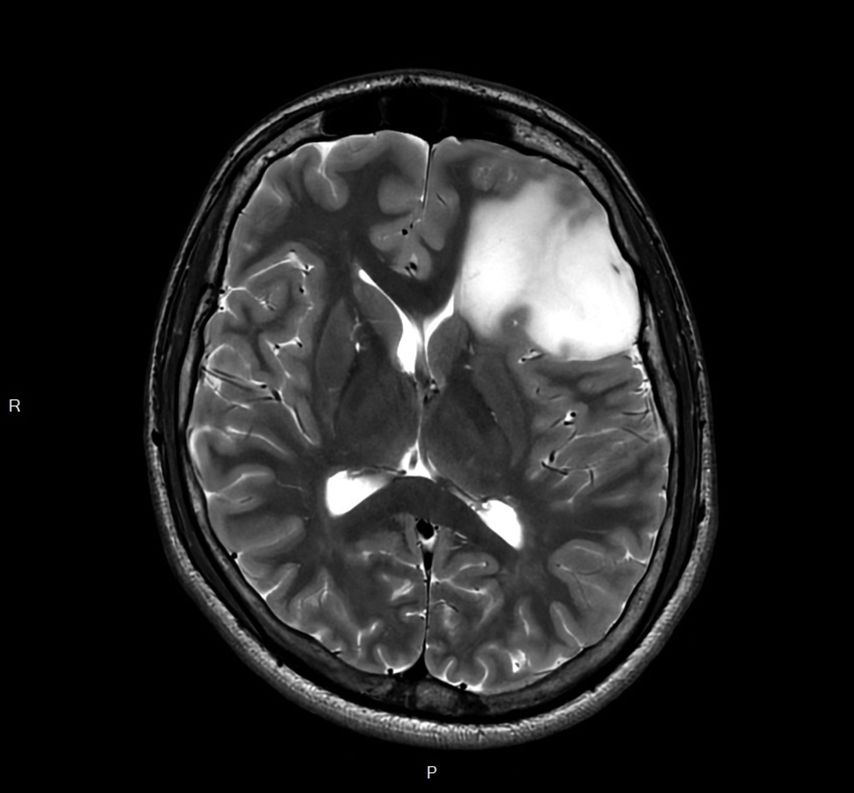
Abb. 1: MRT-Bild eines Astrozytoms vom WHO-Grad 2 im linken Frontallappen. T2-Sequenz
IDH-Inhibitoren
Die Erkenntnis, dass IDH-Mutationen zentrale Treiber der LGG-Entstehung sind, hat die Entwicklung gezielter Therapien wie jener mit IDH-Inhibitoren ermöglicht. Diese Inhibitoren hemmen die abnormale Aktivität des mutierten IDH-Enzyms, blockieren die D-2HG-Produktion und stellen normale zelluläre sowie epigenetische Funktionen wieder her.
Zu den entwickelten IDH-Inhibitoren zählen Ivosidenib und Enasidenib, die bereits für die Behandlung der IDH-mutierten akuten myeloischen Leukämie seit Jahren zugelassen sind. In präklinischen Studien zu LGG senkten IDH-Inhibitoren die D-2HG-Spiegel, verbesserten die enzymatische Aktivität und beeinflussten die Proliferation sowie Differenzierung von Gliomzellen positiv.
Klinische Studien zu IDH-Inhibitoren bei LGG
Der IDH1/IDH2-Inhibitor Vorasidenib, der speziell zur Überwindung der Blut-Hirn-Schranke entwickelt wurde, ist der am intensivsten untersuchte Wirkstoff bei LGG. In frühen klinischen Studien zeigte sich Vorasidenib als sicher und gut verträglich, wobei Leberenzymstörungen die häufigste Nebenwirkung darstellten (bei ca. 18% der Patient:innen).
Die Phase-III-Studie INDIGOuntersuchte Vorasidenib bei 331 Patient:innen mit WHO-Grad-2-LGG, die zuvor für mindestens ein Jahr nach Chirurgie keine Strahlentherapie oder Chemotherapie erhalten hatten. Die Ergebnisse zeigten:
-
progressionsfreies Überleben: 27,7 Monate (Vorasidenib) vs. 11,1 Monate (Placebo); HR: 0,39; 95% CI: 0,27–0,56; p=0,000000067. Es muss betont werden, dass die radiologische Progression im Blindverfahren durch unabhängige Neuroradiolog:innen durchgeführt wurde.
-
«time to next intervention» (TTNI): nicht erreicht (Vorasidenib) vs. 17,4 Monate (Placebo); HR: 0,26; 95% CI: 0,15–0,43; p=0,000000019). Diese stellt die Beurteilung der Progression durch die behandelnden Ärzt:innen dar.
Korrelative Studien ergaben ausserdem, dass die Lebensqualität in beiden Gruppen identisch war und die Patient:innen eine hohe Funktionalität beibehielten. Die Häufigkeit von Krampfanfällen war ebenfalls geringer bei Patient:innen, die Vorasidenib erhielten. Es muss betont werden, dass noch keine Daten zum Überleben der Patient:innen zur Verfügung stehen.
Diese Ergebnisse führten zur Zulassung von Vorasidenib für Patient:innen mit LGG durch die amerikanische FDA und durch Swissmedic (Dezember 2024). Es ist nun wichtig, zu verstehen, wie diese neue Behandlungsmodalität mit den klassischen Ansätzen kombiniert werden kann. Dies ist insbesondere relevant, da die Einschlusskriterien der INDIGO-Studie und früherer Studien zu LGG unterschiedliche Patient:innenkategorien abdeckten.
Behandlung von Patient:innen mitniedriggradigen Gliomen
Die Therapie von LGG erfordert einen multidisziplinären Ansatz. Die Wahl der optimalen Behandlung hängt von Tumorgrösse, Lage, molekularem Profil und vom Allgemeinzustand der Patient:innen ab.
Eine Kombination aus Strahlentherapie und Chemotherapie (PCV) hat sich in einer Phase-III-Studie, die Patient:innen mit als «hochriskant» definierten LGG einschloss (alle Patient:innen über 40 Jahre oder mit unvollständiger Resektion), als überlegen gegenüber einer alleinigen Strahlentherapie erwiesen. Dies führte dazu, dass die Mehrheit der Patient:innen nach einer neurochirurgischen Entfernung des Tumors mit kombinierter Strahlen- und Chemotherapie behandelt wurde, obwohl die Behandlung mit einem Risiko für langfristige Nebenwirkungen, einschliesslich neurokognitiver Beeinträchtigungen, verbunden ist.
Die INDIGO-Studie zeigte, dass bei ausgewählten Patient:innen Vorasidenib den Einsatz von Strahlen- und Chemotherapie verzögern kann. Es sollte insbesondere Patient:innen mit WHO-Grad-2-LGG angeboten werden, deren Tumoren nicht sofort mit Strahlen- und Chemotherapie behandelt werden müssen. Dazu gehören Patient:innen mit nachgewiesen langsam wachsendem Tumor und Patient:innen mit grossen, nicht wachsenden Tumoren oder mit Tumoren, die nicht vollständig entfernt werden können und bei Progression neurologische Defizite verursachen könnten.
Patient:innen mit signifikanten neurologischen Defiziten, die durch das LGG verursacht werden, sollten im Allgemeinen für eine sofortige Strahlen- und Chemotherapie in Betracht gezogen werden, da unter Vorasidenib langsame Reaktionen beobachtet wurden und das Risiko einer weiteren neurologischen Verschlechterung besteht. Es bleibt ebenfalls ungeklärt, ob Patient:innen, bei denen nach dem chirurgischen Eingriff kein Resttumor vorhanden ist, auch mit Vorasidenib behandelt werden sollten.
Fazit
Die Ergebnisse der INDIGO-Studie markieren einen bedeutenden Fortschritt in der Behandlung von IDH-mutierten niedriggradigen Gliomen. Vorasidenib ermöglicht es, aggressive Therapien bei ausgewählten Patient:innen signifikant zu verzögern, und könnte einen neuen Therapiestandard darstellen. Zukünftige Studien müssen jedoch klären, wie diese Therapie mit bestehenden Ansätzen kombiniert werden kann, um die bestmöglichen Ergebnisse zu erzielen.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...