XPO1: Biomarker und therapeutisches Target mit Potenzial
Autor:innen:
Rebecca Gruber,MSc
Universitätsassistentin (Praedoc)
Abteilung für Hämatologie und Onkologie
Comprehensive Cancer Center Innsbruck (CCCI)
Medizinische Universität Innsbruck (MUI)
E-Mail: rebecca.gruber@i-med.ac.at
Priv.-Doz. Dr. Andreas Seeber, PhD
Abteilung für Hämatologie und Onkologie
Comprehensive Cancer Center Innsbruck (CCCI)
Medizinische Universität Innsbruck (MUI)
Abteilung für Onkologie, Hämatologie und Palliativmedizin
Klinik Oberwart
E-Mail: a.seeber@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das duktale Adenokarzinom des Pankreas (PDAC) zählt zu den aggressivsten Tumoren weltweit – mit einer Inzidenz nahe der Mortalität. Späte Diagnose, hohe Tumorheterogenität und rasche Entwicklung von Chemoresistenzen begrenzen die Wirksamkeit bisheriger Therapien. Neue molekulare Zielstrukturen wie Exportin-1 (XPO1) rücken deshalb in den Fokus von Forschung und klinischer Entwicklung.
Keypoints
-
XPO1 ist ein Schlüsselprotein im Transport zwischen Zellkern und Zytoplasma und spielt eine zentrale Rolle in der Tumorbiologie.
-
Seine Überexpression im PDAC ist mit schlechter Prognose, Therapieresistenz und aggressivem Tumorverhalten assoziiert.
-
Der XPO1-Inhibitor Selinexor zeigt in präklinischen Modellen und ersten klinischen Studien vielversprechende Ergebnisse.
-
Kombinationsstrategien mit Chemotherapie und Immuncheckpoint-Inhibitoren könnten das therapeutische Potenzial weiter steigern.
XPO1 im Pankreaskarzinom: Biologie und Biomarkerpotenzial
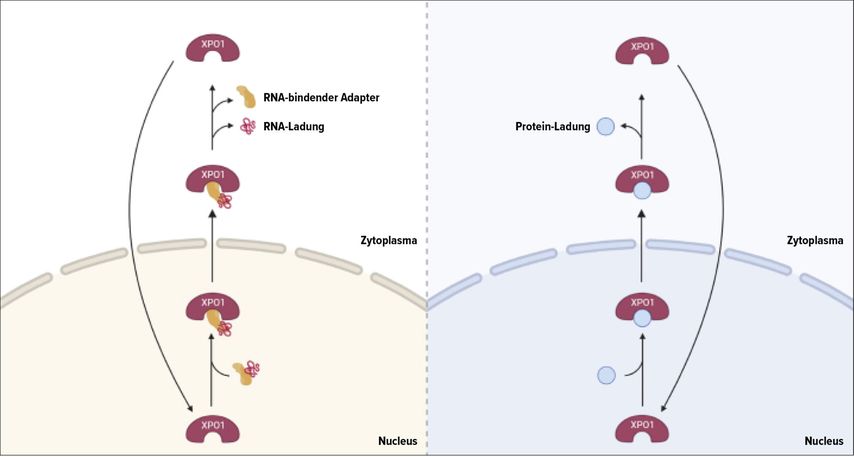
In eukaryotischen Zellen erfolgt der Transport kleiner Moleküle passiv durch die Kernmembran, während größere Moleküle einen aktiven Transportmechanismus benötigen.1 XPO1 ist ein zentraler Exportrezeptor für zahlreiche Proteine und RNA mit nukleärem Export-Signal (NES), darunter auch Tumorsuppressorproteine (TSP; Abb.1).2,3 Eine Überexpression von XPO1 führt zur vermehrten zytoplasmatischen Lokalisation und zur funktionellen Inaktivierung. Dies wird mit aggressivem Tumorverhalten, Chemoresistenz und ungünstiger Prognose bei soliden Tumoren, einschließlich PDAC, in Verbindung gebracht.4–6
Abb. 1: Transportmechanismus des XPO1-vermittelten Kernexports von RNA-Molekülen (links) und Proteinen (rechts; modifiziert nach Sokolova V et al.)3
Bereits vor 15 Jahren wurde eine signifikante Überexpression von XPO1 in PDAC im Vergleich zu gesundem Gewebe beschrieben. Genexpressionsanalysen und immunhistochemische Analysen zeigen eine Korrelation hoher XPO1-Level mit fortgeschrittener Tumorgröße, Lymphknotenbefall, Metastasierung und signifikant verkürztem Gesamtüberleben.7 Diese Korrelationen wurden von mehreren Studien bestätigt.8–11 Damit könnte XPO1 als prognostischer und prädiktiver Biomarker dienen – etwa zur Identifikation therapieempfänglicher Subgruppen von Patient:innen, die von einer XPO1-Inhibition besonders profitieren könnten.
Therapeutische Inhibition von XPO1
Die pharmakologische XPO1-Inhibition erweist sich in präklinischen Studien zu soliden und hämatologischen Tumoren als vielversprechend.12–17 Nur wenige Substanzen aus der Klasse der selektiven Inhibitoren nukleärer Exportproteine (SINE) wurden bislang in klinische Studien überführt. Am besten untersucht ist Selinexor (KPT-330), ein oral verfügbarer XPO1-Inhibitor, der TSP im Zellkern akkumuliert und die Apoptose induziert.18 Dieser Wirkmechanismus führte zur Zulassung durch FDA und EMA für rezidiviertes/refraktäres multiples Myelom sowie durch die FDA für refraktäres DLBCL.19,20
Auch im PDAC zeigte Selinexor in präklinischen Modellen eine signifikante Tumorwachstumshemmung und synergistische Effekte mit Gemcitabin und Nab-Paclitaxel ohne zusätzliche Toxizität.15,21–23 In einer Phase-I-Studie (NCT02178436) erreichte die Kombinationstherapie bei neun Patient:innen zwei partielle Remissionen oder stabile Verläufe.15 Eine laufende Phase-Ib-Studie (NCT02419495) untersucht Selinexor in Kombination mit Chemo- oder Immuntherapie bei soliden Tumoren, bislang jedoch mit wenigen PDAC-Fällen.
Ob sich daraus ein relevanter Fortschritt für die Therapie dieser aggressiven Tumorentität ergibt, bleibt offen – doch die Integration von XPO1-Inhibition könnte einen neuen Weg in der personalisierten Onkologie markieren.
Literatur:
1 Görlich D, Mattaj IW: Nucleocytoplasmic transport. Science 1996; 271(5255): 1513-8 2 Soniat M, Chook YM: Nuclear localization signals for four distinct karyopherin-beta nuclear import systems. Biochem J 2015; 468(3): 353-62 3 Sokolova V et al.: Prognostic and functional role of the nuclear export receptor 1 (XPO1) in gastrointestinal cancers: a potential novel target? Mol Biol Rep 2024; 52(1): 87 4 Azizian NG, Li Y: XPO1-dependent nuclear export as a target for cancer therapy. J Hematol Oncol 2020; 13(1): 61 5 Turner JG, Sullivan DM: CRM1-mediated nuclear export of proteins and drug resistance in cancer. Curr Med Chem 2008; 15(26): 2648-55 6 Parikh K et al.: Selective inhibitors of nuclear export (SINE) – a novel class of anti-cancer agents. J Hematol Oncol 2014; 7: 78 7 Huang WY et al.: Prognostic value of CRM1 in pancreas cancer. Clin Invest Med 2009; 32(6): E315 8 Saulino DM et al.: CRM1/XPO1 expression in pancreatic adenocarcinoma correlates with survivin expression and the proliferative activity. Oncotarget 2018; 9(30): 21289-95 9 Birnbaum DJ et al.: XPO1 expression is a poor-prognosis marker in pancreatic adenocarcinoma. J Clin Med 2019; 8(5): 596 10 Zhu JH et al.: The key genes for perineural invasion in pancreatic ductal adenocarcinoma identified with Monte-Carlo feature selection method. Front Genet 2020; 11: 554502 11 Azmi AS et al.: Exportin 1 (XPO1) inhibition leads to restoration of tumor suppressor miR-145 and consequent suppression of pancreatic cancer cell proliferation and migration. Oncotarget 2017; 8(47): 82144-55 12 Chen CI et al.: Anti tumor activity of selinexor (KPT-330), a first-in-class oral selective inhibitor of nuclear export (SINE) XPO1/CRM1 antagonist in patients (pts) with relapsed/refractory multiple myeloma (MM) or Waldenstrom’s macroglobulinemia (WM). Blood 2013; 122 13 Kalakonda N et al.: Selinexor in patients with relapsed or refractory diffuse large B-cell lymphoma (SADAL): a single-arm, multinational, multicentre, open-label, phase 2 trial. Lancet Haematol 2020; 7(7): e511-e522 14 Savona M et al.: Phase I trial of selinexor (KPT-330), a first-in-class oral selective inhibitor of nuclear export (SINE) in patients (pts) with advanced acute myelogenous leukemia (AML). Blood 2013; 122(21): 1440 15 Azmi AS et al.: Preclinical assessment with clinical validation of selinexor with gemcitabine and nab-paclitaxel for the treatment of pancreatic ductal adenocarcinoma. Clin Cancer Res 2020; 26(6): 1338-48 16 Wei XX et al.: Aphase II trial of selinexor, an oral selective inhibitor of nuclear export compound, in abiraterone- and/or enzalutamide-refractory metastatic castration-resistant prostate cancer. Oncologist 2018; 23(6): 656-e64 17 Westin SN et al.: Selinexor in combination with weekly paclitaxel in patients with metastatic solid tumors: results of an open label, single-center, multi-arm phase 1b study with expansion phase in ovarian cancer. Gynecol Oncol 2023; 168: 76-82 18 Fung HY, Chook YM: Atomic basis of CRM1-cargo recognition, release and inhibition. Semin Cancer Biol 2014; 27: 52-61 19 XPO1 inhibitor approved for multiple myeloma. Cancer Discov 2019; 9: 1150-1 20 Kasamon YL et al.: FDA approval summary: selinexor for relapsed or refractory diffuse large B-cell lymphoma. Oncologist 2021; 26(10): 879-86 21 Azmi AS et al.: Selective inhibitors of nuclear export block pancreatic cancer cell proliferation and reduce tumor growth in mice. Gastroenterology 2013; 144: 447-56 22 Kazim S et al.: Selective nuclear export inhibitor KPT-330 enhances the antitumor activity of gemcitabine in human pancreatic cancer. Mol Cancer Ther 2015; 14(7): 1570-81 23 Uddin MH et al.: Molecular analysis of XPO1 inhibitor and gemcitabine-nab-paclitaxel combination in KPC pancreatic cancer mouse model. Clin Transl Med 2023; 13(12): e1513
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...