Wird die Chemotherapie verdrängt?
Bericht:
Mag. Dr. Anita Schreiberhuber
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Immuntherapien, Antikörper-Wirkstoff-Konjugate und Tyrosinkinaseinhibitoren haben in den letzten Jahrzehnten Einzug in die Therapielandschaft verschiedener Tumorentitäten gehalten. Durch die Identifikation neuer Targets, aber auch durch die Erweiterung von bereits verfügbaren Substanzklassen können die Outcomes weiter verbessert werden.
Unter dem Titel „Das Beste aus 2022“ fand auch bei der diesjährigen Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie die inzwischen traditionelle Session statt, in der relevante Studienergebnisse zu verschiedenen Tumorentitäten präsentiert werden. Dabei hob Ap. Prof. Priv.-Doz. Dr. Aysegül Ilhan-Mutlu gleich zu Beginn ihres Vortrags hervor, dass es in diesem Jahr viele spannende Daten gibt, die definitiv als „practice-changing“ zu bezeichnen sind. Viel Raum haben dabei Neuigkeiten zur Immuntherapie (IO) eingenommen.
Bedeutung der Immuntherapie beigastrointestinalen Tumoren
So dürfte im Bereich der Kolorektalkarzinome, die durch eine dMMR („Mismatch repair“-Defizienz) oder MSI (Mikrosatelliteninstabilität) charakterisiert sind, die IO ins neoadjuvante Setting rücken, wie dies in der Studie NICHE-21 bei Patient*innen mit resektablen dMMR-Kolonkarzinomen in den Stadien IIIa–c gezeigt wurde: Die Patient*innen wurden nach Erhalt von 1 Dosis Ipilimumab (Ipi) und 2 Dosen Nivolumab (Nivo) der Operation zugeführt. Die pCR(pathologisch komplette Response)-Rate lag bei 67%. Nach einem medianen Follow-up (mFU) von 13,1 Monaten war noch immer kein Rezidiv aufgetreten. Möglicherweise könnte zukünftig eine ctDNA-Analyse dabei helfen, festzustellen, ob bei ausgewählten Patient*innen auf eine Operation verzichtet werden kann.
Diesen Schritt ging man in einer Studie zu dMMR-Rektumkarzinomen in den Stadien II und III, in der Dostarlimab in kurativer Intention für 6 Monate verabreicht wurde: Im Fall einer kompletten Response wurde auf eine Operation (OP) verzichtet und die Patient*innen wurden in 4-monatigen Abständen nachkontrolliert. Tatsächlich war bei keine*r/keinem der 14 Patient*innen eine OP erforderlich. Zwar ist die Zahl der Studienpatient*innen gering, aber die Ergebnisse geben Anlass zur Hoffnung, dass die IO in diesem Setting OP, Radiotherapie und/oder Chemotherapie (CTx) ersetzen könnte.2
Schließlich konnte die Effektivität einer neoadjuvanten IO auch bei resektablen Adenokarzinomen des Magens/gastroösophagealen Übergangs mit MSI bzw. dMMR belegt werden: In der Phase-III-Studie GERCOR NEONIPIGA erhielten die Patient*innen (n=32) 2 Zyklen Ipi + Nivound 4 Zyklen Nivo-Monotherapie vor der OP. Als primärer Endpunkt war die pCR-Rate definiert – bei 58,6% der Patient*innen konnte eine komplette Tumorregression ohne Residualerkrankung bestätigt werden und 94% der Patient*innen waren nach >1 Jahr immer noch rezidivfrei.3
Ilhan-Mutlu erläuterte: „Diese Daten sind zukunftsweisend – insgesamt liegen 23 Studien vor, deren Ergebnisse belegen, dass die neoadjuvante IO auch bei MSI/dMRR große Bedeutung hat. Wir wissen bereits aus dem metastasierten Setting, dass MSI/dMRR als prognostischer Marker für die Response auf eine IO gewertet werden kann.“
Immuntherapie beim Nierenzellkarzinom: Auch negative Daten sind wichtig
COSMIC-313 ist die erste Phase-III-Studie zu fortgeschrittenen Nierenzellkarzinomen (RCC), in der im Kontrollarm nicht Sunitinib, sondern eine IO verwendet wurde. 840 unvorbehandelte RCC-Patient*innen mit indermediärem oder ungünstigem Risiko wurden zu Nivolumab (Nivo) + Ipilimumab (Ipi) + Cabozantinib oder nur Nivo + Ipi randomisiert. Zwar hat die Dreierkombination vs. Dublette zu einer signifikanten Verlängerung des progressionsfreien Überlebens (PFS: nicht erreicht [NE] vs. 11,3 Monate; HR: 0,73; p=0,013) geführt, war jedoch mit einem nicht zu vernachlässigbaren Toxizitätsprofil assoziiert, sodass davon auszugehen ist, dass diese Tripelstrategie nur bei ausgewählten Patient*innen zur Anwendung kommen wird.4
Bis vor nicht allzu langer Zeit war für nephrektomierte RCC-Patient*innen mit hohem Rezidivrisiko keine adjuvante Therapie verfügbar. 2021 wurde basierend auf der Phase-III-Studie KEYNOTE-5645 Pembrolizumab (Pembro) als Monotherapie für dieses Setting zugelassen:6 In KEYNOTE-564 wurde die signifikante Überlegenheit von Pembro vs. Placebo (PBO) im krankheitsfreien Überleben (DFS) nachgewiesen – das DFS nach 24 Monaten belief sich auf 77,3% vs. 68,1% (HR: 0,68; p=0,002).
Am diesjährigen Kongress der Europäischen Gesellschaft für Medizinische Onkologie (ESMO) wurden drei Studien zur IO als adjuvante Monotherapie in diesem Setting präsentiert: CheckMate 9147 zu Nivo + Ipi, IMmotion0108 zu Atezolizumab und PROSPER9 zu Nivo. Obwohl das Patient*innenkollektiv jenem aus KEYNOTE-564 ähnlich war, fielen alle drei Studien negativ aus, sodass Pembro die bislang einzige IO bleibt, für die die Reduktion der Rezidivrate bei RCC in der Adjuvanz bestätigt werden konnte.
Nichtkleinzelliges Bronchuskarzinom: Nivo zu CTx; Sotorasib bei Vorbehandlung?
Beim resektablen nichtkleinzelligen Bronchuskarzinom (NSCLC) der Stadien IB–IIIA wurde eine IO mit Nivo als Zusatz zu einer CTx vs. eine CTx im Rahmen einer offenen Phase-III-Studie untersucht. Dabei war sehr früh eine Trennung der Kurven zugunsten der IO-haltigen Therapie zu verzeichnen, die sich in einer signifikanten Überlegenheit der Kombinationsstrategie vs. der alleinigen CTx niederschlug. Der primäre Endpunkt, das ereignisfreie Überleben (EFS), lag bei 31,6 vs. 20,8 Monate (HR: 0,63; p=0,005).3
Erstmals konnte auch für einen KRAS-Inhibitor ein Benefit bei vorbehandelten NSCLC-Patient*innen mit dem Nachweis einer KRASG12C-Mutation nachgewiesen werden: Sotorasib wurde in der Phase-III-Studie CodeBreak 200 im Head-to-Head-Vergleich an 345 mit IO und einer CTx vortherapierten Patient*innen vs. Docetaxel untersucht. In der Studiengruppe konnte eine signifikante Überlegenheit im primären Endpunkt, dem PFS, nachgewiesen werden: Das 12-Monats-PFS belief sich auf 24,8 vs. 10,1% (HR: 0,66; p=0,002). Auch in anderen sekundären Endpunkten konnte diese Überlegenheit bestätigt werden. Darüber hinaus wurden unter Sotorasib weniger Nebenwirkungen der Grade ≥3 verzeichnet und eine im Vergleich zu Docetaxel verbesserte Lebensqualität (QoL) erzielt.11
Kurativer Ansatz beim oligometastasierten Mammakarzinom?
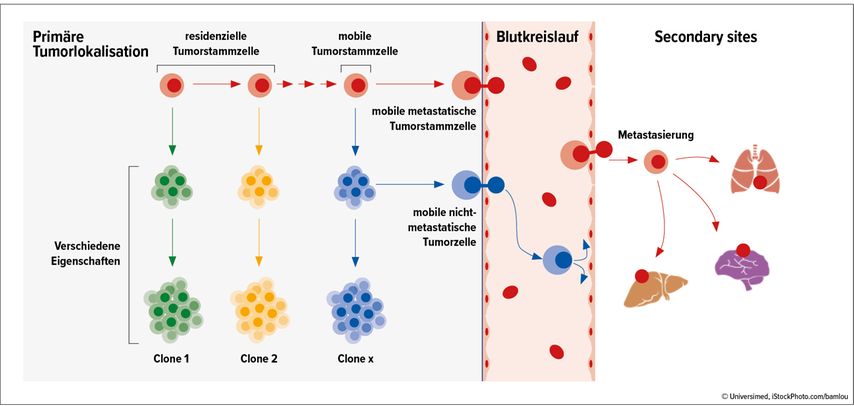
Von oligometastatischer Brustkrebserkrankung (OMBC) spricht man, wenn nur wenige (bis zu 5) metastatische Läsionen vorliegen.12 Assoc.Prof. Priv.-Doz. Dr. Marija Balic, Medizinische Universität Graz, ging der Frage nach, ob bei dieser Form der Metastasierung ein kurativer Ansatz möglich ist. „Wir haben immer schon gesagt, dass es sich um eine systemische Erkrankung handelt. Die hinter der Tumorektomie liegende Idee ist, dass man damit auch die Stammzellen entfernt. Wenn es aber Stammzellen sind, die metastasieren, ist die Entfernung des Primärtumors auch keine Lösung“, so Balic, die das Konzept anhand einer Abbildung erläuterte (Abb.1).
Abb. 1: Tumorprogression und Metastasierung. Erstellt nach dem Vortrag von Prof. Balic in der Session „Das Beste aus 2022“
Für OMBC liegen nur wenige Daten zum Langzeit-Gesamtüberleben (OS) vor. Es gibt jedoch Ergebnisse aus einer Metaanalyse, die zeigen, dass bei OMBC ein Langzeitüberleben möglich ist. Die größte Gruppe umfasste dabei 75 Patientinnen, und in dieser Kohorte waren nach 20 Jahren noch 34,1% am Leben.12
Was die Primärtumorchirurgie im primär metastasierten Setting betrifft, führt die lokoregionäre Chirurgie gemäß den Ergebnissen einer Metaanalyse in allen bis auf eine Studie nicht zu einem längerenOS.13
Dies wurde in einer weiteren Studie bestätigt, die prospektiv durchgeführt worden ist.14 Darüber hinaus stellt sich nicht nur die Frage, ob diese Vorgehensweise Vorteile hinsichtlich der Outcomes mit sich bringt, sondern auch, ob sie sich zumindest positiv auf die QoL auswirkt. Auch diesbezüglich konnten keine positiven Effekte bestätigt werden.14,15
In einer der wenigen Studien zu metastasiertem Brustkrebs (MBC), in denen die OMBC berücksichtigt wurden, wurde die Entscheidung für eine lokoregionäre Therapie (LRT) vs. eine LRT + eine systemische Therapie durch das behandelnde Zentrum getroffen. Die Patientinnen hatten bei Diagnose ausschließlich Knochenmetastasen. Aus den Ergebnissen geht hervor, dass Patientinnen mit solitären Metastasen und jene mit OMBC einen signifikanten Vorteil durch die LRT generierten (beide p-Werte <0,0001). Dies traf jedoch nicht auf jene mit multiplen Metastasen zu. Als Caveat muss angemerkt werden, dass nur 6% der Knochenmetastasen auch histologisch gesichert waren und ein CT-Screening auf das Vorliegen anderer Metastasen nicht verpflichtend war.16
Was ist nun die Conclusio, was die Gruppe der Patient*innen mit OBMT betrifft? Die ESMO gibt dazu das folgende Statement: „A small but very important subset of patients with advanced breast cancer, for example those with oligometastatic disease or low-volume metastatic disease that is highly sensitive to systemic therapy, can achieve complete remission and a long survival. A multimodal approach, including locoregional treatments with curative intent, should be considered for these selected patients.“17 „Wenn auch mit geringer Evidenz belegt, sollten wir dies immer im Hinterkopf behalten“, kommentierte Balic das Statement.
Aus einer US-amerikanischen Simulationsstudie geht hervor, dass zwischen 2000 und 2017 die BC-assoziierte Mortalität zurückgegangen ist.18 „Ich glaube, der Schlüssel liegt darin, dass unsere systemischen Therapien immer effektiver werden. Wichtig für die Verbesserung der Prognose ist auch die rasche Umsetzung der Ergebnisse klinischer Studien in den klinischen Alltag. Wenn auch MBC nicht heilbar ist, das OMBC geht mit einer besseren Prognose einher“, so das Fazit von Balic.
Wirksamkeit neuer Substanzen beiHirnmetastasen
„Von ADC bis TKI“ war der Titel des Vortrags von Prof. Dr. med. Diana Lüftner, Immanuel Klinik Märkische Schweiz, wobei sie den Fokus auf die Effektivität neuer Substanzen bei BC-assoziierten Hirnmetastasen (BM) legte: Da durch die zunehmende Verbesserung der systemischen Therapien (und ein dadurch verlängertes OS) die Zahl der MBC-Patientinnen mit BM über die Jahre hinweg zugenommen hat,19 ist eine hohe Effektivität neuer Substanzen auch im Gehirn umso relevanter.
In der Phase-III-Studie DESTINY Breast-03 wurde das Antikörper-Wirkstoff-Konjugat Trastuzumab Deruxtecan (T-DXd) im Head-to-Head-Vergleich an 524 Patientinnen mit HER2+ MBC, die zuvor mit Trastuzumab (T) und einem Taxan behandelt worden waren, gegen Trastuzumab Emtansin (T-DM1) untersucht. Als primärer Endpunkt war das PFS definiert. Dabei zeigte sich eine signifikante Überlegenheit unter T-DXd vs. T-DM1 – die 12-Monats-PFS-Rate lag bei 75,8% vs. 34,1% (p<0,001). T-DXd führte zu einer Reduktion des Risikos für eine Progression oder den Tod um 72% (HR: 0,28).20
In die Studie konnten Patientinnen mit klinisch stabilen, vorbehandelten BM eingeschlossen werden.20 Aus einer Subanalyse zu Patienten mit vs. jene ohne BM geht hervor, dass T-DXd hinsichtlich der PFS-Verlängerung gleichermaßen effektiv war: Das PFS vs. T-DM1 betrug 15,0 vs. 3,0 Monate (HR: 0,25) bzw. NE vs. 7,1 Monate (HR: 0,30).21
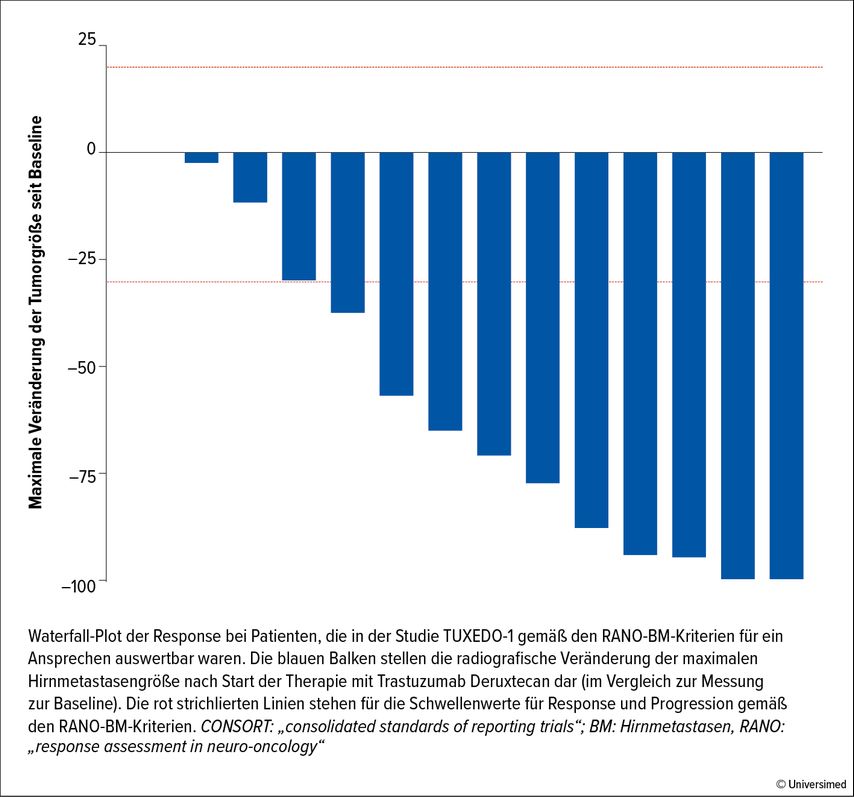
Bartsch et al. untersuchten in der offenen Phase-II-Studie TUXEDO-1 die Wirksamkeit von T-DXd an Patientinnen mit neu diagnostiziertem HER2+ BC und unbehandelten BM oder BM, die nach einer vorangegangenen Lokaltherapie progredient geworden waren. Als primärer Endpunkt wurde die Rate an intrakranieller Responsefestgelegt: Bei 2 der 14 für eine Response auswertbaren Patientinnen (13,3%) wurde eine komplette, bei 9 (60%) eine partielle intrakranielle Response und bei 3 eine stabile Erkrankung erzielt. Dies resultierte in einer intrakraniellen Gesamtresponse von 73,3% (Abb. 2). Die Autor*innen attestierten demnach T-DXd eine hohe Effektivität im Gehirn, die Substanz sollte als Therapieoption in diesem Setting in Erwägung gezogen werden.22
Als Beispiel für die zerebrale Wirksamkeit eines Tyrosinkinase-Inhibitors führte Lüftner Tucatinib an, das im Rahmen der Phase-III-Studie HER2CLIMB an HER2+ MBC-Patientinnen untersucht wurde, die zuvor mit Trastuzumab, Pertuzumab und T-DM1 behandelt worden waren. Die Patientinnen wurden im 2:1-Design zum Erhalt von Tucatinib + T + Capecitabin (Cape) bzw. PBO + T + Cape randomisiert. In diese Studie konnten neben Patientinnen mit stabilen vorbehandelten BM auch solche mit aktiven unvorbehandelten BM und jene mit zuvor progredienten BM eingeschlossen werden, bei denen eine lokale Therapie nicht unmittelbar erforderlich war. Beide Kollektive profitierten in signifikantem Ausmaß vom Zusatz von Tucatinib zu T + Cape: Bei Patientinnen mit aktiven BM betrug das OS 21,4 vs. 11,8 Monate (HR: 0,542; p=0,00087), bei jenen mit stabilen BM 21,6 vs. 16,4 Monate (HR: 0,695; p=0,16223). Das OS war bei Patientinnen mit behandelten stabilen BM im Tucatinib-haltigen Arm um 5,2 Monate länger als im Kontrollarm.23 „Liegen aktive BM vor, ist Tucatinib + Trastuzumab + Capecitabin die bevorzugte Zweitlinientherapie“, äußerte sich Lüftner dazu.
Weitere Daten zu BM bei MBC werden erwartet – so wird z.B. in der Phase-II-Studie DAISY T-DXd bei MBC-Patientinnen mit ≥1 vorangegangenen CTx und klinisch inaktiven BM in 3 Kohorten untersucht: HER2-Überexpression, HER2-low und keine HER2-Expression. Erste Ergebnisse wurden am ESMO-Kongress 2022 präsentiert. Sie sind vielversprechend: T-DXd zeigte auch eine hohe Wirksamkeit bei HER2-angereicherten Tumoren – weitere Untersuchungen dazu sind noch erforderlich.24
Quelle:
Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaften für Hämatologie und Medizinische Onkologie, 7.–10. Oktober 2022, Wien
Literatur:
1 Chamali M et al.: ESMO 2022; Abstr. #LBA7 2 Cercek A et al.: ASCO 2022; Abstr. #LBA5 3 André T et al.: ASCO GI 2022; Abstr. #244 4 Choueiri TK et al.: ESMO 2022; Abstr. #LBA8 5 Choueiri TK et al.: N Engl J Med 2021; 385: 683-694 6 EMA: 23.11.2022. Online unter https://www.ema.europa.eu/en/medicines/human/EPAR/keytruda . Abgerufen am 29.11.2022 7 Motzer RJ et al.: ESMO 2022; Abstr. #LBA7 8 Bex A et al.: ESMO 2022; Abstr. #LBA66 9 Allaf M et al.: ESMO 2022; Abstr. #LBA67 10 Forde PM et al.: NEngl J Med 2022; 386: 1973-85 11 Johnson MF et al.: ESMO 2022; Abstr. #LBA10 12 Kwapisz D: Breast Cancer 2019; 26: 138-46 13 Reinhorn D et al.: The Breast 2021; 58: 173-81 14 Khaan SA et al.: J Clin Oncol 2022; 40: 978-87 15 Bjelic V et al.: BMC Cancer 2020; 20: 392 16 Soran A et al.: Ann Surg Oncol 2021; 28: 5048-57 17 Cardoso F et al.: Ann Oncol 2018; 29: 1634-57 18 Caswell-Lin J et al.: ASCO 2022; Abstr. #1008 19 Lin NU, Wider EP: Clin Cancer Res 2007; 13: 1648-55 20 Cortés J et al.: N Engl Med 2022; 396: 1143-54 21 Hurwitz SA et al.: SABCS 2021; Abstr. #GS3-01 22 Bartsch R et al.: Nature Med 2022 23 Lin YU et al.: SABCS 2021; Abstr. # PD4-04 24 Epaillard N et al.: ESMO 2022; Abstr. #LBA1
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...