
Weniger testen, mehr forschen
Bericht:
TÄ Ingeborg Morawetz, MA
Der 66. Jahreskongress der Gesellschaft für Thrombose- und Hämostaseforschung (GTH) fand 2022 als Hybridveranstaltung statt. Sowohl online als auch vor Ort im Leipziger Kongresszentrum tauschten sich Expert*innen über die jüngsten Erkenntnisse auf ihrem Fachgebiet aus.
Thrombophilietestung: Es geht auch ohne
Zur Indikation der Thrombophilietestung im Jahr 2022 brachte Prof. Dr. Sebastian Schellong vom Städtischen Klinikum Dresden den Kongress auf den neuesten Stand. Thrombophilietestung kann sowohl für Patient*innen mit hereditärer als auch für solche mit erworbener Thrombophilie relevant sein, ist aber nur selten prophylaktisch indiziert.
Es sollte nur getestet werden, wenn die potenziellen klinischen Konsequenzen der Testergebnisse allen Beteiligten bewusst sind. Symptomfreie Patient*innen sollten ebenso wenig getestet werden wie solche, die eine Thrombophilietestung ohne Indikation selber einfordern. Ein Druck zur Testung durch andere Parteien, wie zum Beispiel Labore, ist oft wirtschaftlich und nicht medizinisch motiviert.
Bisher gibt es keine Evidenz, dass eine Testung in standardisierten Situationen mehr Nutzen als Schaden bringen könnte. Während zwar die Verhinderung zusätzlicher Episoden venöser Thromboembolie (VTE), wenn der Test positiv ausfällt, und die Verhinderung unnötiger Blutungen durch Antikoagulation bei negativem Test relevant sein können, überwiegt der Schaden. Unterlassung sinnvoller Prophylaxe, unnötige Beunruhigung, genetische Diskriminierung, vermeidbare Kosten und auch versicherungsrechtliche Schwierigkeiten können hier genannt werden.
Konkrete Fälle, in denen nicht pauschalisiert getestet werden sollte, sind Sekundärprophylaxe bei Zustand nach (Z.n.) getriggerter und nicht getriggerter VTE und Primärprophylaxe bei Verwandten ersten Grades mit VTE. Bei der geplanten Einnahme eines oralen Kontrazeptivums bei Verwandten ersten Grades mit VTE und bei geplanter Schwangerschaft bei Z.n. nach VTE sind Ausnahmen möglich.
Moderne onkologische Therapie und ihr Thromboserisiko
Um Krebs als einen Risikofaktor für venöse (VTE) und arterielle Thromboembolie (ATE) nachzuweisen, wurden bis 2018 in einer populationsbasierten Kohortenstudie in Österreich, den Niederlanden und Dänemark 499092 dänische Krebspatient*innen mit einer gesunden Kontrollgruppe verglichen.1 Die Inzidenz von VTE in den letzten zwei Jahrzehnten erhöhte sich dreifach bei allen Patient*innen und sechsfach bei Patient*innen mit Chemo- oder zielgerichteter Therapie. Dieses Resultat kann jedoch auch von verbesserter Thromboemboliediagnostik beeinflusst sein.
Neben Patient*innen- und Tumor-abhängigen Risikofaktoren und Biomarkern trat der Risikofaktor Therapieform in den Vordergrund. Am niedrigsten unter allen Therapieformen war die VTE-Inzidenz beim Ausbleiben von Therapie, bei Hormontherapie, Chirurgie, Bestrahlung und Chemotherapie, am höchsten bei der zielgerichteten Therapie.1 Neuere Therapieformen können also als signifikante Risikofaktoren für VTE bei Krebspatient*innen gesehen werden.
Prof. Dr. Cihan Ay von der Medizinischen Universität Wien stellte neben dieser Studie auch eine österreichweite Analyse der gesamten Population vor, in der VTE bei Krebspatient*innen im Vergleich zu Gesunden eine 15-fach (95% CI: 8,90–24,95) und ATE eine siebenfach erhöhte Inzidenz (95% CI: 4,81–9,48) hatte.2
Da zudem eine verkürzte Gesamtüberlebenszeit (OS) und ein verkürztes progressionsfreies Überleben von Krebspatient*innen mit VTE bekannt sind, wurde von der Medizinischen Universität Wien eine retrospektive Kohortenstudie veranlasst.3 Bei Krebspatient*innen unter Therapie mit kürzlich zugelassenen Immuncheckpoint-Inhibitoren lag das OS bei jenen mit VTE bei 11,6 Monaten und bei jenen ohne VTE bei 25,5 Monaten. Außerdem zeigte sich bei dieser Therapieform eine kumulative Erhöhung von VTE und ATE auf 12,9% (95% CI: 8,2–18,5) und 1,8% (95% CI: 0,7–3,6) – eine Komplikation, die in keiner der Zulassungsstudien zutage trat.
Bei anderen zielgerichteten Therapien stieg laut der dänischen Kohortenstudie die VTE- und ATE-Inzidenz bei VEGF-gerichteter, HER2-neu-gerichteter, EGFR-gerichteter und bei ALK/ROS-gerichteter Therapie und bei Multikinase-Inhibitoren an. Auch das relative Risiko war erhöht.1 Bei CAR-T-Zell-Therapie erhöhte sich in einer anderen Studie die VTE-Inzidenz auf 11% der Studienteilnehmenden und trat vermehrt bei jenen mit den Nebenwirkungen Zytokin-Release-Syndrom oder Neurotoxizität auf.4
Eine zukünftige Einbeziehung von Thromboembolien als Komplikation bei modernen onkologischen Therapien ist für das Patient*innenwohl unabdingbar.
Sichelzellkrankheit als hämostatisches Problem
Die Sichelzellkrankheit (SCD) wird zwar durch ein hämatologisches Ereignis ausgelöst, muss aber eigentlich als eine Erkrankung der Hämostaseologie und Immunologie betrachtet werden, so Prof. Dr. Holger Cario vom Universitätsklinikum Ulm. Da die Inzidenz von SCD in den vergangenen Jahren zugenommen hat, ist ein Fokus auf die hämostatischen Effekte der Krankheit nötiger denn je.
Bei SCD-Patient*innen liegt die Inzidenz eines zerebrovaskulären Ereignisses bis zum 45. Lebensjahr bei 24%.5–7 Auch klassische venöse thromboembolische Ereignisse treten bei bis zu 25% aller Patient*innen auf und haben einen ebenso hohen Einfluss auf die Mortalität wie zum Beispiel renale Komplikationen.8 Unerwünschte Langzeitfolgen dieser Ereignisse sind pulmonale Hypertension, Kardiomyopathie und chronische Niereninsuffizienz.9 21% aller SCD-Patient*innen zeigen eine erhöhte Blutungsneigung.10
Gewebefaktor (TF), Faktor Xa (FXa) und Thrombin trugen im Mausmodell zudem zu Inflammation und Organschäden bei SCD-Patient*innen bei.11 Eine Koagulationsprophylaxe zur Hemmung dieser Faktoren hatte einen positiven Einfluss auf das Krankheitsgeschehen.11,12 Auch der Von-Willebrand-Faktor (vWF) scheint eine wichtige Rolle zu spielen. Er wird gerade in mehreren Studien untersucht.
Antikoagulative Wirkstoffe, die für den Einsatz bei SCD erforscht werden, sind verschiedene Vitamin-K-Antagonisten, FXa- und Thrombin-Inhibitoren, Thrombozytenfunktionshemmer und SHP655(rADAMTS-13) zur Reduzierung des vWF.13 In der SUSTAIN-Studie von 2016 wurde zudem der P-Selektin-Blocker Crizanlizumab als wirksam ermittelt, um die Anzahl der vasookklusiven Krisen pro Jahr zu reduzieren und die Zeit bis zum Auftreten der nächsten Krise zu verlängern.14
Der Circulus vitiosus vaskulärer Inflammation und hämostatischer Aktivierung bei SCD kann in Zukunft durch frühzeitige Therapie durchbrochen werden.
Gentherapie bei Hämophilie
Zwei Studien von 2011 und 2014 können als Proof of Concept für die erfolgreiche i.v. Infusion von AAV(„Adenoassoziiertes Virus“)-basierter Gentherapie bei Hämophilie gelten. Bis acht Jahre nach Studienbeginn können nach wie vor erhöhte Level von Faktor IX (FIX) nachgewiesen werden.15,16 Da gerade 47 weitere klinische Studien zu Gentherapie bei Hämophilie stattfinden, bezog sich Prof. Dr. Miesbach vom Universitätsklinikum Frankfurt vor allem auf jüngste Daten aus klinischen Phase-III-Studien.
In der HOPE-B-Studie zum FIX blieben die erhöhten FIX-Level bis 18 Monate nach Therapiebeginn erhalten (6 Monate: 39,0IU/dL, 18 Monate: 36,9IU/dL).17 Die GENEr8-1-Studie zum Faktor VIII (FVIII) ist mit 132 Patient*innen die größte gentherapeutische Studie jemals. In ihr zeigte sich der Höchstwert von FVIII in Woche 26 nach Therapiebeginn. Bis Woche 156 konnte ein langsamer Abfall beobachtet werden. 84% der Patient*innen hatten keine behandlungsbedürftigen Blutungen im zweiten Jahr, 95% brauchten beim letzten Follow-up keine Prophylaxe mehr. Insgesamt kam es zu einer Reduzierung um 98% beim durchschnittlichen Gebrauch von exogenem FVIII.18
Sicherheitsbedenken wecken die erhöhten Alanin-Aminotransferase(ALT)-Werte, die in beiden Studien auftraten. In der GENEr8-1-Studie waren sie bei 86% aller Patient*innen präsent, und 80% aller Patient*innen wurden erfolgreich mit Prednisolon immunsupprimiert. Die Erhöhung ist asymptomatisch, aber muss ernst genommen werden, da sie mit dem Therapieerfolg interferieren kann. Andere Risiken, wie das der Genintegration in die menschliche DNA, konnten bisher nicht nachgewiesen werden.
Was Hausärzt*innen wissen wollen
Ein Panel unter Moderation der Leipziger Hausärztin Dr. Amrit Forker-Tutschkus stellte sich den dringlichsten Fragen von Hausärzt*innen zur Hämostaseologie (Tab.1).
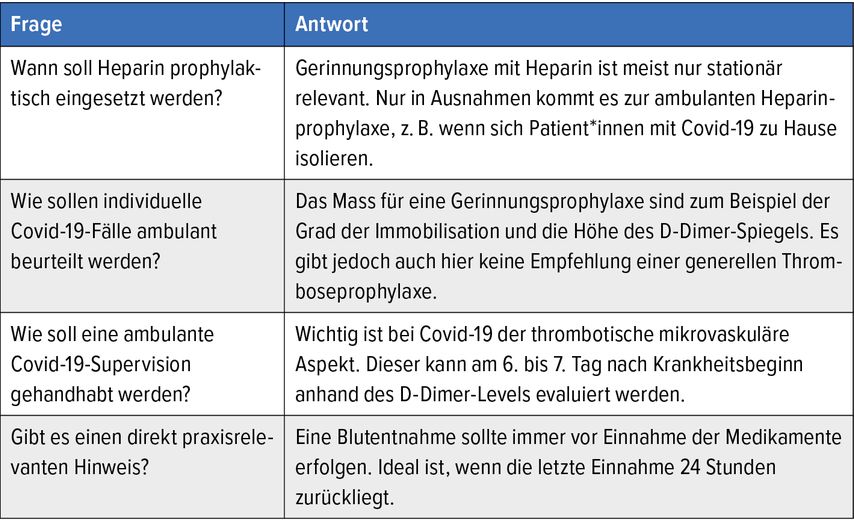
Tab. 1: Was Hausärzt*innen von Gerinnungsexpert*innen wissen wollen
Quelle:
66. Jahrestagung der Gesellschaft für Thrombose- und Hämostaseforschung, 1.–4. März 2022, Leipzig und virtuell
Literatur:
1 Mulder FI et al.: Venous thromboembolism in cancer patients: a population-based cohort study. Blood 2021; 137(14): 1959-69 2 Grilz E et al.: Relative risk of arterial and venous thromboembolism in persons with cancer vs. persons without cancer - a nationwide analysis. Eur Heart J 2021; 42(23): 2299-307 3 Moik F et al.: Incidence, risk factors, and outcomes of venous and arterial thromboembolism in immune checkpoint inhibitor therapy. Blood 2021; 37(12): 1669-78 4 Hamza H et al.: Venous thromboembolism associated with CD19-directed CAR T-cell therapy in large B-cell lymphoma. Blood Adv 2020; 4(17): 4086-90 5 Ohene-Frempong K et al.: Cerebrovascular accidents in sickle cell disease: rates and risk factors. Blood 1998; 91: 288-94 6 Adams RJ et al.: Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial doppler ultrasonography. NEngl J Med 1998; 339: 5-11 7 Adams RJ et al.: Discontinuing prophylactic transfusions used to prevent stroke in sickle cell disease. NEngl J Med 2005; 353: 2769-78 8 Naik RP et al.: Venous thromboembolism in adults with sickle cell disease: a serious and under-recognized complication. Am J Med 2013; 126(5): 443-9 9 Elmariah H et al.: Factors associated with survival in a contemporary adult sickle cell disease cohort. Am J Hematol 2014; 89(5): 530-5 10 Hariharan N et al.: Bleeding in patients with sickle cell disease: a population-based study. Blood Adv 2020; 4(5): 793-802 11 Sparkenbaugh EM et al.: Differential contribution of FXa and thrombin to vascular inflammation in a mouse model of sickle cell disease. Blood 2014; 123(11): 1747-56 12 Arumugam PI et a.: Genetic diminution of circulating prothrombin ameliorates multiorgan pathologies in sickle cell disease mice. Blood 2015; 126(15): 1844-55 13 Nasimuzzaman M et al.: Role of the coagulation system in the pathogenesis of sickle cell disease. Blood Adv 2019; 3(20): 3170-80 14 Ataga K et al.: SUSTAIN. A multicenter, randomized, placebo-controlled, double-blind, 12-month study to assess safety and efficacy of SelG1 with or without hydroxyurea therapy in sickle cell disease patients with sickle cell-related pain crises. Blood 2016; 128(22): 1 15 Nathwani AC et al.: Adenovirus-associated virus vector-mediated gene transfer in hemophilia B. N Engl J Med 2011; 365: 2357-65 16 Nathwani AC et al.: Long-term safety and efficacy of factor IX gene therapy in hemophilia B. N Engl J Med 2014; 371: 1994-2004 17 Miesbach W et al.: Final analysis of pivotal HOPE-B-study demonstrates durable and sustained therapeutic effect of etranacogene dezaparvovec gene therapy in Hemophilia B. EAHAD 2022 18 Ozelo MC et al.: Efficacy and safety of valoctocogene roxaparvovec gene transfer for severe hemophilia A: results from the GENEr8-1 year two analysis. EAHAD 2022
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


