Wegweisende Entwicklungen in der Therapie des NSCLC
Bericht:
Mag. pharm. Irene Senn, PhD
Neue Studiendaten vom Europäischen Lungenkrebskongress (ELCC) könnten die Therapielandschaft beim nichtkleinzelligen Lungenkarzinom (NSCLC) nachhaltig verändern: Kombinationstherapien bei EGFR- und KRAS-mutierten Tumoren erzielten in der Erstlinie beeindruckend hohe Überlebensraten. Gleichzeitig erlauben innovative Ansätze – von prophylaktischem Nebenwirkungsmanagement über Deeskalationsstrategien bis zur Liquid Biopsy – eine präzisere und verträglichere Behandlung.
NSCLC mit EGFR-Mutationen
MARIPOSA: neuer Behandlungsstandard in der Erstlinie
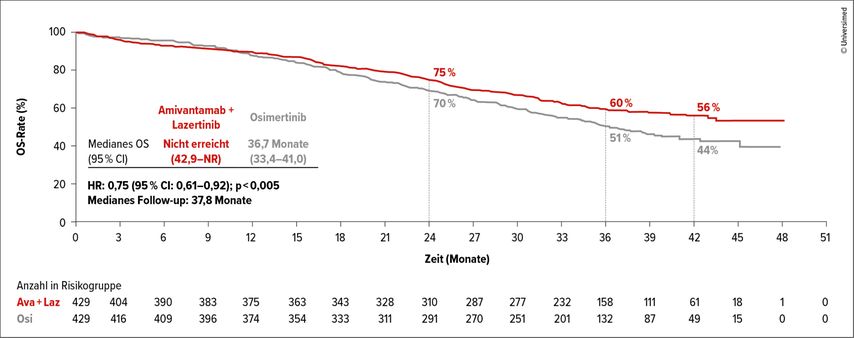
Die finalen Daten zum Gesamtüberleben (OS) aus der Phase-III-Studie MARIPOSA gehörten sicher zu den meistdiskutierten Präsentationen am ELCC.1 Die Studie verglich Amivantamab (AMI) plus Lazertinib (LAZ) mit Osimertinib (OSI) als Erstlinientherapie bei unbehandelten Patient:innen mit aktivierenden EGFR(epidermaler Wachstumsfaktor-Rezeptor)-Mutationen (EGFRm). Erstmals konnte ein signifikanter und klinisch relevanter Überlebensvorteil durch eine EGFR-Tyrosinkinase-Inhibitor(TKI)-Kombination gegenüber der bisherigen Standardtherapie nachgewiesen werden.
Nach einem medianen Follow-up von 37,8 Monaten war das mediane OS im AMI+LAZ-Arm noch nicht erreicht (95% CI: 42,9 bis nicht erreicht), während es unter OSI 36,7 Monate betrug (Abb. 1). Nach drei Jahren lebten noch 60% der Patient:innen im Kombinationsarm gegenüber 51% unter OSI. Modellbasierte Extrapolationen deuten auf einen potenziellen Überlebensvorteil von über einem Jahr (!) hin. Zusätzlich zeigte sich ein Vorteil beim Überleben ohne intrakranielle Progression (PFS). AMI+LAZ positioniert sich damit als neuer Therapiestandard für Patient:innen mit EGFRm NSCLC in der Erstlinie.
Abb. 1: Gesamtüberleben (OS) in der Phase-III-Studie MARIPOSA: Amivantamab plus Lazertinib (Ava+Laz) vs. Osimertinib (Osi) in der Erstlinie bei unbehandelten Patient:innen mit aktivierenden EGFR-Mutationen (modifiziert nach Yang JC-H et al.)1
COCOON: proaktives Management von Hautnebenwirkungen
Eine zentrale Herausforderung der Therapie mit AMI+LAZ sind die für EGFR-Inhibitoren typischen Haut- und Nageltoxizitäten. Die auf dem ELCC vorgestellten ersten Ergebnisse der Phase-II-Studie COCOON (medianes FU: 4,2 Monate) zeigen, dass ein präventives dermatologisches Management diese Nebenwirkungen deutlich reduzieren kann.2
Das prophylaktische Regime umfasste Doxycyclin oder Minocyclin (Wochen 1–12), Chlorhexidin für die Nägel, tägliche Feuchtigkeitscreme und ab Woche 13 topisches Clindamycin. Die Rate von Hautnebenwirkungen ≥Grad 2 in den ersten 12 Wochen wurde damit gegenüber der Standardversorgung halbiert (38,6% vs. 76,5%; p<0,0001), Kopfhautreaktionen wurden sogar um rund 70% reduziert (9% vs. 29%). Die Therapieabbruchrate aufgrund von Hauttoxizität sank mit der COCOON-Prophylaxe auf 1% (vs. 4%). Diese Ergebnisse unterstreichen, dass ein proaktives Nebenwirkungsmanagement essenziell ist, um den vollen Benefit der neuen Kombinationstherapie auszuschöpfen.
Strategien nach Osimertinib: SAVANNAH und ORCHARD
Trotz des Erfolgs von OSI in der Erstlinientherapie bleibt die Therapie des NSCLC nach Progress – insbesondere bei MET-abhängiger Resistenz – weiterhin eine Herausforderung.
In der Phase-II-Studie SAVANNAH erhielten 80 Patient:innen mit EGFRm NSCLC und MET IHC 3+/≥90% oder FISH10+ nach Progress unter Erstlinien-OSI eine Kombination aus Savolitinib (SAVO) plus OSI.3 Die objektive Ansprechrate (ORR) betrug laut Prüfarztbewertung („investigator“, inv) 56%, durch eine verblindete unabhängige zentrale Bewertung (BICR) wurden 55% bestätigt. Die mediane Ansprechdauer (DoR) lag bei 7,1 Monaten (inv) bzw. 9,9 Monaten (BICR), das PFS lag bei 7,4 bzw. 7,5 Monaten. Schwerwiegende Nebenwirkungen (AE) ≥Grad 3 traten bei 57% auf; therapiebedingte Abbrüche betrafen 16% (SAVO) bzw. 12% (OSI). Häufig waren periphere Ödeme (58%), Übelkeit (45%) und Diarrhö (33%). SAVANNAH bestätigt damit den klinischen Nutzen einer gezielten MET-Hemmung nach OSI-Versagen. Die Chemotherapie-freie Salvage-Therapie wird nun in der Phase-III-Studie SAFFRON weiter evaluiert.
Einen anderen Ansatz verfolgt das Plattformprotokoll ORCHARD: Nach Progress unter Erstlinien-OSI werden hier parallel mehrere personalisierte Therapie-Module getestet. Beim ELCC wurden neue Daten aus Modul10 präsentiert, in dem OSI (80mg QD) mit dem TROP2-Antikörper-Wirkstoff-Konjugat Datopotamab-Deruxtecan (Dato-DXd) kombiniert wird.4 In den zwei Dosis-Kohorten (4mg/kg vs. 6mg/kg Q3W) zeigte sich eine ORR von 43% bzw. 36%, bei einer medianen DoR von ≥9 Monaten in beiden Armen. Unter der höheren Dosis (6mg/kg) lag das mediane PFS bei 11,7 Monaten (vs. 9,5 Monate bei 4mg/kg), wobei 64% der Responder:innen ≥9 Monate ansprachen. Schwere AE ≥Grad 3 traten bei 56% (6mg) vs. 34% (4mg) auf. Obwohl das OS noch unreif ist (37% Datenreife), belegen die Daten die Machbarkeit und Wirksamkeit einer personalisierten Kombinationstherapie nach EGFR-TKI-Versagen. Eine globale Phase-III-Studie (TROPION-Lung15) ist bereits in Planung.
KRASG12C-mutiertes NSCLC: neue Kombinationstherapien in der Erstlinie
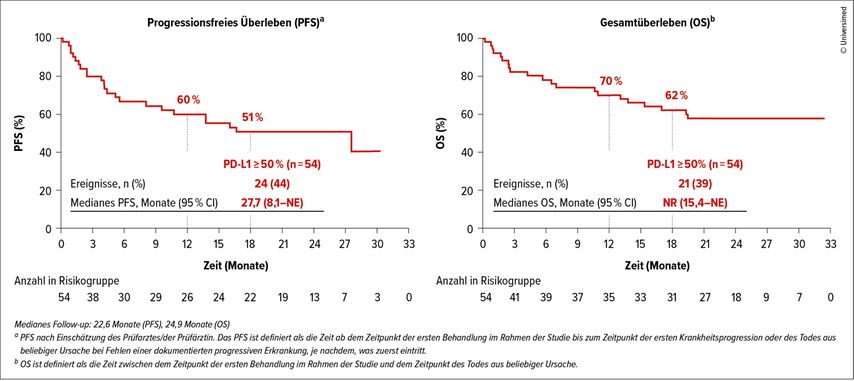
Auch beim KRASG12C-mutierten NSCLC zeichnen sich neue Therapieoptionen ab. Die aktualisierten Daten der Phase-II-Studie KRYSTAL-7 untermauern das Potenzial von Adagrasib (ADA) – einem oralen KRASG12C-Inhibitor – in Kombination mit Pembrolizumab (PEMBRO) als Chemotherapie-freie Erstlinienoption bei fortgeschrittenem KRASG12C-mutiertem NSCLC mit PD-L1 ≥50%.5 Nach einer medianen Nachbeobachtungszeit von über 22 Monaten lag die ORR bei 59%, die mediane DoR bei 26,3 Monaten. Das mediane PFS betrug 27,7 Monate, die 18-Monats-Überlebensrate lag bei 62% (Abb. 2). Im Vergleich zu den historischen Daten der PEMBRO-Monotherapie (PFS ca. 10 Monate, KEYNOTE-024)6 zeigt sich damit ein deutlicher Vorteil. Allerdings traten therapieassoziierte Nebenwirkungen ≥Grad 3 bei 68% der Patient:innen auf, darunter auch Grad-5-Ereignisse (Pneumonie, Pneumonitis), sodass die Kombination wohl bevorzugt für fitte Patient:innen infrage kommen dürfte. Die laufende Phase-III-Studie vergleicht nun die Kombination direkt mit PEMBRO-Monotherapie.
Abb. 2: Überlebensvorteil mit ADA+PEMBRO bei fortgeschrittenem/metastasiertem KRASG12C-mutiertem NSCLC in der KRYSTAL-7-Studie (modifiziert nach Garassino M et al.)5
Ermutigende Ergebnisse lieferte auch die Phase-II-Studie KROCUS, in der Fulzerasib – ein neuartiger oraler KRASG12C-Inhibitor – erstmals in Kombination mit Cetuximab (EGFR-Antikörper) bei unbehandeltem KRASG12C-mutiertem NSCLC untersucht wurde.7 Die ORR lag bei 80%; 58% der Patient:innen zeigten eine Tumorverkleinerung von ≥50%. Auch bei Patient:innen mit Hirnmetastasen war die Kombination wirksam (ORR: 71,4%). Nach einem medianen Follow-up von 12,8 Monaten betrug das mediane PFS 12,5 Monate, die mediane DoR war noch nicht erreicht. Die Wirksamkeit war unabhängig vom PD-L1-Status. Schwere therapieassoziierte AE ≥Grad 3 wurden bei 14,9% beobachtet, Grad-4/5-Ereignisse traten nicht auf. Die Abbruchrate aufgrund von AE lag bei nur 6,4%. Eine Phase-III-Studie versus PEMBRO + Chemotherapie bei PD-L1 <50% ist in Planung. Die Kombination gilt als vielversprechende, gut verträgliche Erstlinien-Option – auch bei zerebraler Beteiligung.
Pembrolizumab subkutan: neue Option mit vergleichbarer Wirksamkeit
Auch bei der Applikationsart von Immuntherapien gibt es Fortschritte: In der Phase-III-Studie MK-3475A-D77 wurde subkutanes (SC) PEMBRO – formuliert mit Hyaluronidase – mit der herkömmlichen intravenösen (IV) Gabe verglichen. Die am ELCC präsentierten Daten zeigen eine pharmakokinetische Nichtunterlegenheit der SC-Form.8 Auch Wirksamkeit und Sicherheit waren vergleichbar: Die ORR betrug 45,4% (SC) vs. 42,1% (IV), das mediane PFS 8,1 vs. 7,8 Monate. Schwere Nebenwirkungen traten in beiden Gruppen gleich häufig auf (ca. 47%).
Die Vorteile der SC-Applikation liegen u.a. in einer geringeren Belastung durch Klinikbesuche, reduziertem Personal- und Zeitaufwand sowie möglichen Kosteneinsparungen. Obwohl die SC-Formulierung mit einer höheren Dosis verabreicht wird (790mg vs. 400mg), könnte sie dank ihrer praktischen Vorteile künftig eine zentrale Rolle in der onkologischen Versorgung spielen.
Deeskalationsstrategien in der Immuntherapie
Ein weiterer viel beachteter Programmpunkt am ELCC war die Keynote Lecture von Prof. Benjamin Besse, Paris.9 Er ging der Frage nach, ob sich Dosis, Intervall oder Gesamtdauer von immunonkologischen Regimen verringern lassen, ohne an Wirksamkeit einzubüßen. Besse zeigte eindrucksvoll, dass die etablierten Standarddosierungen vieler Immuncheckpoint-Inhibitoren (ICI) bislang nur begrenzt auf realen pharmakokinetischen Daten beruhen. Studien zeigen, dass selbst deutlich geringere Mengen (z.B. 0,1 statt 10mg/kg Nivolumab) eine ähnliche Rezeptorsättigung und vergleichbare Ansprechraten erreichen können. Gerade in Ländern mit knappen Ressourcen bergen „Ultra low-dose“-Protokolle somit großes Potenzial. Diese Ansätze sind aber nicht für alle Substanzen geeignet: Bei Ipilimumab etwa führt eine geringere Dosierung zu deutlichen Einbußen in der Effizienz.
Der Nutzen verschiedener Deeskalationsstrategien wird aktuell in mehreren Studien geprüft:
-
DIAL (Frankreich, NCT05255302): Stop-and-Go-Konzept, bei dem nach sechs Monaten pausiert und die ICI-Therapie erst bei Progress reaktiviert wird
-
DEDICATION-1 (Niederlande, NCT04909684): vergleicht reduzierte PEMBRO-Dosen (ca. 75%) gegenüber der Standard-Dosierung (100%)
-
PULSE (Frankreich, NCT05692999): vergleicht eine verlängerte PEMBRO-Gabe (200mg, Q6W) mit der Standardbehandlung (200mg, Q3W) als Erhaltungstherapie
-
REFINE-Lung (Großbritannien, NCT05085028): testet nach 6 Monaten PEMBRO-Standardtherapie die Verlängerung der Behandlungsintervalle von 6 auf 12 Wochen sowie ggf. 9, 15 oder 18 Wochen mit Option zur Wiedereskalation bei Progression
Ziel ist es, Patient:innen durch geringere Toxizität und weniger Infusionen zu entlasten und zugleich die Therapiekosten zu senken. Ein zentrales Problem bleibt jedoch, dass die regulatorischen Zulassungen oft unverändert bleiben, selbst wenn akademische Studien die Wirksamkeit reduzierter Dosierungen belegen. Da nur pharmazeutische Unternehmen Label-Änderungen bei der EMA oder FDA beantragen können, fordert Besse verstärkte internationale Zusammenarbeit, um evidenzbasierte Deeskalationsstrategien in der Praxis zu implementieren.
MRD und ctDNA in der adjuvanten Therapieplanung
Neben den Fortschritten bei zielgerichteten Therapien gewinnen auch Biomarker-basierte Ansätze zunehmend an Bedeutung. Die Liquid-Biopsy-Technologie, insbesondere die Messung zirkulierender Tumor-DNA (ctDNA), könnte die Beurteilung des Therapieansprechens und die Früherkennung von Rezidiven beim Lungenkarzinom maßgeblich verbessern.
In frühen Stadien des NSCLC hat sich die Messung der minimalen Resterkrankung (MRD) mittels zirkulierender Tumor-DNA (ctDNA) als vielversprechender prognostischer Biomarker etabliert.10,11 Studien wie NADIM II und CheckMate 816 zeigen, dass ein ctDNA-Nachweis nach kurativer Therapie mit erhöhtem Rezidivrisiko einhergeht, während MRD-negative Patient:innen eine signifikant bessere Prognose aufweisen.
Ein besonderer Vorteil der MRD-Tests liegt in der Früherkennung von Rezidiven. Im Vergleich zur konventionellen Bildgebung können molekulare Rückfälle im Median etwa 6 Monate früher detektiert werden (TRACERx-Studie), in der ADAURA-Studie waren es 5 Monate vor dem radiologischen Nachweis.
Die MRD-Analytik könnte künftig zudem die adjuvante Therapieplanung lenken: MRD-positive Patient:innen würden von einer Therapieintensivierung profitieren (z.B. zusätzliche adjuvante Immuntherapie wie in IMpower010), während bei MRD-Negativität prinzipiell eine Deeskalation (Verzicht auf adjuvante Therapie) denkbar wäre. Die Grenzen der aktuellen Technologie müssen dabei jedoch berücksichtigt werden – insbesondere die eingeschränkte Detektion von Hirnmetastasen sowie die begrenzte Sensitivität: Ein Resttumor kann trotz MRD-Negativität nicht sicher ausgeschlossen werden.
Trotz dieser vielversprechenden Daten bleiben MRD-Assays daher vorerst rein prognostische Werkzeuge. Für ihren routinemäßigen Einsatz in der Therapiesteuerung fehlen sowohl die regulatorische Zulassung als auch prospektive Studien, die einen klinischen Nutzen MRD-gesteuerter Therapieentscheidungen zweifelsfrei belegen.
Quelle:
European Lung Cancer Congress, 26.–29. März 2025, Paris
Literatur:
1 Yang JC-H et al.: 4O: Amivantamab plus lazertinib vs osimertinib in first-line (1L) EGFR-mutant (EGFRm) advanced NSCLC: final overall survival (OS) from the phase III MARIPOSA study. ELCC 2025; Abstr. #40 2 Girard N et al.: Preventing moderate to severe dermatologic adverse events in first-line EGFR-mutant advanced NSCLC treated with amivantamab plus lazertinib: early success of the COCOON trial. ELCC 2025; Abstr. #10MO 3 Ahn M et al.: SAVANNAH: Savolitinib (savo) + osimertinib (osi) in patients (pts) with EGFRm advanced NSCLC and METoverexpression (OverExp) and/or amplification (Amp) following progressive disease (PD) on osi. ELCC 2025; Abstr. #20 4 Le X et al.: Osimertinib (osi) + datopotamab deruxtecan (Dato-DXd) in patients (pts) with EGFR-mutated (EGFRm) advanced NSCLC (aNSCLC) whose disease progressed on first-line (1L) osi: ORCHARD. ELCC 2025; Abstr. #10 5 Garassino M et al.: First-line adagrasib (ADA) with pembrolizumab (PEMBRO) in patients (pts) with advanced/metastatic KRASG12C-mutated non-small cell lung cancer (NSCLC) and PD-L1 ≥50% from the phase II portion of KRYSTAL-7. ELCC 2025; Abstr. #5MO 6 Reck M et al.: Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375(19): 1823-33 7 Majem Tarruella M et al.: First-line (1L) fulzerasib + cetuximab in KRAS G12Cm advanced NSCLC: updated efficacy and safety from KROCUS study. ELCC 2025; Abstr. #LBA1 8 Felip E et al.: Subcutaneous (SC) versus intravenous (IV) pembrolizumab (Pembro) plus chemotherapy (CT) in metastatic non-small cell lung cancer (mNSCLC): phase III MK-3475A-D77 trial. ELCC 2025; Abstr. #8MO 9 Besse B: Less is more: de-escalation strategies in patient management and clinical trials. ELCC 2025; Präsentation 10 Wakelee H: Is liquid biopsy a tool for detecting early relapse in lung cancer patients? ELCC 2025; Präsentation 11 Romero A: Has MRD detection a role for guiding treatment adaptation in non-oncogene addicted early NSCLC? ELCC 2025; Präsentation
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...