Was gibt es Neues zur medikamentösen Therapie des Nierenzellkarzinoms?
Autor:
OA Dr. Josef Mühlmann
Abteilung für Innere Medizin mit Hämatologie und internistischer Onkologie
Krankenhaus der Barmherzigen Brüder, Salzburg
E-Mail: Josef.Muehlmann@bbsalz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die medikamentöse Therapie des Nierenzellkarzinoms (RCC) hat sich in den letzten Jahren grundlegend gewandelt. Durch Einführung der Tyrosinkinaseinhibitoren (TKI) Mitte der Nuller-Jahre sowie der Checkpoint-Inhibitoren (ICI) etwa zehn Jahre später konnte das Überleben deutlich verbessert werden. Durch Kombinationen dieser beiden Substanzklassen lassen sich im fortgeschrittenen Krankheitsstadium noch nie da gewesene Ansprechraten erzielen.
Die adjuvante Therapie des operierten klarzelligen RCC
Im lokoregionären Krankheitsstadium ist und bleibt die kurative Nephrektomie der therapeutische Standard, wobei das Rezidivrisiko vor allem für Patienten mit Hochrisikoerkrankung beträchtlich bleibt. Im Zeitalter der TKI wurde deshalb in vielen großen Therapiestudien versucht, das Überleben zu verlängern. Nur eine Studie mit adjuvant eingesetztem Sunitinib (S-TRAC) erzielte bei Hochrisikopatienten einen signifikanten Vorteil bezüglich des progressionsfreien Überlebens. Aufgrund des ungünstigen Nutzen-/Toxizitätsverhältnisses erfolgte jedoch keine Zulassung in der EU.
Erst nach Einführung der ICI und deren Therapieerfolge in der metastasierten Situation konnte erstmals in der adjuvanten Situation der Einsatz des PD-1-Inhibitors Pembrolizumab das krankheitsfreie Überleben (DFS) mit nun auch akzeptablem Verträglichkeitsprofil verlängern.1
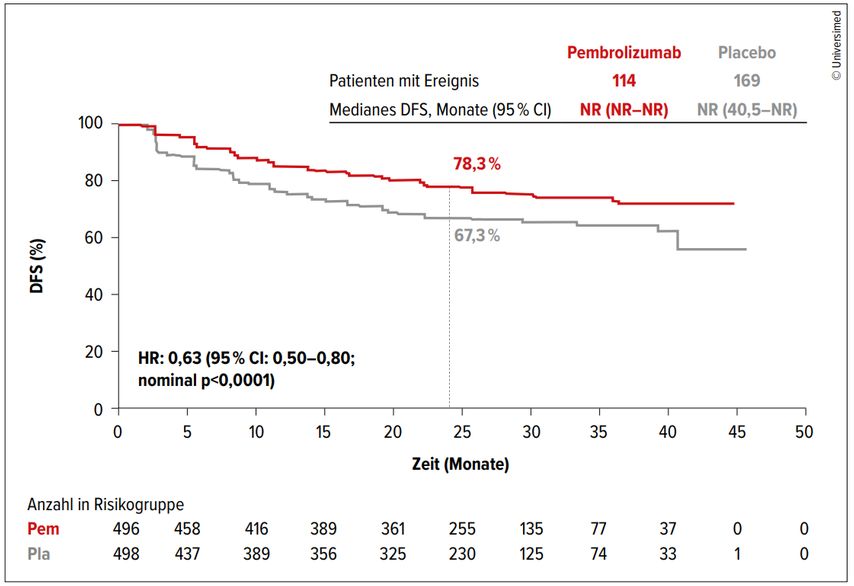
Zwischenzeitlich liegen außerdem die Daten zum 30-Monate-Follow-up der Zulassungsstudie KEYNOTE-564 vor.2 Eingeschlossen wurden Patienten mit intermediär-hohem und hohem Risiko für ein Rezidiv nach Nephrektomie sowie nach Metastasenresektion ohne Hinweis auf eine Resterkrankung. Die Randomisierung erfolgte 1:1 (Pembrolizumab vs. Placebo) für insgesamt ein Jahr. In der Follow-up-Analyse wurde der primäre Endpunkt des krankheitsfreien Überlebens bestätigt und im experimentellen Arm weiter verbessert, mit einer Hazard-Ratio (HR) von 0,63 (Abb. 1). Der Unterschied betrug 24 Monate nach Randomisierung ca. 10%. Der Nutzen war in allen Subgruppen zu beobachten, wobei vor allem Patienten nach Metastasenresektion (HR: 0,28) und Tumoren mit sarkomatoiden Eigenschaften (HR: 0,54) besonders von der adjuvanten Immuntherapie profitierten.
Das Gesamtüberleben ist im Trend ebenfalls verlängert (HR: 0,52), allerdings aufgrund der geringen Zahl an Ereignissen noch nicht statistisch signifikant. Das Nebenwirkungsprofil blieb im längeren Follow-up konstant und zeigte keine neuen Sicherheitsbedenken auf. Die Therapie war gut verträglich, sodass unter Abwägung von Nutzen und erwarteter Toxizität Pembrolizumab kürzlich die erste Zulassung in der adjuvanten Situation des klarzelligen Nierenzellkarzinoms nach Nephrektomie bzw. zusätzlicher Metastasenresektion bei Patienten mit intermediär-hohem und hohem Risiko für ein Rezidiv von der FDA in den USA als auch von der EU erhalten hat.
Der adjuvante Einsatz von Pembrolizumab sollte insbesondere bei sehr hohem Rezidivrisiko (pT4, N1, sarkomatoide Histologie, komplette Metastasektomie) nach persönlicher Diskussion indiziert sein, wenn auch noch weitere Fragen zur optimalen Therapiedauer, zu eventuellen Kombinationen und der Behandlung im Rezidiv nach adjuvanter Immuntherapie in zukünftigen Studien beantwortet werden müssen.
Erstlinientherapie des fortgeschrittenen und metastasierten klarzelligen RCC
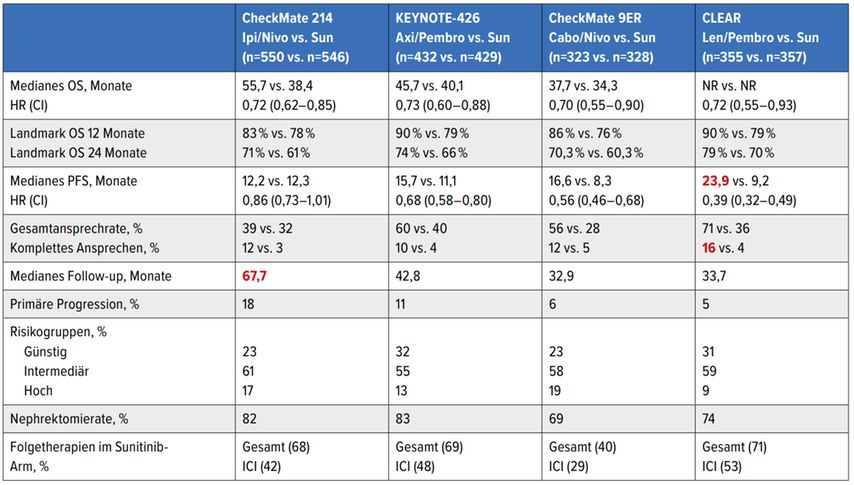
Kombinationstherapien mit ICI und TKI stellen aktuell den klaren Therapiestandard in allen Risikogruppen dar, wobei nach den aktuellen ESMO(Europäische Gesellschaft für Medizinische Onkologie)-Leitlinien in der Niedrigrisikogruppe drei Therapieoptionen und in der Gruppe mit intermediärem bzw. hohem Risiko vier verschiedene Kombinationen mit gleichem Empfehlungsgrad zur Verfügung stehen.3 Die empfohlenen Kombinationstherapien haben im Vergleich zu Sunitinib einen signifikanten Überlebensvorteil zeigen können.
Das längste Follow-up (5 Jahre) besteht für die ICI-Kombinationstherapie aus Ipilimumab und Nivolumab (CheckMate 214), mit einem medianen Gesamtüberleben von 55,7 Monaten. Der Vorteil war beim sarkomatoiden Subtyp besonders ausgeprägt (medianes Gesamtüberleben 48,6 Monate, HR: 0,46 vs. 14,2 Monate unter Sunitinib, Ansprechrate 61% vs. 23%).4 Speziell bei diesem Subtyp sollte differenzialtherapeutisch jene ICI-Kombination im Falle des Vorliegens eines intermediären bzw. hohen Risikos zum Einsatz kommen.
Die am rezentesten mit Daten gestützte Strategie ist eine Kombination von Pembrolizomab mit Lenvatinib, welche im Vergleich zu Sunitinib das progressionsfreie Überleben (HR: 0,39) über alle Risikogruppen hinweg sowie das Gesamtüberleben (HR: 0,72) bei intermediärem und hohem Risiko mit vergleichbarer Lebensqualität signifikant verlängerte.5 Bemerkenswert sind dabei eine Ansprechrate von 71% und eine Rate an kompletten Remissionen von 16%. Bei einem medianen progressionsfreien Überleben von 24 Monaten sind diese Ergebnisse im indirekten Vergleich unter Berücksichtigung aller Einschränkungen dieser Methodik bezüglich der Effektivität unerreicht.
Tabelle 1 bietet eine Übersicht über wichtige Ergebnisse von Studien zu ICI-Kombinationen in der Erstlinie. Aufgrund der hohen Ansprechraten und nach wie vor fehlender valider Biomarker für die optimale Therapieselektion sollte eine ICI/TKI-Kombination vor allem bei symptomatischer Erkrankung bzw. hohem Remissionsdruck primär zum Einsatz kommen.
Folgetherapien nach Versagen der Erstlinie
In dieser Situation gibt es nach wie vor keinen etablierten Therapiestandard. Die ESMO-Leitlinien empfehlen den Einsatz eines TKI, der nicht in der Erstlinientherapie verwendet wurde, für alle einsetzbaren TKI gibt es eine IIIB-Empfehlung.3
Eine kürzlich präsentierte Metaanalyse zu acht Zweitlinientherapien wies einen Benefit im Vergleich zu Placebo für alle Optionen aus, wobei die Kombination von Lenvatinib mit Everolimus sowie die Therapie mit Cabozantinib am besten abschnitten.6 Auf Basis älterer Phase-II-Daten werden die höchsten Ansprechraten durch die Kombination von Lenvatinib mit Everolimus auf Kosten der Toxizität erreicht, sodass diese bei symtomatischer Erkrankung bzw. hohem Remissionsdruck bevorzugt zum Einsatz kommen sollte.7
Tab. 1:Erstlinien-ICI-Kombinationsstudien beim metastasierten RCC im indirekten Vergleich. HR, Hazard-Ratio; NR, nicht erreicht; OS, Gesamtüberleben; PFS, progressionsfreies Überleben
Neue Therapiestrategien
90% der sporadischen Nierenzellkarzinome haben eine gestörte pVHL-Funktion (pVHL: Von-Hippel-Lindau-Tumorsuppressor-Protein). In diesen Fällen ist auch unter Normoxie der hypoxieinduzierte Transkriptionsfaktor (HIF) aktiviert mit daraus folgender Expression von Proliferations- und Angiogenesefaktoren, was wiederum die Tumorprogression begünstigt.8 Um diesen Transduktionsweg zu antagonisieren, sind aktuell mehrere HIF-2α-Inhibitoren in der klinischen Entwicklung. Am weitesten fortgeschritten ist der Wirkstoff Belzutifan, welcher bei Nierenzellkarzinomen im Rahmen der autosomal-dominant vererbten VHL-Erkrankung und bei im Median mit drei Therapielinien vorbehandelten sporadischen Nierenzellkarzinomen Ansprechraten von 49% bzw. 25% erzielte.9,10 Anämie und Hypoxie sind die häufigsten, allerdings gut supportiv zu beherrschenden Nebenwirkungen. Eine laufende randomisierte Phase-III-Studie testet prospektiv Belzutifan gegen Everolimus nach Versagen von Checkpoint-Inhibitoren und TKI.11
Vielversprechende Anprechraten wurden auch durch Nemvaleukin-α, ein neues Interleukin-2-Zytokin, bei multipel vorbehandelten Nierenzellkarzinomen als Monotherapie bzw. in Kombination mit Pembrolizumab erzielt.12 Die Wirkung beruht auf selektiver Bindung des „intermediate affinity receptor“ mit dadurch bevorzugter Aktivierung von CD8+-T-Zellen und natürlichen Killerzellen. In der Monotherapie wurden partielle Ansprechraten von 17,4% und Krankheitsstabilisierungen von 43,5% berichtet.
Literatur:
1 Choueiri TK et al.: N Engl J Med 2021; 384: 829-41 2Choueiri TK et al.: ASCO GU 2022; Abstr. #290 3 Powels T et al.: Ann Oncol 2021; 32: 1511-19 4 Tannir NM et al.: ASCO GU 2022; Abstr. #352 5 Motzer RJ et al.: N Engl J Med 2021; 384: 1289 6 Recio-Boiles V et al.: ASCO GU 2022; Abstr. #337 7 Motzer RJ et al.: Lancet Oncol 2015; 16: 1473-82 8 Cohen HT et al.: N Engl J Med 2005; 353: 2477-90 9 Jonash E et al.: N Engl J Med 2021; 385: 2036-46 10 Bauer TM et al.: ASCO GU 2021; Abstr. #273 11 Choueiri TK et al.: ASCO 2020; Abstr. #TPS5094 12 Calvo E et al.: ASCO GU 2022; Abstr. #330
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...