Was gibt es Neues zur neoadjuvanten Immuntherapie?
Autorin:
Priv.-Doz. OÄ Dr. Gudrun Absenger
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
Medizinische Universität Graz
E-Mail: gudrun.absenger@medunigraz.at
Die Immuntherapie mit Checkpoint-Hemmern ist ein fixer Bestandteil der palliativen Behandlung des metastasierten nichtkleinzelligen Lungenkarzinoms (NSCLC). Zukünftig wird sie auch in der kurativen Situation eine Rolle spielen, wie erste Daten zum adjuvanten und neoadjuvanten Einsatz zeigen. Nachfolgend mehr zur aktuellen Datenlage bei der Immuntherapie in neoadjuvanten Setting.
Keypoints
-
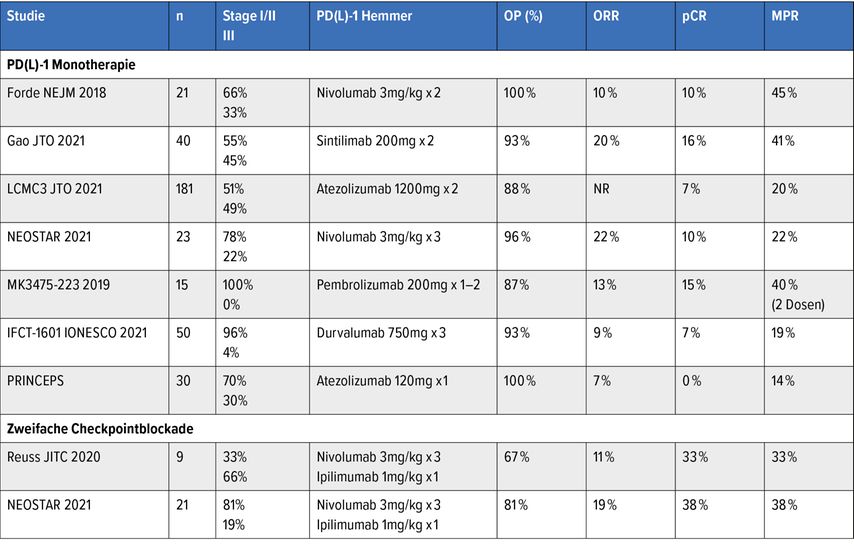
Die neoadjuvante Immuntherapie erzielt eine hohe Rate an pathologischer Tumorregression in Phase-II-Studien. Ein wesentlicher Endpunkt vieler Studien ist hier die „major pathological response“ (MPR), definiert als ≤10% vitale Tumorzellen im Resektat. Die MPR-Rate liegt bei der alleinigen Immuntherapie je nach Studie zwischen 14 und 45%.
-
Kombinationsstudien aus neoadjuvanter Chemo- und Immuntherapie zeigen tendenziell höhere Raten an pathologischer Response, dies betrifft MPR und pCR. PFS- und OS-Daten großer Phase-III-Studien liegen derzeit jedoch noch nicht vor.
Adjuvante vs. neoadjuvante Therapie im frühen Stadium
Die Prognose von Patienten mit frühem, resektablem NSCLC ist trotz Operation und Chemotherapie eingeschränkt. Die 5-Jahres-Überlebensrate liegt zwischen 80% im Stadium I und 40% im Stadium III. Durch eine (neo-)adjuvante Chemotherapie kann ein zusätzlicher Benefit von ca. 5% erreicht werden, wobei die adjuvante und die neoadjuvante Chemotherapie gleichzusetzen sind.
Vorteile einer neoadjuvanten Therapie sind die möglichst frühe Eradikation von Mikrometastasen und eine höhere Compliance der Patienten. Im Hinblick auf eine neoadjuvante Immuntherapie besteht der Vorteil eines in situ liegenden Tumors, der als Antigen-Pool fungiert und die Antwort des Immunsystems triggert. Durch Checkpoint-Inhibitor-Therapie aktivierte T-Zellen wirken somit nicht nur im Primärtumor, sondern können frühzeitig periphere Mikrometastasen eradizieren. Ein weiterer Vorteil der neoadjuvanten Therapie ist die Möglichkeit der pathologischen Responseevaluierung und damit die Einschätzung des Outcomes.
Ein adjuvanter Therapieansatz hingegen führt rasch zu einer Operation ohne das Risiko, dass diese durch präoperative Komplikationen verzögert wird. Den Patienten kann postoperativ die nötige Erholungszeit gegeben werden und eine adjuvante Immuntherapie könnte zeitlich länger gegeben werden als eine neoadjuvante.
Neoadjuvante Immuntherapie
Die derzeitige Datenlage zur neoadjuvanten Immuntherapie stützt sich mehrheitlich auf die Ergebnisse von Phase-I/II-Studien, eine Übersicht gibt Tabelle 1. Bereits am Meeting 2016 der European Society of Medical Oncology (ESMO) wurden erste Daten zur neoadjuvanten Therapie mit dem „Programmed cell death protein 1“(PD-1)-Hemmer Nivolumab präsentiert. In der Studie von Ford et al. erhielten 21 Patienten zwei Zyklen Nivolumab 28 bzw. 14 Tage vor der Operation und danach eine „Standard of care“(SoC)-Behandlung. Es zeigte sich eine eindrucksvolle Tumorregression, drei Patienten hatten eine pathologisch komplette Remission (pCR). Als Maßstab für die pathologische Remission wurde die „major pathological response“ (MPR) definiert, diese entspricht ≤10% vitalen Tumorzellen im Resektat. Die MPR-Rate lag bei 45%.
Die LCMC3 ist mit 181 Patienten die größte der Phase-II-Studien. Sie untersucht den Einsatz von zwei Zyklen Atezolizumab neoadjuvant gefolgt von Resektion mit der Option, die Immuntherapie für insgesamt ein Jahr fortzuführen. Die MPR-Rate lag in der Patientengruppe ohne aktivierende Treibermutationen bei 21%, 7% hatten eine pCR. In der Biomarker-Analyse zeigte sich ein Zusammenhang von MPR und einer PD-L1-Expression von ≥50%. Hingegen hatten Patienten mit Mutationen im bekannten, negativ prädiktiven Marker Serin-/Threonin-Kinase 11 (STK11) deutlich geringere Tumorregressionen. In einer explorativen Analyse war eine Assoziation zwischen der MPR und dem krankheitsfreien Überleben (DFS) bzw. Gesamtüberleben (OS) zu sehen, Patienten, die eine MPR erreichen konnten, hatten ein deutlich längeres DFS und OS.
In der rezent am Meeting 2021 der ESMO präsentierten Phase-II-Studie IFCT-1601 IONESCO wurde der PD-L1-Hemmer Durvalumab im neoadjuvanten Setting untersucht. 46 Patienten erhielten drei Zyklen Durvalumab 750mg neoadjuvant und wurden anschließend operiert. Der primäre Endpunkt war die R0-Resektionen, eine solche konnte bei 89% der Patienten erreicht werden. Weiters erfolgte eine Auswertung der residualen vitalen Tumorzellen (%RVT) im Resektat verblindet durch zwei unabhängige, Pathologen. Die Autoren der Studie konnten zeigen, dass die pathologische Response, gemessen als RVT, ein unabhängiger prognostischer Faktor für das DFS und OS der Patienten ist. Der Einsatz einer dualen neoadjuvanten Immuntherapie wurde in der NEOSTA-Studie untersucht. 44 Patienten erhielten entweder 3x Nivolumab oder 3x Nivolumab und den CTLA-4(„cytotoxic T-lymphocyte-associated protein 4“)-Hemmer Ipilimumab neoadjuvant, wurden anschließend operiert und erhielten danach eine SoC-Therapie. Die MPR-Rate war unter Nivolumab 17%, unter der Kombination 33%, wobei vor allem die Rate an pCR unter Nivolumab und Ipilimumab mit 29% sehr hoch war. Ein Update dieser Studie zu Patienten mit Behandlungsversagen wurde am Meeting der American Society of Clinical Oncology (ASCO) letztes Jahr präsentiert. Insgesamt hatten 11 von 44 Patienten einen radiologisch oder histologisch gesicherten Progress, zwei Patienten waren verstorben. Auffällig war, dass die progedienten Patienten zu 73% TKI(Tyrosin-Kinase-Inhibitor)-sensitive Mutationen aufwiesen (5 Patienten: epidermaler Wachstumsfaktorrezeptor [EGFR], 1: anaplastische Lymphomkinase [ALK], 1: BRAF und 1: RET).
Neoadjuvante Immunchemotherapie
Die Kombination aus Chemotherapie und Immuntherapie ist – mit Ausnahme bei Patienten mit sehr hoher PD-L1-Expression – in der palliativen Behandlung des NSCLC zur Standardtherapie geworden. Auch im neoadjuvanten Konzept werden derzeit einige Studien durchgeführt, erste Daten liegen bereits vor.
In der Phase-II-Studie NADIM erhielten 46 Patienten mit resektablem NSCLC im Stadium IIIA drei Zyklen einer neoadjuvanten Kombination aus Nivolumab und Chemotherapie und wurden anschließend operiert. Postoperativ war die Fortführung der Immuntherapie mit Nivolumab für insgesamt ein Jahr vorgesehen. Radiologisch erreichten zwei Patienten (4,3%) eine CR und 32 (69,6%) eine partielle Remission (PR). Die pathologische Response war mit einer MPR-Rate von 83% sehr eindrucksvoll, 59% der Patienten hatten eine pCR. Auf der World Conference on Lung Cancer (WCLC) 2021 wurden PFS- und OS-Daten der NADIM-Studie präsentiert: Nach 42 Monaten lag das PFS bei 69% und das OS bei 78,9%. Wenn die Patientenzahl auch sehr gering ist, unterstreichen diese Ergebnisse die hohe Wirksamkeit einer Kombinationstherapie.
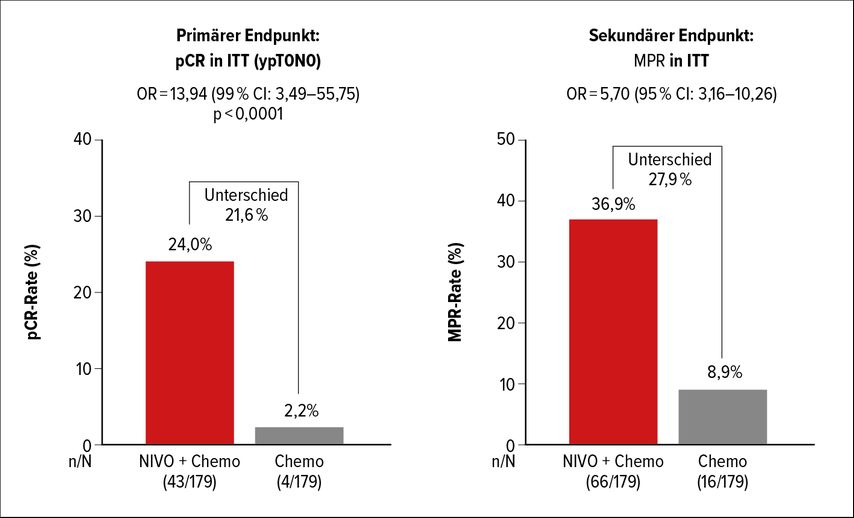
Mehrere Phase-III-Studien, die eine neoadjuvante Immunchemotherapie-Kombination untersuchen, sind derzeit noch im Status der Rekrutierung. Erste Ergebnisse liegen von CheckMate 816 vor und wurden letztes Jahr am Meeting der American Association for Cancer Research (AACR) präsentiert. Patienten mit resektablem NSCLC im Stadium IB bis IIIA ohne aktivierende Treibermutationen erhielten im Rahmen der Studie drei Zyklen platinbasierter Chemotherapie in Kombination mit Nivolumab oder eine platinbasierte Chemotherapie alleine und wurden anschließend innerhalb von 6 Wochen operiert. Postoperativ war eine Chemo- oder eine Radiatio möglich. Der primäre Endpunkt pCR war positiv mit einer pCR-Rate von 24% unter der Kombination vs. 2,2% unter Chemotherapie (OR:13,94; 99% CI: 3,49–55,75; p<0,0001), die MPR-Rate lag bei 36,9% vs. 8,9% (Abb.1). Der pCR-Vorteil war unabhängig von Histologie, PD-L1-Status und Tumormutationslast (TMB). Jedoch zeigte die Clearance von zirkulierender Tumor-DNA (ctDNA) einen deutlichen Zusammenhang mit der pathologischen Response. Es erfolgten am Tag 1 jedes Therapiezyklus ctDNA-Bestimmungen.Eine ctDNA-Clearance lag vor, wenn initial positive ctDNA beim dritten Zyklus nicht mehr nachweisbar war. Patienten mit ctDNA-Clearance hatten unter Immunchemotherapie zu 46% (11/24) eine pCR, jedoch konnte kein Patient (0/19) ohne ctDNA-Clearance eine pCR erreichen.
Abb. 1: Erste Ergebnisse von CheckMate 816: Patienten mit resektablem NSCLC im Stadium IB–IIIA ohne aktivierende Treibermutationen, behandelt mit drei Zyklen platinbasierter Chemotherapie in Kombination mit Nivolumab vs. platinbasierte Chemotherapie alleine
Fazit
Zusammenfassend ist festzustellen, dass die derzeitigen Daten der neoadjuvanten Immuntherapie sehr vielversprechend sind, Ergebnisse großer Phase-III-Studien – v.a. hinsichtlich PFS und OS – stehen noch aus. Es ist jedoch anzunehmen, dass die Immun(chemo)therapie zukünftig im Behandlungsalgorithmus des NSCLC im Frühstadium eine wesentliche Rolle spielen wird.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...