Von perioperativer Systemtherapie bisKRAS-Inhibition
Autor:
Dr. Timm Reißig
Assistenzarzt/Clinician Scientist
Innere Klinik (Tumorforschung)
Westdeutsches Tumorzentrum (WTZ)
Universitätsmedizin Essen
E-Mail: timm.reissig@uk-essen.de
Die Prognose beim duktalen Adenokarzinom des Pankreas (PDAC) ist mit einer 5-Jahres-Überlebens-Rate von ca. 10–12% leider weiterhin schlecht. Positiv hervorzuheben sind jedoch die vielen Studien, die Therapieverbesserungen erreichen konnten und weitere interessante Therapieansätze untersuchen. Hier sollen daher die aktuellen Therapien, neuere Entwicklungen und kommende Substanzen/Studienfür das PDAC dargestellt werden.
Keypoints
-
Die perioperative Systemtherapie und/oder Strahlentherapie stehen in den lokalisierten Stadien im Mittelpunkt des Forschungsinteresses.
-
In der Behandlung der metastasierten Erkrankung zeichnet sich mit NALIRIFOX eine Alternative in der Erstlinie ab.
-
Die ersten Daten zu (spezifischen) KRAS-Inhibitoren sind vielversprechend und könnten die Behandlung für bis zu 90% der Patient:innen grundlegend verändern.
Die Rolle der perioperativen Therapie bei lokalisierter Erkrankung
Resektables PDAC
Beim resektablen PDAC ist die Resektion mit adjuvanter systemischer Chemotherapie der Therapiestandard. Seit einigen Jahren wird die Rolle perioperativer Systemtherapien untersucht. Wichtig zu erwähnen ist, dass die Resektabilität nicht mehr ausschließlich anatomisch, sondern zusätzlich biologisch (CA19–9-Werte) und patient:innenbezogen (Performance-Status [z.B. ECOG]) definiert wird.
Beim resektablen PDAC ist das Therapieziel die Heilung durch eine R0-Resektion mit adjuvanter FOLFIRINOX-Chemotherapie (Folinsäure, 5-FU, Irinotecan und Oxaliplatin).1,2 Patient:innen, die für FOLFIRINOX nicht geeignet sind, können Gemcitabin und Capecitabin erhalten (ESPAC-4).3
Erstmals wurde in der adjuvanten Therapie ein individuelles Neoantigen-Vakzin mit dem PD-L1-Inhibitor Atezolizumab und modifiziertem FOLFIRINOX kombiniert.
Von 16 Patient:innen entwickelten acht Patient:innen neoantigenspezifische T-Zellen (die „Responder“). Nach einem 18-monatigen Follow-up wurde das mediane rezidivfreie Überleben (mRFS) in der Responder-Gruppe nicht erreicht, während die Non-Responder ein mRFS von 13,4 Monaten aufwiesen (p=0,003).4
Daneben wurden in den letzten Jahren verschiedene perioperative Systemtherapien untersucht. Einige Studien konnten keinen Vorteil zeigen (Studien: PREOPANC-1 für resektable Tumoren, SWOG S1505), wohingegen z.B. die Studie NEONAX einen positiven Trend der perioperativen Therapie zeigen konnte.5 Aufgrund der bisher uneindeutigen Ergebnisse bleibt die perioperative Systemtherapie Gegenstand klinischer Studien (u.a. Alliance A021806, PREOPANC-3).
Grenzwertig resektables PDAC
Im Fall der grenzwertig resektablen PDAC konnten mehrere Studien zeigen, dass diese perioperativ behandelt werden sollten. Nachdem die Studie PREOPANC-1 den Nutzen einer neoadjuvanten Radiochemotherapie (RCT) mit Gemcitabin gegenüber einer sofortigen Resektion zeigen konnte,6 untersuchte die Studie PREOPANC-2 eine totale neoadjuvante Therapie mit FOLFIRINOX gegenüber einer RCT mit Gemcitabin. Diese konnte jedoch keinen signifikanten Unterschied im medianen Gesamtüberleben (mOS: 21,9 vs. 21,3 Monate) oder bei den Resektionsraten (77% vs. 75%) zeigen.7
In der ESPAC-5F-Studie wurde eine sofortige Operation mit einer neoadjuvanten Behandlung mit Gemcitabin und Capecitabin (G+C), FOLFIRINOX oder Capecitabin-basierter CRT verglichen. Die neoadjuvante Behandlung verlängerte das Überleben (1-Jahres-DFS: 39% mit sofortiger Operation gegenüber 78% unter G+C, 84% unter FOLFIRINOX und 60% unter CRT).8
Folglich ist eine präoperative Kombinationstherapie beim grenzwertig resektablen PDAC sinnvoll; die optimale Induktionstherapie bleibt jedoch unklar und ist Studiengegenstand. Die ESMO-Leitlinie empfiehlt eine Kombinationschemotherapie mit FOLFIRINOX oder Gemcitabin mit nab-Paclitaxel (Gem/nab-P) und Radiotherapie.9
Lokal fortgeschrittenes PDAC
Beim lokal fortgeschrittenen PDAC (LAPC) kann die neoadjuvante Systemtherapie ebenfalls helfen, eine sekundäre Resektion zu erreichen und das Überleben zu verlängern. Aktuell wird seitens der ESMO neoadjuvantes Gem/nab-P oder FOLFIRINOX empfohlen. Bei Ansprechen (Senkung von CA19–9, klinische Verbesserung und Verkleinerung des Tumors) sollte eine chirurgische Exploration mit Resektion erwogen und die Entscheidung hierzu in einem multidisziplinären Tumorboard getroffen werden.
Einen Hinweis, dass eine maximale Systemtherapie nicht immer notwendig ist, könnte die noch nicht vollpublizierte NEOPAN-Studie liefern. Sie verglich Gemcitabin mit FOLFIRINOX, der primäre Endpunkt war das progressionsfreie Überleben (PFS). FOLFIRINOX konnte zwar ein signifikant längeres medianes PFS erzielen (9,7 vs. 7,7 Monate; p=0,0462), das mediane OS war jedoch ähnlich (15,7 vs. 14,9 Monate; p=0,7183). Sekundäre Resektionen waren selten und FOLFIRINOX konnte in den Folgelinien gegeben werden, was die Überlebensdaten zu einem gewissen Grad verzerren dürfte.10
Zusammengefasst spielen perioperative Therapien insbesondere im Fall der grenzwertig resektablen und lokal fortgeschrittenen Pankreaskarzinome eine wichtige Rolle; für primär resektable PDAC ist die Rolle noch nicht abschließend geklärt.
KRAS-Inhibition als nächster Schritt beim metastasierten PDAC
Im Fall einer metastasierten Erkrankung bilden weiterhin FOLFIRINOX und Gem/nab-P den Therapiestandard. Das mOS lag in den Zulassungsstudien bei 11,1 Monaten mit FOLFIRINOX11 und 8,5 Monaten mit Gem/nab-P12. Die Phase-III-Studie NAPOLI-3 verglich erstmals zwei Kombinationstherapien (Gem/nab-P vs. NALIRIFOX) in der Erstlinientherapie beim metastasierten PDAC. NALIRIFOX konnte hierbei ein signifikant längeres mOS gegenüber Gem/nab-P erreichen (11,1 vs. 9,2 Monate; p=0,036).13 Die Dosis von Oxaliplatin war geringer und der 5-FU-Bolus wurde nicht gegeben, wodurch die Therapie weniger toxisch war. NALIRIFOX wird somit voraussichtlich eine weitere Alternative in der Erstlinientherapie.
Beim PDAC gibt es weiterhin keine regelhafte Anwendung von Immun- oder zielgerichteten Therapien. Der EGFR-Inhibitor Erlotinib ist zwar mit Gemcitabin von der EMA zugelassen, wird aufgrund des geringen Überlebensvorteils (zwei Wochen) aber selten genutzt.14 Neben dieser allen Patient:innen zugänglichen Option können drei Subgruppen von einer molekular-zielgerichteten Therapie profitieren: 5–7% der Patient:innen mit einer Keimbahnmutation im BRCA1/2-Gen können nach einer platinhaltigen Induktionstherapie eine Erhaltungstherapie mit Olaparib erhalten.15,16Für Patient:innen mit einem MSI-high/MMR-defizienten Tumor (ca. 1% der Patient:innen) kann eine Therapie mit Pembrolizumab sinnvoll sein,17 wobei jedoch keine EMA-Zulassung vorliegt.Selten (<1%) kommen NTRK-Fusionen vor, die durch Larotrectinib oder Entrectinib adressiert werden können.18
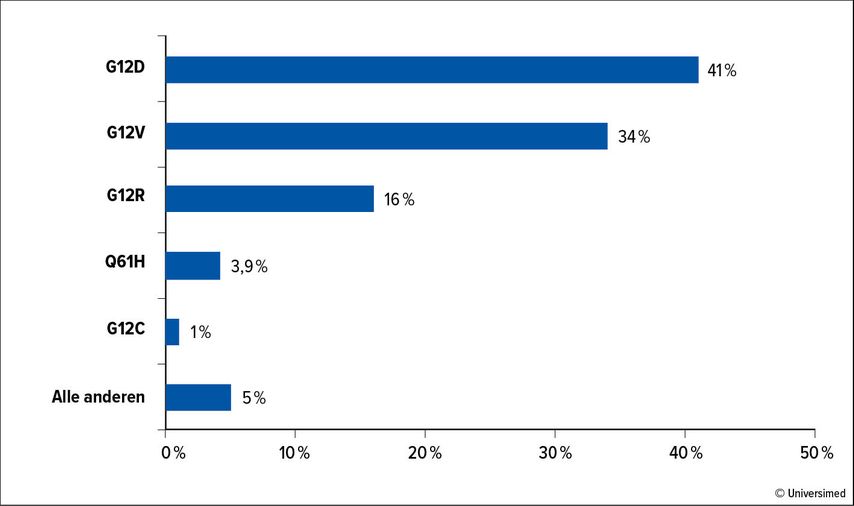
Weitere zielgerichtete Ansätze werden vermehrt entwickelt und untersucht. Besonders hervorzuheben sind (spezifische) KRAS-Inhibitoren, da bis zu 90% der Patient:innen hiervon profitieren könnten. Aufgrund der besseren Inhibition unterschiedlicher Subtypen (Abb. 1) werden Inhibitoren für einzelne Subtypen entwickelt.
Für KRAS-G12C-Mutationen wurden Adagrasib und Sotorasib bei PDAC-Patient:innen untersucht. Sotorasib konnte in einer Phase-I/II-Studie für eine reine PDAC-Patient:innen-Kohorte ein mOS von 6,9 Monaten zeigen. Dies ist vergleichbar mit den üblichen Zweitlinientherapien nal-Irinotecan und 5-FU (Studie NAPOLI-1; mOS: 6,2 Monate) oder Oxaliplatin, Folinsäure und 5-FU (Studie CONKO-003; mOS: 5,9 Monate).19,20 Insgesamt war die Therapie gut verträglich; häufigste Grad-3-Nebenwirkungen waren Diarrhöen und Fatigue (je 5% der Patient:innen). Für KRAS-G12D- und KRAS-G12V-Mutationen sind weitere spezifische Inhibitoren in der Entwicklung. Damit würden zusammen 74% der KRAS-mutierten PDAC zielgerichtet behandelbar. Bisher liegen vielversprechende präklinische Daten vor.21,22
Daneben gibt es erste, nicht vollpublizierte Phase-I-Daten zu dem pan-RAS-Inhibitor RMC-6236. In einer Kohorte von 46 stark vorbehandelten Patient:innen (1–7 Linien, im Median 3) zeigte RMC-6236 bei 20% der Patient:innen ein partielles Ansprechen und bei 67% eine stabile Erkrankung. In dieser stark vorbehandelten Patient:innengruppe ist dies ein beachtliches Ergebnis.23
Fazit
Die Forschung am Pankreaskarzinom konnte in den vergangenen Jahren Fortschritte erzielen. Insbesondere die Adressierbarkeit von KRAS-Mutationen könnte die Behandlung grundlegend verändern. Ob die Substanzen jedoch wirksam sind, werden die klinischen Studien der kommenden Jahre zeigen.
Es bleibt daher wichtig, Patient:innen in klinische Studien einzuschließen und so die Behandlung und Prognose für Patient:innen mit Pankreaskarzinom langfristig zu verbessern.
Literatur:
1 Conroy T et al.: N Engl J Med 2018; 379(9): 2395-406 2 Conroy T et al.: JAMA Oncol 2022; 8(11): 1571-8 3 Neoptolemos JP et al.: Lancet 2017; 389(10073): 1011-24 4 Rojas LA et al.: Nature 2023; 618(7963): 144-50 5 Seufferlein T et al.: Ann Oncol 2023; 34(1): 91-100 6 Versteijne E et al.: J Clin Oncol 2022; 40(11): 1220-30 7 Koerkamp BG et al.: Ann Oncol 2023; 34(Suppl. 2): S1254-35 8 Ghaneh P et al.: Lancet Gastroenterol Hepatol 2023; 8: 157-68 9 Conroy T et al.: Ann Oncol 2023; 34(11): 987-1002 10 Ducreux MP et al.: Ann Oncol 2023; 34: S894-5 11 Conroy T et al.: N Engl J Med 2011; 364(19): 1817-25 12 Von Hoff DD et al.: N Engl J Med 2013; 369(18): 1691-703 13 Wainberg ZA et al.: Lancet 2023; 402(10409): 1272-81 14 Moore MJ et al.: J Clin Oncol 2007; 25: 1960-6 15 Golan T et al.: N Engl J Med 2019; 381(4): 317-27 16 Kindler HL et al.: J Clin Oncol 2022; 40: 3929-39 17 Marabelle A et al.: J Clin Oncol 2020; 38: 1-10 18 Drilon A et al.: N Engl J Med 2018; 378(8): 731-9 19 Wang-Gillam A et al.: Eur J Cancer 2019; 108: 78-87 20 Oettle H et al.: J Clin Oncol 2014; 32(23): 2423-9 21 Kemp SB et al.: Cancer Discov 2023; 13(2): 298-311 22 Hallin J et al.: Nat Med 2022; 28(10): 2171-82 23 Arbour KC et al.: Ann Oncol 2023; 34: S458 24 Waters AM, Der CJ: KRAS: Cold Spring Harb Perspect Med 2018; 8: a031435
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...